
XAXANINA
.pdf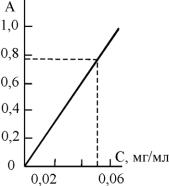
Оборудование и реактивы
Фотоколориметр.
Стеклянные кюветы на 3,0 см, 2 шт.
Цилиндры: на 10 мл, 1 шт.; на 25 мл, 1 шт.
Мерные колбы на 50 мл, 8 шт.
Азотная кислота, разбавленная 1:1.
Роданид калия, 10%-ный раствор.
Стандартный раствор железа (III), содержащий 0,1 мг железа в 1 мл.
Навеску 0,8640 г NH4Fe(SO4)2∙12H2O растворяют в мерной колбе на 1000 мл в воде,
подкисленной 25 мл HNO3 конц.
Описание определения
Для построения калибровочного графика в мерные колбы на 50 мл добавьте пипет-
кой последовательно 0,5; 1,0; 2,0; 3,0 мл стандартного раствора железа (III), затем в каж-
дую колбу прилейте по 2 мл азотной кислоты (1:1), по 10 мл роданида калия, воды до мет-
ки и перемешайте.
Измерьте оптическую плотность окрашенного раствора в кювете длиной 3 см при
430 нм, используя подходящий светофильтр относительно нулевого раствора.
По полученным данным постройте калибровочный график А = f(C), на оси ординат нанесите значения оптической плотности, а на оси абсцисс - соответствующие им значе-
ния концентрации раствора в мг/мл (рис.1).
Рис.1. Калибровочный график для определения железа
41

Зная оптическую плотность исследуемого раствора железа, по графику найдите его концентрацию.
Для определения железа в исследуемом растворе, налитом в колбу на 50 мл, до-
бавьте для подкисления 2 мл азотной кислоты (1:1), 10 мл роданида калия, воды до метки и перемешайте. Наполните раствором кювету и измерьте оптическую плотность при тех же условиях, при которых был получен калибровочный график.
Зная оптическую плотность анализируемого раствора, найдите по графику концен-
трацию Fe3+ в мг/мл. Умножив ее на объем всего анализируемого раствора (50 мл), вычис-
лите общее количество железа.
Б. Фотометрическое определение соединений марганца (VII) методом ограничивающих растворов
Метод ограничивающих растворов основан на том, что для определения концен-
трации неизвестного раствора Сх готовят два раствора известной концентрации таких,
чтобы С1 < Cx < C2, и измеряют оптическую плотность растворов. Если выполняется закон Бугера - Ламберта - Бера, то справедливы следующие соотношения:
А1 C1 k C1;Аx Cx k Cx ;А2 C2 k C2.
Комбинируя первое и второе, а также первое и третье уравнения, можно получить
k |
А2 А1 |
|
Аx А1 |
. |
||||
|
|
|||||||
|
C |
2 |
C |
|
C |
x |
C |
|
|
|
1 |
|
|
1 |
|
||
Окончательно имеют
Cx C1 Аx А1 C2 C1 .
А2 А1
Погрешность определения концентрации методом ограничивающих растворов тем меньше, чем ближе концентрации стандартных растворов к определяемой концентрации анализируемого раствора.
Преимущества метода: относительная простота и малая трудоемкость при анали-
зе отдельных образцов.
Недостатки метода: его часто невозможно использовать, если анализируемый образец имеет сложный состав (присутствие "третьего" компонента). Он становится тру-
доемким при анализе большой партии образцов. Метод предполагает линейную зависи-
мость между аналитическим сигналом и содержанием вещества, по крайней мере, в ин-
42
тервале между двумя ограничивающими растворами. Он не пригоден для анализа предельно чистых веществ на содержание в них микропримесей.
Оборудование и реактивы
Фотоэлектроколориметр. Бюретка, 1 шт.
Колбы мерные на 50 мл, 4 шт.
Стандартный раствор KMnO4, содержащий 0,316 г соли в 1 л. Дистиллированная вода.
Описание определения
Доведите объем задач, помещенных в мерные колбы на 50 мл, дистиллированной водой до метки и тщательно перемешайте.
В серию заранее пронумерованных мерных колб емкостью 50 мл из бюретки последовательно внесите 1, 2, 3, 4 мл стандартного раствора перманганата калия, доведите дистиллированной водой объем раствора до метки и тщательно перемешайте.
По формуле mi C0 Vi , где mi - содержание перманганата калия в растворе, мг; C0 -
концентрация стандартного раствора (0,316 мг/мл); Vi - объем стандартного раствора, вносимого в колбу, мл; i - номер колбы, рассчитайте содержание перманганата калия в приготовленных растворах и результаты расчета внесите в форму табл.6 (строка 2).
Форма таблицы 6
Результаты фотометрирования растворов
№ |
|
|
Номер |
|
Задача |
Задача |
|
Параметр |
|
колбы |
|
||||
п/п |
|
|
№1 |
№2 |
|||
|
1 |
2 |
3 |
4 |
|||
|
|
|
|
||||
1 |
Объем стандартного раствора, мл |
1 |
2 |
3 |
4 |
|
|
2 |
Содержание перманганата калия mi в |
|
|
|
|
|
|
|
растворе, мг |
|
|
|
|
|
|
3 |
Оптическая плотность A |
|
|
|
|
|
|
4 |
Содержание KMnO4, рассчитанное методом |
|
|
|
|
|
|
|
ограничивающих растворов, мг |
|
|
|
|
|
|
5 |
Относительная погрешность определения |
|
|
|
|
|
|
|
методом ограничивающих растворов, % |
|
|
|
|
|
|
6 |
Содержание KMnO4, определенное методом |
|
|
|
|
|
|
|
калибровочного графика, мг |
|
|
|
|
|
|
7 |
Относительная погрешность определения |
|
|
|
|
|
|
|
методом калибровочного графика, % |
|
|
|
|
|
|
43
Измерьте оптическую плотность задач и растворов при длине волны 550 нм, ис-
пользуя для этого кювету с толщиной слоя 5 см, а в качестве раствора сравнения - дистил-
лированную воду. Результаты измерений внесите в форму табл.6 (строка 3).
По формуле рассчитайте Сх:
|
|
|
|
|
|
|
|
А |
x |
А |
min |
|
|
|
C |
x |
C |
0 |
|
|
V |
|
|
|
V |
V |
, |
||
|
|
|
|
|||||||||||
|
|
|
min |
|
Аmax Аmin |
max |
min |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
где Cx - содержание определяемого вещества в задаче, мг; C0 - концентрация стандартного раствора (0,316 мг/мл); А - оптическая плотность задачи; Amin - ближай-
шая, не превосходящая Ax, опти-ческая плотность раствора, содержащего Vmin мл стандартного раствора; Amax - ближайшая, превосходящая Ax, оптическая плотность раствора, содержащего Vmax мл стандартного раствора перманганата калия (для усло-
вий лабораторной работы Vmax – Vmin = 1 мл), рассчитайте содержание перманганата в задаче. Результаты расчета внесите в форму табл.6 (строка 4).
По результатам измерений постройте график зависимости оптической плотности от содержания перманганата калия в растворе (калибровочный график А f mi ) и по нему,
исходя из оптической плотности задачи Ax, определите содержание перманганата в зада-
че. Результаты определения внесите в форму табл.6 (строка 6).
По формуле отн |
|
mT mx |
|
100% |
найдите относительную погрешность определе- |
|
|
||||
|
mT |
|
|||
|
|
|
|
|
ния методом ограничивающих растворов и методом калибровочного графика. Для этого уз-
найте у преподавателя истинное содержание mT перманганата калия в задачах. Результаты расчетов внесите в форму табл.6 (строки 5 и 7 соответственно). Сравните методы огра-
ничивающих растворов и калибровочного графика. Какой из них является более точным?
В. Фотометрическое определение соединений хрома (VI) в сточных водах методом добавок
Метод добавок заключается в том, что исследуемый образец делится на несколько частей. Затем во все части, кроме одной, дополнительно вводится в известном количестве определяемый компонент. Для всех частей в одинаковых условиях измеряется оптическая плотность. Строится график зависимости оптической плотности от количества добавки и экстраполируется до пересечения с осью Х. Точка пересечения будет соответствовать со-
держанию определяемого компонента.
Достоинства метода: незаменим при анализе объектов, имеющих сложный со-
став или состав которых меняется со временем, например, сточных вод, уникальных еди-
44
ничных объектов, например, лунного грунта, для которых крайне трудно или практически невозможно приготовить стандартные растворы.
Недостатки метода: пригоден для анализа отдельных образцов, но становится крайне трудоемким при анализе партии образцов, может применяться только при стро-
гом выполнении закона Бугера - Ламберта - Бэра.
Оборудование и реактивы
Фотоэлектроколориметр.
Пипетки градуированные: на 1 мл - 1 шт.; на 10 мл - 1 шт.
Колбы мерные: на 100 мл - 1 шт.; на 25 мл - 5 шт.
Стандартный раствор бихромата калия, содержащий 15 г соли в 1 л;
Дистиллированная вода.
Описание определения
Доведите объем задачи, помещенной в мерную колбу на 100 мл, дистиллированной водой до метки и тщательно перемешайте.
В серию заранее пронумерованных мерных колб емкостью 25 мл пипеткой отбери-
те по 10 мл задачи, а затем во вторую колбу добавьте 0,1 мл, в третью - 0,2 мл, в четвер-
тую - 0,3 мл, в пятую - 0,4 мл стандартного раствора. Во всех колбах, в том числе и в пер-
вой, доведите объем раствора дистиллированной водой до метки и тщательно перемешайте.
Измерьте оптическую плотность растворов на длине волны 430 нм, используя для этого кювету с толщиной слоя 5 см, а в качестве раствора сравнения - дистиллированную воду. Результаты измерений занесите в форму табл.7.
Форма таблицы 7
Результаты фотометрирования растворов
Номер мерной колбы |
1 |
2 |
3 |
4 |
5 |
Объем добавки стандартного |
0 |
0,1 |
0,2 |
0,3 |
0,4 |
раствора, мл |
|
|
|
|
|
Оптическая плотность раствора |
|
|
|
|
|
Объем стандартного раствора, |
|
|
|
|
|
эквивалентный содержанию хрома |
|
|
|
|
|
в задаче Vx, мл |
|
|
|
|
|
Содержание хрома в задаче Cx, мг |
|
|
|
|
|
Относительная погрешность |
|
|
|
|
|
определения, % |
|
|
|
|
|
45 |
|
|
|
|
|
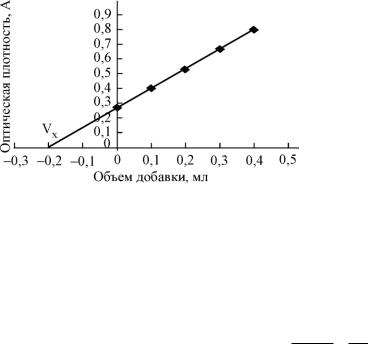
По результатам измерений постройте график зависимости оптической плотности от объема добавки. Экстраполируя график до пересечения с осью абсцисс (рис.2), определи-
те объем стандартного раствора, эквивалентный содержанию хрома в задаче Vx. Результат занесите в форму табл.7.
Рис.2. Зависимость оптической плотности от объема добавки стандартного раствора
По формуле Сх С0 | Vx | n , где C0 - концентрация стандартного раствора
(15 мг/мл); Vx - объем стандартного раствора, соответствующий точке пересечения графи-
ка с осью абсцисс (мл); n - число аликвотных частей, равное n Vзадачи 100 10 ; Vзадачи -
Vпробы 10
объем задачи (100 мл); Vпробы - объем пробы (объем пипетки 10 мл), рассчитайте содержа-
ние хрома в задаче. Результат занесите в форму табл.7.
По формуле отн |
|
СT Cx |
|
100% |
рассчитайте относительную погрешность опреде- |
|
|
||||
|
CT |
|
|||
|
|
|
|
|
ления. Для этого узнайте у преподавателя истинное содержание хрома в задаче CT. Ре-
зультат занесите в форму табл.7.
46
Работа № 6
Определение меди в виде аммиачного комплекса
Оборудование и реактивы
Фотоколориметр.
Стеклянные кюветы на 2 см, 2 шт.
Цилиндр на 10 мл, 1 шт.
Пипетка на 10 мл, 1 шт.
Мерные колбы на 50 мл, 8 шт.
Аммиак разбавленный 1:3.
Серная кислота концентрированная (ρ = 1,84).
Стандартный раствор Cu2+, содержащий 1 мг/мл, готовят: 3,9270 г х.ч. CuSO4∙5H2O
растворяют в мерной колбе на 1000 мл в небольшом количестве воды, приливают 5 мл концентрированной серной кислоты и воды до метки.
Метод калибровочного графика
Определение содержания ионов меди в природных водах представляет практиче-
ский интерес. Соли меди широко применяют в сельском хозяйстве как ядохимикаты.
Кроме того, ион Сu2+ входит в состав медных микроудобрений. После дождей и таяния снега медь может попадать в природные источники питьевой воды. Избыток меди в орга-
низме разрушает витамины С и А, способствует образованию токсичных продуктов окис-
ления липидов.
Фотометрическое определение меди основано на образовании иона Cu2+ с аммиа-
ком комплекса [Cu(NH3)4]2+, окрашенного в интенсивно-синий цвет. Максимальное по-
глощение света окрашенным раствором λmax = 610 нм. Чувствительность метода составля-
ет 0,01 мг меди в 25 мл конечного раствора при толщине фотометрического слоя 2 см.
Измерение оптической плотности эталонов и исследуемых растворов осуществля-
ют по отношению к нулевому раствору сравнения.
Нулевой раствор приготавливают следующим образом: 10 мл разбавленного (1:3)
аммиака NH4OH переносят в мерную колбу на 50 мл, добавляют 1 каплю концентриро-
ванной серной кислоты, разбавляют дистиллированной водой до метки и перемешивают.
Результаты фотометрических измерений заносят в форму, аналогичную форме
табл.5.
47
Описание определения
Для построения калибровочного графика в пять мерных колб на 50 мл отмерьте пипеткой соответственно 1, 2, 3, 5 и 8 мл стандартного раствора Cu2+. В каждую из колб прибавьте по 10 мл разбавленного (1:3) NH4OH, дистиллированной воды до метки и пере-
мешайте.
Измерив оптическую плотность всех растворов, постройте калибровочный график.
При этом по оси абсцисс отложите известные концентрации ионов Cu2+ (т.е. 0,02; 0,04;
0,06; 0,1; 0,16 мг меди в 1 мл), а по оси ординат - соответствующие им оптические плотно-
сти растворов.
Для определения меди в исследуемый раствор, налитый в колбу на 50 мл, добавьте
20 мл NH4OH (1:3), дистиллированной воды до метки и перемешайте. Наполните раство-
ром кювету и измерьте оптическую плотность раствора при тех же условиях, при каких был получен калибровочный график.
Зная оптическую плотность, найдите по графику концентрацию иона Cu2+ в мг на 1
мл раствора. Умножив ее на объем всего анализируемого раствора (50 мл), вычислите об-
щее количество меди.
Метод стандартных добавок
Определение концентрации примеси этим методом основано на сравнении оптиче-
ских плотностей исследуемого раствора и того же раствора с известной добавкой опреде-
ляемого вещества. Метод незаменим, если требуется устранить мешающее влияние посто-
ронних примесей и создать одинаковые условия фотометрирования исследуемого и стандартного растворов.
Неизвестную концентрацию определяемой примеси находят расчетным путем:
|
|
Ах |
|
Сх |
|
, Cx Ca |
Ax |
, |
(1) |
|
|
Ах а |
Сх |
|
Ax a Ax |
||||
|
|
|
Са |
|
|
||||
где Cx |
- неизвестная концентрация определяемой примеси, мг; |
Ca - концентрация |
|||||||
добавки, мг; |
A x - оптическая плотность исследуемого раствора; Ax a |
- оптическая плот- |
|||||||
ность исследуемого раствора с добавкой. |
|
|
|
||||||
48
Описание определения
Отберите три аликвотные части анализируемого раствора по 25 мл в колбы на 50
мл для приготовления раствора с добавкой. К первой аликвотной части добавьте точно отмеренное количество стандартного раствора меди. Наибольшая точность определения меди достигается при Ах+а = 2Ах = 0,5, поэтому в эту аликвотную часть добавьте 5 мл стандартного раствора меди, 10 мл NH4OH и воды до метки. Ко второй аликвотной части добавьте 10 мл NH4OH и воды до метки. В третью колбу добавьте только NH4OH и воду до метки (нулевой раствор). Нулевым раствором может быть и дистиллированная вода.
Растворы фотометрируйте с синим светофильтром в кюветах толщиной 2 см отно-
сительно нулевого раствора.
Расчет неизвестной концентрации проведите по формуле (1).
49
Работа № 7
Определение висмута в виде тиокарбамидного комплекса
Катионы висмута образуют с тиокарбамидом (тиомочевиной) комплексные катио-
ны, окрашивающие раствор в желтый цвет:
Bi3+ + 3(NH2)2CS = [Bi(NH2)2CS)3]3+.
Максимальное поглощение света окрашенным раствором находится в синей облас-
ти спектра вблизи 430 нм.
Чувствительность метода составляет 2 мкг/мл в 50 мл конечного раствора при тол-
щине фотометрического слоя 5 см.
Измерение оптических плотностей эталонов и исследуемых растворов осуществ-
ляют по отношению к нулевому раствору сравнения.
Нулевой раствор приготавливают следующим образом: 15 мл 1 н HNO3, 10 мл 8%-
ного раствора тиокарбамида переносят в мерную колбу на 50 мл и добавляют дистиллиро-
ванной воды до метки.
Работу выполняют методом калибровочного графика. Результат фотометрических измерений заносят в форму, аналогичную форме табл.5.
Оборудование и реактивы
Фотоколориметр.
Стеклянные кюветы на 3 см, 2 шт.
Цилиндр на 20 мл, 1 шт.
Пипетка на 10 мл, 1 шт.
Мерные колбы на 50 мл, 7 шт.
Азотная кислота, 1 н.
Тиомочевина, 10%-ный раствор.
Стандартный раствор висмута 0,1 мг Bi3+ в 1 мл готовят, растворяя 0,2321 г соли
Bi(NO3)3∙5H2O в 100 мл HNO3 (1:3) в мерной колбе на 1000 мл и добавляя дистиллирован-
ную воду до метки.
Описание определения
Для построения калибровочного графика в четыре мерные колбы на 50 мл отмерьте пипеткой соответственно 1, 2, 3 и 5 мл стандартного раствора Bi3+. В каждую колбу до-
50
