
формальная кинетика
.pdf
СЕМИНАР 1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ. РАСЧЕТ КОНСТАНТ СКОРОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ
1.1 Скорость реакции
Скоростью химической реакции по некоторому компоненту (Wi) называется изменение количества этого компонента в единицу времени в единице реакционного пространства:
W 1 dni |
|
|
i |
q dt , |
(1) |
|
||
где ni – количество компонента, t – время, q – размер пространства, в котором локализирована реакция.
Для гомогенной реакции реакционным пространством является объем
реакционной системы (V). Отсюда для гомогенной реакции: |
|
|
|||||||||||||||||||
|
|
|
|
|
A A A' |
A' |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
1 |
|
2 |
|
1 |
|
2 |
|
|
|
|
|
|
||||
|
1 |
|
dnA |
|
1 |
|
dnA |
|
|
1 |
|
|
dnA/ |
|
1 |
|
dnA/ |
|
|
||
|
|
1 |
|
|
2 |
|
|
|
|
|
1 |
|
|
|
2 |
. |
(2) |
||||
V |
|
dt |
V |
dt |
|
V |
|
|
|
dt |
V |
|
dt |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
В случае гетерогенной реакции в роли выступает поверхность раздела фаз S и тогда:
Wi 1 dni . S dt
реакционного пространства
(3)
Для гомогенного процесса, если объем реакционной системы не меняется, объем (V) в уравнении (2) можно внести под знак дифференциала:
Wi |
d ni |
V |
|
dc |
|
|
|
|
i |
|
|||
|
|
|
. |
(4) |
||
dt |
|
dt |
||||
Таким образом, для гомогенного химического процесса, идущего при постоянном объеме, скоростью процесса по некоторому компоненту называется изменение концентрации этого компонента в единицу времени.
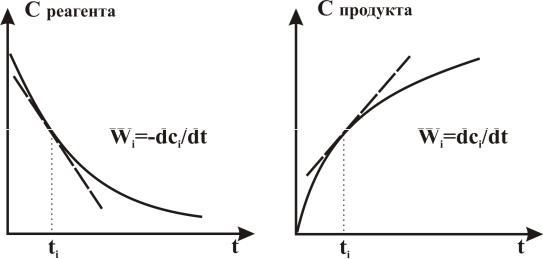
Графически скорость реакции выражается величиной углового коэффициента касательной в точке кинетической кривой C = f(t), соответствующей выбранному моменту времени t (рис. 1, 2).
Если в ходе реакции соблюдается стехиометрическое уравнение:
1A1 2 A2 1' A1' 2' A2' ,
то между изменением числа молей веществ и, следовательно, изменением концентраций реагентов выполняется соотношение:
|
|
1 dcA |
|
|
1 dcA |
|
|
1 dcA/ |
|
|
1 dcA/ |
|||||||||
|
|
|
1 |
|
|
|
2 |
|
|
|
1 |
|
|
|
2 |
. |
||||
1 |
dt |
2 |
dt |
1' |
dt |
2' |
dt |
|||||||||||||
1
В этом случае скорости реакции по отдельным компонентам связаны между собой, и можно ввести понятие скорости реакции в целом:
W |
|
1 dcAi |
|
|
1 dcAi/ |
|||||
|
|
|
|
|
|
|
|
. |
||
i |
dt |
i' |
dt |
|||||||
Рис. 1 |
Рис. 2 |
1.2 Кинетическое уравнение
Уравнение, описывающее зависимость скорости химического процесса от концентрации компонентов реакционной смеси, называется кинетическим уравнением процесса (дифференциальное уравнение скорости реакции). Так, для некоторой реакции
1 A1 2 A2... 1' A1' 2' A2' ...
скорость может быть описана кинетическим уравнением в общем виде:
W f (cA1 ,cA2 ...cAn ).
Для элементарной реакции (реакции, протекающей в одну стадию) такая зависимость дается закон ом действующих масс; тогда для элементарной (простой) реакции
1A1 2 A2 продукты
кинетическое уравнение имеет вид:
1 |
2 |
|
i |
|
|
||
W k c |
A |
c |
A |
, |
W k c |
, |
(5) |
|
|
i |
|||||
|
1 |
|
2 |
|
|
|
|
где Ci – концентрация реагента, k – константа скорости, П – символ произведения
Согласно закону действующих масс, скорость элементарной реакции равна произведению константы скорости реакции (k) на произведение концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам.
2

Часто для сложных реакций скорость оказывается пропорциональной произведению концентраций реагирующих веществ, возведенных в некоторые степени:
W k cn1 |
cn2 |
...cni |
, |
W k cni |
, |
(6) |
A |
A |
A |
|
i |
||
1 |
2 |
i |
|
|
|
|
где n1, n2...ni – числа, отличные от стехиометрических коэффициентов. Уравнение (6) обычно называют постулатом химической кинетики. Выражение (6) не является общей формой кинетического уравнения для
любой реакции. Иногда зависимость скорости реакций от концентраций реагентов вообще описывается нестепенной функцией.
Например, для реакции
H2 J2 2HJ
кинетическое уравнение имеет вид:
Wk c1H 2 c1J2 ,
адля, казалось бы, похожей реакции:
H2 Br2 2HBr
кинетическое уравнение: |
|
|
|
|
W |
K cH |
2 |
c1Br2 |
|
1 c |
. |
|||
|
|
2 |
|
|
|
HBr |
K ' cBr |
||
|
|
|||
|
|
|
2 |
|
То есть, если скорость некоторой реакции подчиняется закону действующих масс, это в общем случае не означает, что реакция является элементарной. Существуют сложные реакции, скорость которых формально описывается законом действующих масс. С другой стороны, если скорость реакции не описывается законом действующих масс, то это является прямым указанием на ее сложность.
1.3 Константа скорости реакции
Если кинетическое уравнение имеет вид степенной зависимости:
W k cn1 cn2 ...cni ,
A1 A2 Ai
то коэффициент, пропорциональности (k) называют константой скорости или удельной скоростью реакции. Константа скорости служит количественной мерой реакционной способности данного вещества в данной реакции. Из уравнения (6) следует, что константа скорости равна скорости реакции при концентрации реагентов, равных 1. Константа скорости не зависит от концентрации реагентов, входящих в кинетическое уравнение, а зависит, главным образом, от температуры.
Показатель степени при концентрации в кинетическом уравнении называется порядком реакции по данному компоненту (частный порядок –
3

n1, n2,...ni). Сумма показателей степеней при концентрации в уравнении (6) называется общим порядком реакции (n = n1 + n2 +...ni).
Если скорость реакции не подчиняется степенному уравнению (6), а выражается иной зависимостью, например,
W K1 c1 c2 ,
1 K2 c2
то K1 и K2 называют коэффициентами для скорости реакции.
Форма кинетического уравнения и характеризуемая им зависимость скорости реакции от концентрации реагентов вытекают из определенного механизма процесса и конкретных условий его осуществления. Поэтому каждое кинетическое уравнение справедливо только в определенном интервале указанных условий (температура, давление, состав реакционной смеси и т.п.). Размерность константы скорости реакции зависит от порядка реакции (табл. 1).
Таблица 1 |
|
|
|
|
Порядок реакции |
Размерность константы |
|
|
|
скорости |
|
|
0 |
[конц.] [ время]-1 |
|
|
1 |
[время]-1 |
|
|
2 |
[конц.]-1 |
[время]-1 |
|
3 |
[конц.]-2 |
[время]-1 |
|
n |
[конц.]n-1[время]-1 |
|
1.4 Порядок и молекулярность
Порядок реакции по данному компоненту – показатель степени в кинетическом уравнении вида:
W k cn1 cn2 ...,
A1 A2
где n1, n2 - порядки реакции по веществам A1 и A2.
Важно отметить, что показатели степени ni в кинетическом уравнении не являются стехиометрическими коэффициентами νi уравнения химической реакции, а должны быть определены из экспериментальных измерений скорости реакции.
Порядок реакции – величина формальная, может быть положительным, отрицательным, целым, дробным числом, а также равным нулю. Общий порядок равен сумме показателей степеней
n n1 n2...
Величинам порядков реакции нельзя приписать какой-либо физический смысл, для этого необходимо выяснить механизм и проанализировать, каким образом из него вытекает данное кинетическое уравнение.
4

Для элементарных реакций или элементарных стадий реакций порядок реакции совпадает со стехиометрическими коэффициентами, показывающими сколько молекул данного вещества одновременно участвует элементарном акте реакции.
Молекулярность реакций – это число частиц, принимающих участие в элементарном акте, т.е. она равна сумме целочисленных значений стехиометрических коэффициентов исходных веществ. Реакции бывают мономолекулярными, бимолекулярными и тримолекулярными. Участие в элементарном акте более трех частиц крайне маловероятно.
Большинство химических реакций является совокупностью нескольких последовательных и параллельных элементарных стадий, то есть имеет место сложный механизм, поэтому молекулярность и порядок, в общем случае, не совпадают. Таким образом, порядок реакции указывает лишь на показатель степени, в котором концентрация данного вещества входит в кинетическое уравнение, а молекулярность – на механизм взаимодействия в элементарном акте.
1.5 Односторонние реакции первого порядка
Для элементарной реакции
A продукты
кинетическое уравнение имеет вид:
W dcA kcA ; dt
после интегрирования: |
1ln |
|
|
|
|
k |
c0A |
|
|
||
, |
(7) |
||||
|
t |
||||
|
cA |
|
|||
где С0А – начальная концентрация вещества А; СА – концентрация вещества А в момент времени t.
В некоторых случаях, когда начальная концентрация реагента неизвестна, для расчета константы скорости односторонней реакции первого порядка можно использовать уравнение:
k |
1 |
ln |
c1A |
, |
|
t1 t2 |
c2A |
||||
|
|
||||
|
|
|
где c1A, c2A – концентрации исходного вещества A для времени t1 и t2. Поскольку концентрации входят в уравнение (7) в виде отношения, то
значение константы скорости первого порядка не зависит от того, в каких единицах выражена концентрация реагента.
Уравнение (7) в линейной форме имеет вид:
ln cA ln c0A kt . |
(8) |
5
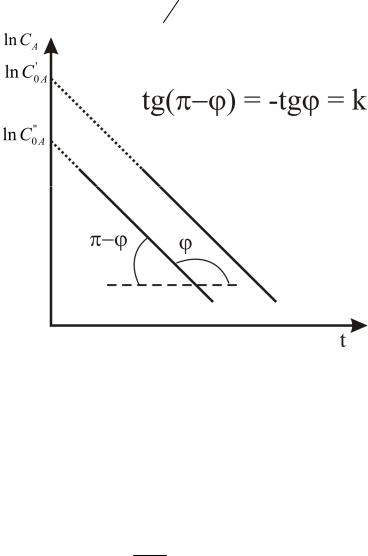
Таким образом, зависимость lnCA от времени должна изображаться прямой линией (рис. 3).
Период полупревращения для реакций первого порядка не зависит от
начальной концентрации исходного вещества: |
|
|
||
1 |
2 |
ln 2 0.693 . |
(9) |
|
|
k |
k |
|
|
Рис. 3
1.6 Односторонние реакции второго порядка
Тип 1: 2A k
Кинетическое уравнение имеет вид:
|
1 |
dcA |
k cA2 ; |
|
|||
|
2 dt |
||
dcA 2k cA2 . dt
Множитель 2 появляется потому, что в каждом акте реакции удаляются две молекулы A. После интегрирования получим:
k |
1 |
|
1 |
|
1 |
|
|
|
|
|
|||||
|
|
|
|
||||
|
2t cA |
|
c0A . |
(10) |
|||
Уравнение (10) в линейной форме имеет вид:
1 |
|
1 |
2kt. |
|
|
|
|
(11) |
|||
cA |
c0A |
||||
|
|||||
6

Рис. 4
Поэтому зависимость 1/cA = f(t) представляет собой прямую линию с положительным наклоном, равным 2k (Рис. 4, прямая а).
Время полупревращения:
1 2 |
|
1 |
. |
(12) |
|
||||
|
|
2kc0 A |
|
|
Таким образом, в отличие от кинетики первого порядка период полупревращения в реакции второго порядка зависит от начальной концентрации реагента.
Тип 2: A B k
Эту реакцию можно рассмотреть в разных условиях:
б) Начальные концентрации исходных веществ A и B одинаковы: C0A =
C0B.
Этот случай математически сводится к типу 1, но вместо 2k в уравнении (11) появляется просто k:
|
dcA |
|
|
|
1 |
|
|
|
|
|
k cA2 |
,k 1 |
1 |
|
|
, |
(13) |
||
|
|
|
|||||||
|
dt |
t cA |
|
c0A |
|
|
|||
в линейной форме уравнение (13) имеет вид (Рис. 4, прямая б), |
|||||||||
1 |
|
1 |
kt. |
(14) |
|
|
|
||||
cA |
c0A |
||||
|
|||||
Период полупревращения:
|
1 2 |
|
1 |
|
|
|
kc0 A . |
(15) |
|||||
|
|
|||||
|
|
|
||||
в) Начальные концентрации реагентов неодинаковы С0А≠С0В, кинетическое уравнение имеет вид:
7
W |
dcA |
k c |
A |
c |
B |
;c |
c |
; |
||||||
|
||||||||||||||
|
|
dt |
|
|
|
|
0 A |
0B |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
k |
|
1 |
|
|
ln |
c0BcA |
, |
|
(16) |
|||||
t(c |
c |
) |
|
|
|
|||||||||
|
|
|
c |
|
c |
B |
|
|
||||||
|
|
0 A |
|
0B |
|
|
|
0 A |
|
|
|
|||
где СА и Св – концентрации веществ A и В к моменту времени t. В линейной форме уравнение (16) имеет вид:
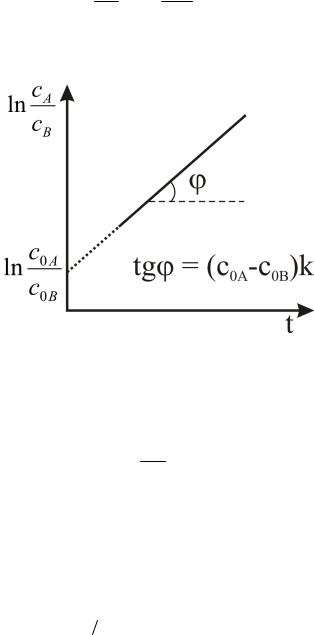
ln cA ln c0 A c0 A c0B kt . cB c0B
Таким образом, зависимость ln(CA/CB) является линейной времени t (рис. 5).
Рис. 5
1.7. Односторонние реакции n-нного порядка
Кинетическое уравнение имеет вид:
W dc k cn ,
|
dt |
|
|
|
|
1 |
|
cn 1 |
cn 1 |
||
k |
|
0 |
. |
||
n 1 t |
|
cn 1cn 1 |
|
||
|
|
0 |
|
|
|
Время полупревращения для реакций n-нного порядка:
(17)
функцией
(18)
1 2 |
|
1 |
|
2n 1 1 |
|
|
k (n 1) |
|
n 1 |
. |
(19) |
||
|
|
|
c0 |
|
||
Уравнения (18-19) справедливы при любом значении n, как целом, так и дробном, больше и меньше 0.
8
1.8 Реакции нулевого порядка
Нулевой порядок реакции указывает на независимость скорости реакции от концентрации реагирующего вещества, что имеет место для сложных реакций. Скорость реакции в этом случае определяется не концентрацией исходного вещества, а другими факторами (количеством поглощенного света, концентрацией катализатора, концентрацией поверхностных промежуточных соединений и т.д.).
Кинетическое уравнение реакции нулевого порядка имеет вид:
dc k, dt
после интегрирования:
k |
c0 |
c |
. |
(20) |
|
t |
|||
|
|
|||
|
|
|
|
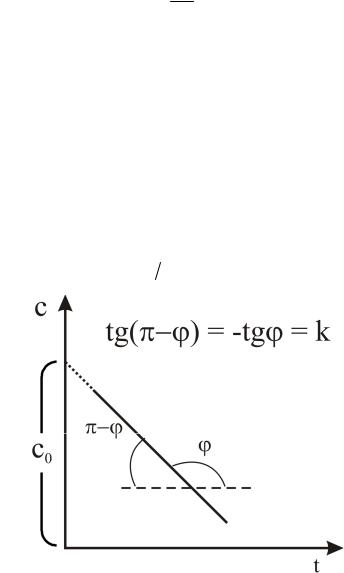
Уравнение (20) можно представить в виде:
c c0 kt . |
(21) |
Зависимость С = f(t) является линейной функцией времени t (рис. 6). Время полупревращения для реакций нулевого порядка выражается
уравнением:
|
1 2 |
|
c0 |
|
|
|
2k . |
(22) |
|||||
|
|
|||||
|
|
|
||||
Рис. 6
1.9.Вопросы для самоконтроля
1.Что называется скоростью химической реакции?
9
2.Запишите выражение для скорости гомогенной реакции при условии, что а) V ≠ const, б) V = const.
3.Запишите выражение для скорости химической реакции при условии, что реакция протекает на границе раздела фаз.
4. В чем различие записей: |
W |
1 |
|
dni |
и |
W |
dci |
|
|
|
dt |
||||
i |
V dt |
i |
|||||
|
|
|
|
|
|
||
(ni и ci - соответственно число молей и концентрация исходного вещества)? 5. В каких единицах измеряется скорость химической реакции?
6. Какие существуют методы расчета скорости химической реакции?
7. В чем различие между истинной и средней скоростью реакции? Покажите это различие графически.
8. Можно ли утверждать, что в начальный момент времени скорость имеет наибольшее значение?
9. Дайте понятие кинетического уравнения.
10. Для каких реакций кинетическое уравнение совпадает с законом действующих масс?
11. Как связана скорость реакции взаимодействия водорода с кислородом
( 2H2 O2 2HO2 ), выраженная по водороду, со скоростями этой реакции, выраженными по другим компонентам?
12.Запишите кинетическое уравнение для элементарной реакции:
HH M H 2 M
13.Какие из следующих факторов влияют на скорость химической реакции: природа реагирующих веществ, катализатор, растворитель, температура?
14.Каков физический смысл константы скорости химической реакции? Какова размерность константы скорости? От чего она зависит?
15.Как соотносятся константы скорости второго порядка, если концентрация реагента и время выражены либо в моль/л и сек, либо в молекул/см3 и сек?
16.Можно ли сравнивать константы скорости разных порядков?
17.Какие из следующих факторов влияют на константу скорости химической реакции: природа реагирующих веществ, концентрация реагирующих веществ, катализатор, растворитель, температура?
18.Графическим выражением какой зависимости является кинетическая кривая?
19.Что называется порядком реакции по данному компоненту и общим порядком реакции? Какие значения может принимать порядок реакции?
20.Константа скорости какого порядка не зависит от начальной концентрации исходного вещества?
21.Поясните термин "молекулярность" реакции. Почему молекулярность не превышает трех? Для каких реакций порядок и молекулярность совпадают?
22.Если порядок реакции равен единице, можно ли утверждать, что исследуемая реакция имеет молекулярность, равную единице?
23.Изобразите графически зависимость константы скорости реакции от концентрации исходных веществ.
10
