
формальная кинетика
.pdf
соответствии с различными кинетическими уравнениями. Для реакций первого порядка - это зависимость ln c f t (рис. 3); для реакций второго порядка -
1 c f t |
(рис.4) или ln cA |
cB f t (рис. 5); для реакций нулевого |
порядка - c f t (рис. 6). При этом находят такую функцию, которая на
графике ее зависимости от времени дает прямую линию.
В случае сложных реакций интегральный метод может привести к ошибочным выводам. Для того чтобы корректно судить о порядке реакции, необходимо исследовать зависимость концентрации реагента от времени для различных начальных концентраций. Только параллельные прямые в соответствующих координатах служат ясным доказательством наблюдаемого порядка (рис. 3, 4).
Кроме того, следует учитывать то обстоятельство, что кинетические кривые, относящиеся к разным порядкам, при прочих равных условиях начинают различаться тем больше, чем выше степень превращения. В случае малых значений времени линейная зависимость концентрации продукта от времени характерна не только для реакций нулевого порядка, но первого и второго. Поэтому для однозначного отличия одного порядка от другого, необходимо проследить за реакцией до глубины ее протекания на 60 – 70 %.
3. Метод времени полупревращения:
для реакции первого порядка 1 2 0.693 ,
k
для реакции второго порядка 1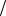 2 k 1c0 ,
2 k 1c0 ,
для реакции третьего порядка 1 2 2k3c02 .
2 2k3c02 .
В общем случае для реакции n-нного порядка соотношение между временем полупревращения и начальной концентрацией исходного вещества будет
|
1 2 |
const |
или ln 1 2 ln const (n 1) lnc 0 |
|
|
|
(24) |
||
|
n 1 |
|||
|
|
c0 |
|
|
а) |
Если известны два значения 1 2 , измеренные при двух начальных |
|||
концентрациях, то порядок реакции в соответствии с уравнением (24) определяется по формуле:
|
ln ' |
ln " |
|
|
|
|
n |
1 2 |
1 2 |
1 |
|
|
|
" |
' |
. |
(25) |
|||
|
|
|||||
|
ln c0 |
ln c0 |
|
|
|
21
Уравнения (24, 25) могут быть использованы, если известно время превращения вещества на определенную долю (например, на 1/3; 1/5 и т.д.) при различных начальных концентрациях (метод Оствальда-Нойеса).
б) Если имеется несколько (более чем два) периода полупревращения для различных начальных концентраций реагентов, то порядок реакции определяется графически.
В координатах ln 1 2 lnc0 уравнение |
(24) выражается прямой, |
показанной на рис. 7. Тангенс угла наклона |
прямой tg n 1 |
определяет порядок реакции: |
|
n tg 1. |
(26) |
Рис. 7
2.2.Дифференциальные методы
Воснове этих методов лежит кинетическое уравнение в дифференциальной форме.
Для реакции n-ного порядка зависимость скорости реакции от концентрации имеет вид:
W |
dcA |
kcn |
, |
(27) |
|
||||
|
dt |
A |
|
|
|
|
|
|
логарифмирование этого уравнения дает:
ln ln dcA
W
dt
|
ln k n ln cA. |
|
|
(28) |
|
|
|
|
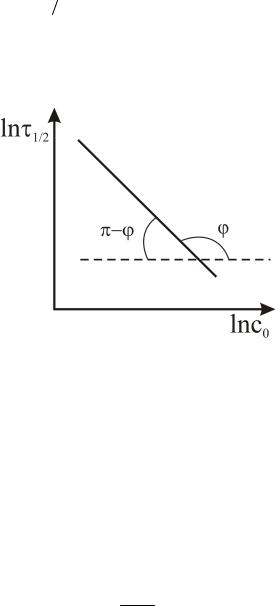
Из уравнения (28) видно, что определение порядка реакции сводится к построению графической зависимости:
|
|
dc |
A |
|
|
|
|
c |
A |
|
|
|
ln |
|
|
|
|
f ln cA ;ln |
|
|
|
f ln cA . |
|||
dt |
t |
|||||||||||
|
|
|
|
|
|
|
|
|||||
Этот метод применить в двух вариантах:
22

1 – вариант
Для определения порядка реакции определяют начальные скорости W0
при различных наборах начальных концентраций ci0 . Эта зависимость имеет тот же вид, что и для скорости вообще:
lnW0 ln k nln c0 A . |
(29) |
Для нескольких начальных концентраций c10 , c20 , c30 |
строят графики в |
координатах «концентрация – время» и проводят в начальной точке касательные, так как показано на рис. 8. Касательные отвечают начальным скоростям при определенных начальных концентрациях. Порядок определяют
из графика зависимости lnW0 f ln c0 (рис. 9).
Рис. 8 Рис. 9 Следует иметь в виду, что разница в значениях начальных концентраций
не должна быть слишком малой, иначе из-за ошибок в определении скорости ошибка расчета порядка может быть большой. С другой стороны, нельзя слишком варьировать начальную концентрацию, так как это может привести к выходу за пределы справедливости уравнения (29).
2 – вариант (графическое дифференцирование кинетической кривой)
Второй вариант графического метода применяют для обработки результатов одной кинетической кривой (т.е. данных одного опыта).
Исходными для расчета являются графики c f (t) (рис.10).
Наиболее удобным и достаточно точным методом определения производной в данной точке является метод конечных отрезков.
Для нахождения производной ( dc dt) в различных точках кинетической кривой необходимо ось времени (t) разделить на отрезки ti (эти отрезки можно брать равными или неодинаковыми, а именно, большими там,
dt) в различных точках кинетической кривой необходимо ось времени (t) разделить на отрезки ti (эти отрезки можно брать равными или неодинаковыми, а именно, большими там,
где наклон кривой невелик), и найти изменение концентрации реагента ci .
23
Рис. 10 |
Рис. 11 |
Отношение конечных приращений ci |
ti равно производной в |
некоторой промежуточной точке. Обычно это значение производной относят к средней точке отрезка ti . Поэтому отрезок ti делят пополам и, восстановив
перпендикуляр, определяют концентрацию ci , к которой относится найденное
значение производной. На рис.10 показано как определяют ci  ti и ci . По данным графического дифференцирования строят график в координатах ln c
ti и ci . По данным графического дифференцирования строят график в координатах ln c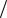 t i и ln ci . Порядок реакций определяют из тангенса угла наклона
t i и ln ci . Порядок реакций определяют из тангенса угла наклона
прямой (рис.11).
Наряду с графическими методами можно определить порядок реакции по значениям скорости реакции (W или Wo) при двух значениях концентраций реагента:
Метод Вант - Гоффа
Если известны две скорости (W1 и W2) для двух моментов времени, то из уравнения (28) при условии, что k const , имеем
|
n |
ln c1 t1 ln c2 t2 |
, |
(30) |
|
|
|||
|
|
ln c1 ln c2 |
||
где c1 и c2 |
|
|
||
- изменение концентрации за промежуток времени ti ; c1 и c2 - |
||||
средняя концентрация за данный промежуток времени ti . |
|
|||
Метод начальных скоростей
Этот метод является модификацией предыдущего метода. Если определены две начальные скорости (W01 и W02) для двух различных исходных концентраций, то порядок реакции можно определить по уравнению (31):
24
n |
lnW01 |
lnW02 |
|
|
ln c01 |
ln c02 |
. |
(31) |
|
Преимуществом интегральных методов определения порядка реакции является то, что экспериментальные значения концентраций реагентов определенных в различные промежутки, времени можно подставлять без предварительной обработки в интегральную форму кинетического уравнения, получая более точные константы. Главный недостаток метода связан с тем, что нужно сначала предположить вид интегрального уравнения скорости, а затем проверить, описывает ли это уравнение экспериментальные данные.
Главное преимущество дифференциального метода перед интегральным методом состоит в том, что не требуется никаких предварительных соображений по поводу порядка и механизма реакции. Недостаток метода заключается в том, что исходные данные (концентрация - время) нужно сначала перевести в данные «скорость – концентрация» ("второе поколение" экспериментальных данных), а также в том, что построение касательных сопряжено с определенными ошибками. Особенно это играет роль, в тех случаях, когда кинетические кривые не записываются непрерывно, а строятся по отдельным точкам.
2.3.Вопросы для самоконтроля.
1.Дайте понятие кинетического уравнения. Могут ли входить в кинетическое уравнение концентрации продуктов, промежуточных веществ?
2.Что называется порядком реакции по данному компоненту и общим кинетическим порядком?
3.Может ли порядок реакции быть нулевым, дробным, отрицательным? Может ли реакция нулевого порядка быть простой?
4.От каких факторов зависит порядок реакции?
5.Можно ли на основании величины порядка реакции судить о сложности реакции?
6.В каком случае для определения порядка реакции используется принцип изолирования Оствальда? Какой порядок (частный или общий) при этом определяется?
7.Что подразумевается под термином "псевдопорядок" реакции?
8.Для определения порядка реакции:
1 A1 2 A2 продукты
была использована смесь, содержащая вещества в эквивалентных количествах. Какой порядок реакции (частный или общий) при этом определяется?
9.В чем сущность интегральных методов определения порядка реакции. Какие у них преимущества и недостатки?
25
10. Каким образом графически подтвердить 0, 1, 2 порядки реакции? Как при этом рассчитать константу скорости? Приведите линейные формы интегральных кинетических уравнений 0, 1 и 2 порядков реакции.
11.Какое заключение Вы можете сделать о порядке реакций, если кинетические кривые имеют вид:
12.Каким образом можно определить порядок реакции по периоду полупревращения? Какие уравнения лежат в основе этого метода?
13.Для реакции какого порядка период полупревращения не зависит от начальной концентрации исходного вещества?
14.В чем сущность дифференциальных методов определения порядка реакции? Какие у них преимущества и недостатки?
15.Покажите, как проводится графическое дифференцирование кинетической кривой?
2.4. Примеры решения задач
Пример 1. При определенных условиях гексафенилэтан разлагается на два свободных радикала трифенилметила:
С6H5 3 C C С6H5 3 2 С6H5 3 C .
При 273 К концентрация гексафенилэтана в одном опыте изменялась следующим образом:
|
|
|
№ |
t, мин |
с, моль/л |
1 |
0 |
0.1000 |
2 |
0.50 |
0.0934 |
3 |
1.05 |
0.0867 |
4 |
2.20 |
0.0733 |
5 |
3.65 |
0.0600 |
6 |
5.50 |
0.0465 |
7 |
7.85 |
0.0334 |
8 |
9.45 |
0.0265 |
9 |
14.75 |
0.0134 |
Определить порядок реакции.
Решение:
Предположим, что предлагаемая реакция является реакцией первого порядка. Проведем проверку уравнения (7) аналитически и уравнения (8) графически.
26

1) Метод подбора (аналитический).
Подставим значения времени и соответствующих концентраций гексафенилэтана в уравнение
|
|
|
|
|
|
|
|
|
|
k 1ln |
c0 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
t |
c |
|
|
|
|
||||||
k2 |
|
1 |
ln |
|
0.1 |
|
0.138 |
1 |
k3 |
|
1 |
|
0.1 |
|
|
||||||
0.5 |
0.0934 |
1.05 |
0.0867 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
k2 |
|
1 |
|
ln |
0.1 |
0.140 |
1 |
k2 |
|
|
1 |
|
0.1 |
|
|
||||||
3.65 |
0.06 |
14.75 |
0.0134 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
0.137 |
|
|
|
1 |
|
|
|
||||
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|||||||
1
1
Константа скорости постоянна в пределах неизбежных ошибок опыта. Следовательно, предлагаемая реакция является реакцией первого порядка.
2) Проверим предполагаемый порядок реакции графически, построив
зависимость ln c f (t) рис.12. Поскольку зависимость, показанная на рис. 12 прямолинейна, то рассматриваемая реакция первого порядка.
Пример 2. Определить порядок реакции превращения цианата аммония в мочевину при 308 К, пользуясь зависимостью между временем полупревращения и начальной концентрацией цианата аммония.
c0 , моль/л |
0.05 |
0.10 |
0.15 |
0.20 |
0.25 |
1 2 , ч |
37.03 |
19.15 |
12.43 |
9.45 |
7.51 |
Решение:
1. Поскольку известно пять значений периодов полупревращения и соответствующих им начальных концентраций, определим порядок реакции,
пользуясь уравнением (24). Построим график в координатах ln 1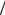 2 ln c0
2 ln c0
(рис.13). Порядок реакции n tg 1; tg 1; n 1 1 2.. Искомый
порядок равен 2.
2. Проверим порядок, используя зависимость между временем полупревращения и константой скорости для реакций второго порядка:
27
Рис. 12 |
|
1 |
|
|
|
|
|
|
Рис.13 |
|
k |
|
|
|
|
|
|
1.60 10 4 |
|
||
0.05 |
37.03 3600 |
|
||||||||
|
|
|
|
|||||||
k |
|
1 |
|
|
|
1.45 10 4 |
|
|||
0.1 19.15 |
3600 |
|||||||||
|
|
|
|
|
||||||
k |
|
1 |
|
|
|
|
|
1.49 10 4 |
|
|
0.15 |
12.43 3600 |
|
||||||||
|
|
|
|
|||||||
k |
|
1 |
|
|
1.47 10 4 |
|
||||
0.2 9.45 3600 |
||||||||||
|
|
|
|
|
|
|
||||
k |
|
1 |
|
|
|
1.48 10 4 |
|
|||
0.25 |
7.51 3600 |
|||||||||
|
|
|
|
|
||||||
Константа скорости сохраняет удовлетворительное постоянство, что подтверждает второй порядок.
Пример 3. Время, необходимое для разложения диметилового эфира при 777 К на 31% зависит от его начального давления следующим образом:
P0 10 2 , Па |
|
200 |
416 |
0.31 , с |
|
900 |
665 |
Определить порядок |
реакции. |
|
|
Решение: |
|
|
|
Для определения порядка реакции воспользуемся уравнением (25).
n |
ln ' |
ln " |
1, |
|
|
0.31 |
|
0.31 |
|
||
ln P" ln P' |
|
||||
|
|
|
|||
|
0 |
|
0 |
|
|
n |
ln 900 |
ln 665 |
1 4. |
||
ln 41600 |
ln 20000 |
||||
Пример 4. При каталитическом дегидрировании н-бутилена до дивинила при 893 К для двух значений начальных давлений н-бутилена (Р0) определены две начальные скорости дегидрирования(W0):
28
|
|
|
|
|
|
||
W0, моль/г к-ра∙ч |
|
0.0360 |
|
0.0248 |
|||
P0 10 3 , Па |
|
89.069 |
|
31.899 |
|||
Определить порядок |
|
реакции. |
|
|
|||
Решение: |
|
|
|
|
|
|
|
Воспользуемся уравнением (31): |
|
|
|||||
n |
lnW ' |
lnW " |
|
|
ln 0.036 ln.0248 |
0.33 |
|
0 |
0 |
|
|
||||
|
ln 89069 ln 31899 |
||||||
|
ln c0" ln c0' |
|
|
|
|
||
2.5.Задачи
1.Из приведенных ниже данных для реакции разложения N2O5 в растворе
четыреххлористого углерода, полученные при 318 К, определить порядок реакции всеми возможными способами и рассчитать константу скорости. Вычислить порядок реакции по оксиду азота и водороду и константу скорости.
t, с |
|
|
0 |
184 |
319 |
526 |
867 |
1198 |
1877 |
2315 |
3144 |
сN O |
|
2.33 |
2.08 |
1.91 |
1.67 |
1.37 |
1.11 |
0.72 |
0.55 |
0.31 |
|
2 |
5 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
моль/л |
|
|
|
|
|
|
|
|
|
||
|
|
Ответ: первый, 6.3·10-4 с-1 |
|
|
|
|
|
|
|||
2. При изменении начальной концентрации реагента А в простой реакции
A B от 0.51 до 1.03 моль/л, период полупревращения при 298 К снизился от 150 до 75 с. Каковы порядок реакции и константа скорости?
Ответ: второй, 0.013 л/моль·с
3.Было найдено, что при изменении начальной концентрации реагента с 0.502 до 1.007 моль/л период полупревращения уменьшился с 51 до 26 с. Каков порядок этой реакции и чему равна константа скорости?
Ответ: второй, 0.0391 л/моль·мин.
4.При изучении реакции разложения ацетона в газовой фазе были получены следующие экспериментальные данные:
P0 10 2 , Па |
390 |
|
650 |
1 2 , мин |
23.8 |
|
24.0 |
|
|
|
|
Определить порядок реакции и константу скорости. |
|
||
Ответ: первый, 0.029 мин-1 |
|
||
5. Для реакции между оксидом азота и водородом: |
|
||
|
2NO 2H2 N2 2H2O |
||
при 373 К были получены следующие кинетические данные: |
|||
Начальные концентрации, моль/л |
|
Начальные скорости, |
|
29
|
|
моль/л·с |
NO |
H2 |
W0 |
0.025 |
0.01 |
2.4·106 |
0.025 |
0.005 |
1.2·106 |
0.0125 |
0.01 |
0.6·106 |
Вычислить порядок реакции по оксиду азота и водороду и константу скорости. Ответ: первый по водороду, второй по оксиду азота, 0.384 л2/моль2·с
6. В реакционный сосуд вводят эквивалентные количества 1г и натриевой соли фенилпропиоповой кислоты. За течением реакции следили, отбирая пробы и титруя иод тиосульфатом натрия. Были проведены два опыта:
Время, мин |
На отобранную пробу пошло мл 0.1H |
|
Na2S2O3 |
||
|
||
1опыт – 0 |
24.96 |
|
29 |
8.32 |
|
2 опыт – 0 |
21.00 |
|
34.5 |
7.00 |
Определить порядок реакции, если объем отбираемых проб одинаков во всех опытах.
Ответ: второй, 0.0027 л/моль·мин.
7. Реакция омыления уксусноэтилового эфира щелочью 298 К идет по следующему уравнению:
CH3COOC2H5 NaOH CH3COONa C2 H5 OH
Кинетика этой реакции исследовалась путем титрования проб одинакового объема смеси (начальные концентрации реагентов неодинаковы). Определить порядок реакции и константу скорости и на основании следующих данных:
t, мин |
0 |
4.9 |
10.4 |
29.0 |
∞ |
|
Количество мл 0.01M р-ра HCl, |
61.95 |
50.59 |
42.40 |
29.35 |
14.9 |
|
пошедшее на титрование 10 мл смеси |
||||||
|
|
|
|
|
||
Ответ: второй, 1.0097л/моль·мин. |
|
|
|
|
|
8. При изучении реакции между оксидом азота и водородом, протекающей по уравнению
2NO 2H2 N2 2H2O
было проведено две серии опытов: в первой серии опытов определяли период полупревращения при разных начальных давлениях реагентов ( P0H2 P0NO );
во второй серии опытов определяли начальные скорости реакции W0 в зависимости от начальных давлений NO, а давление водорода поддерживали
постоянным ( P0H2 =const):
P0H 2 |
P0NO 10 4 , Па |
4.72 |
3.59 |
3.20 |
2.69 |
30
