
Особенности адсорбции на твердой поверхности
Адсорбция из растворов на твердой поверхности играет важную роль в процессах образования, разрушения и устойчивости коллоидных систем. С ней связаны процессы очистки и рекуперации, извлечения из растворов цен-ных примесей, усвоения живыми организмами питательных веществ и др.
Адсорбция на границе «твердое тело – раствор» – явление более сложное, чем адсорбция на жидкой поверхности. Так как в этом случае приходится учитывать влияние силового поля, структуры и природы твердой поверх-ности, которая обычно бывает энергетически неоднородной. В отличие от жидкости, на твердой поверхности имеются активные (выступы, углубления) и неактивные участки, а адсорбция происходит на активных участках, т.е. она является локализованной. Приходится также учитывать межмолекулярные взаимодействия в растворе. Растворитель и растворенное вещество будут кон-курировать за места в поверхностном слое. По правилу выравнивания поляр-ностей Ребиндера на твердой поверхности адсорбируется вещество, поляр-ность которого близка к полярности твердой фазы или чем лучше оно сма-чивает твердую поверхность. Например, на поверхности угля из водного раствора адсорбируется не вода, а уксусная кислота. При адсорбции на гра-нице «твердое тело – раствор» выполняется и правило Дюкле-Траубе. Экспериментально количество адсорбированного вещества определяют путем измерения концентрации раствора до адсорбции (Со) и равновесной концен-
16
трации
после адсорбции (С):
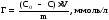 ,
,
где V – объем раствора; m – масса адсорбента.
Количественные закономерности адсорбции на твердой поверхности
Мономолекулярная
теория Ленгмюра. При
увеличении концентрации адсорбтива
адсорбция распространяется на всю
поверхность так, что на ней образуется
плотно заполненный слой толщиной в
одну молекулу (мономоле-кулярный слой).
Ленгмюр считал, что адсорбция на твердой
поверхности происходит только на
свободных активных участках, она имеет
мономолеку-лярную природу, т.е. адсорбция
продолжается до тех пор, пока поверхность
не будет полностью покрыта адсорбированными
молекулами. Дополнитель-ная адсорбция,
т.е. образование других слоев невозможно.
Адсорбционное равновесие носит
динамический характер, адсорбционные
центры (активные участки) не взаимодействуют
между собой. Исходя из этих представлений
Ленгмюр вывел количественную зависимость
между величиной адсорбции и концентрацией
адсорбтива при постоянной температуре:
 где Г – величина адсорбции, т.е. разность
концентраций вещества на поверх-ности
и в прилегающем (жидком или гавофазном)
слое, моль/м2;
Гmax
– пре-дельная величина адсорбции,
достигаемая при плотном заполнении
мономо-лекулярного слоя; С – равновесная
концентрация, моль/л; К – константа
равновесия, равная отношению констант
скоростей десорбции и адсорбции.
где Г – величина адсорбции, т.е. разность
концентраций вещества на поверх-ности
и в прилегающем (жидком или гавофазном)
слое, моль/м2;
Гmax
– пре-дельная величина адсорбции,
достигаемая при плотном заполнении
мономо-лекулярного слоя; С – равновесная
концентрация, моль/л; К – константа
равновесия, равная отношению констант
скоростей десорбции и адсорбции.
|
|
|
Для
установления Гмах
используют графический метод. Уравнение
изо-термы Ленгмюра легко преобразуется
в уравнение прямой линии путем деления
концентрации на обе части уравнения:
 .
По это-му уравнению прямой строят график
зависимости С/Г
= f(C).
Котангенс угла прямой и представляет
максимальную величину адсорбции: Гмакс
= ctgα
= ΔС/(ΔС/Г).
Следует отметить, что уравнение Ленгмюра
дает хорошую зависи-мость адсорбции
от концентрации в области малых
концентраций, т.к. при этих концентрациях
наблюдается прямая зависимость.
.
По это-му уравнению прямой строят график
зависимости С/Г
= f(C).
Котангенс угла прямой и представляет
максимальную величину адсорбции: Гмакс
= ctgα
= ΔС/(ΔС/Г).
Следует отметить, что уравнение Ленгмюра
дает хорошую зависи-мость адсорбции
от концентрации в области малых
концентраций, т.к. при этих концентрациях
наблюдается прямая зависимость.
17
Уравнение и изотерма Фрейндлиха. В случае адсорбции на пористых адсорбентах было установлено отклонение адсорбции от уравнения Ленгмю-ра. Для такой адсорбции Фрейндлихом было предложено эмпирическое урав-нение: Г = KС1/n, где Г = x/m – величина адсорбции (отношение количества вещества к массе адсорбента), ммоль/г; С – равновесная концентрация, ммоль/л; K и n – эмпирически подобранные константы.
Уравнение Фрейндлиха дает изотерму, выражающейся параболой без максимума. Для нахождения констант, уравнение Фрейндлиха приводят в линейную форму, логарифмируя обе его части: lg Г = lgK + 1/nlgC.
|
|
|
По уравнению Фрейндлиха адсорбция возрастает без предела, но оно не дает точных значений величин адсорбции в области низких и больших концентраций.
Теория Поляни. Оказалось, что адсорбция на твердой поверхности имеет полимолекулярную природу. М.Поляни считал, что адсорбция не заканчи-вается после формирования первого слоя толщиной в одну молекулу. До окончания его формирования начинается адсорбция следующего слоя молекул. И так образуются 2-ой, 3-ий, четвертый и 5-ый слои. Дополнитель-ные слои образуются за счет ван-дер-ваальсового притяжения. Такой вид адсорбции называется полимолекулярной. И она объясняет, почему в области больших концентраций адсорбция возрастает, вопреки теории Ленгмюра.
Теория полимолекулярной адсорбции БЭТ. Брунауэр, Эммет и Теллер
|
Рис. 9. Изотерма БЭТ. |
(сокращенно БЭТ) вывели количес-твенную зависимость, описываю-щую полимолекулярную адсорб-цию. Она объединяет и развивает основные положения теорий Ленг-мюра и Поляни. По этой теории на поверхности адсорбента имеются локализованные центры адсорб-ции, адсорбция специфически полимолекулярна («столбиковая»), |
18
обратима, адсорбционные центры не взаимодействуют между собой. Процесс адсорбции аналогичен протеканию серии квазихимических реакций между адсорбентом и адсорбатом. Изотерма уравнения БЭТ имеет сложный вид: в области низких концентраций она совпадает изотерме Ленгмюра, в области высоких концентраций кривая уходит вверх, отражая процессы образования различных слоев.
Полярная (или ионная) адсорбция. Когда молекулы адсорбента или адсорбтива полярны, то притяжение молекул происходит за счет ориентации противоположными полюсами. Такая адсорбция веществ за счет индукцион-ных и ориентационных взаимодействий называется полярной или ионной. Различают эквивалентную и ионообменную адсорбции. При эквивалентной адсорбции на поверхности адсорбируются только те ионы, которые имеются в составе адсорбента и (или) достраивают его кристаллическую структуру. Эта закономерность формулируется в виде правила Панета-Фаянса: «при эк-вивалентной адсорбции ионы адсорбируются в эквивалентном по заряду количестве; адсорбируются те ионы, которые имеются в составе адсорбента и могут достраивать его кристаллическую структуру». Например, на поверх-ности сульфата бария из раствора могут адсорбироваться ионы бария и сульфат ионы.
В случае замены каких-либо ионов на другие ионы раствора, и имеющие одинаковый заряд, наблюдается ионообменная адсорбция. Такие адсорбенты называются ионообменниками.
По природе различают природные и искусственные ионообменники. По составу различают неорганические (цеолиты – дегидратированные алюмоси-ликаты щелочных и щелочноземельных металлов, пермутиты – искусствен-ные цеолиты) и органические ионообменники (например, гумус – не получил широкого применения ввиду нестойкости и малой механической прочности).
Искусственные ионообменники подразделяются на полусинтетические (получают путем присоединения к природным адсорбентам группировок, способных к ионному обмену, например уголь обрабатывают серной кисло-той и получают сульфоуголь) и синтетические или ионообменные смолы. Это различные полимеры, имеющие в своей структуре функциональные группы. Основой их являются структуры, образованные из полистирольных, полифе-нолформальдегидных, целлюлозных и др. цепей, к которым присоединены функциональные группы. Например, основу КУ-1 представляет полифенол-формальдегидная смола, а КУ-2 – полистирольная основа с сульфогруппами. Их получают поликонденсацией или химической модификацией готового по-лимера путем введения в его структуру ионогенных группировок. Выпус-каются в виде зёрен, волокон, порошков, тканей, мембран.
Вещества, способные обменивать свои катионы на катион электролита, называются катионобменниками (катионитами). В них активной или функ-циональной группой служит сульфо- ( -SO3H), карбоксильные (-СООН), гидроксильные (-ОН), фосфатные (-РО3Н2) группы. В общем виде катион-ный обмен и регенерацию представляют следующим образом:
RH + Na+ (p-p) ® RNa + H+
(катионит в Н-форме)
RNa + HCl (5-6% p-p) ® RH + NaCl (где R – полианион).
Вещества, способные обменивать свои анионы на анион раствора называ-ются анионитами или анионообменниками. В общем виде анионный обмен анионита в ОН-форме представляют следующим образом (где R – поликатион): ROH + Cl- (p-p) ® RCl + OH- .
Функциональными группами в них чаще являются различные аминогруппы: -NH2, >NH, ºN, -NH3+.
В водоподготовке (для умягчения воды) воду сначала пропускают через катионит, а затем через анионит:
2RNa + Ca2+(p-p) ® R2Ca + 2Na+
RNH2 + HCl ® RNH3+Cl-
RNH2 + H2SO4 ®RNH3+HSO4-
Ионообменники используются и для разделения редкоземельных элемен-тов, в химической промышленности, фармацевтике, ионообменной хромато-графии, в работе аппарата «искусственная почка».
Адсорбционные процессы в организме. Практическое применение адсорбции
В организме имеются различные поверхности раздела, основным строи-тельным элементом которых является клеточная мембрана. На клеточной и внутриклеточной мембране происходит адсорбция ферментов и они действу-ют в адсорбированном состоянии. Это создает пространственную организа-цию ферментов и обеспечивает согласованное течение всех биохимических
реакций. Транспорт многих веществ (жирных кислот, лекарственных средств) кровью обеспечивается переносом их в адсорбированном виде на молекулах белка плазмы крови альбумина. В организме действуют также такие ПАВ, как фосфолипиды, эфиры. В эпителии, покрывающем стенки альвеол легких, образуются специальные белки (сурфактанты), которые понижают поверх-ностное натяжение на поверхности эпителия альвеол и тем самым препят-ствуют слипанию их стенок. С адсорбции начинается нейтрализация микро-организмов антителами.
В клинической медицине адсорбция используется при адсорбционной тера-пии. Больному дают внутрь различные адсорбенты – энтеросорбенты (активи-рованный уголь, белую глину и др.). Они адсорбируют в кишечнике токсины микроорганизмов, газы. При отравлении солями тяжелых металлов в качестве адсорбента дают яичный белок или молоко. Для осушения мокнущих участ-ков кожи применяются различные присыпки, основным компонентом кото-рых является тальк (он адсорбирует воду). Адсорбция является основой гемо-сорбции: это метод лечения при заболеваниях печени. При этом кровь про-пускают через специальные колонки с адсорбентами и из неё удаляют про-дукты обмена.
ПАВ широко применяются в различных технологических процессах про-мышленности, в быту (моющие средства), в фармации для изготовления лекарственных форм (эмульсии, пластыри, мази). В медико-биологических исследованиях ПАВ (детергенты) применяют для разделения различных тканей на отдельные клеточные и субклеточные фракции.

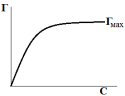 Рис.
5. Изотерма Ленгмюра.
Рис.
5. Изотерма Ленгмюра. Рис.
6. Определение параметров уравнения
Ленгмюра
Рис.
6. Определение параметров уравнения
Ленгмюра Рис.
7. Изотерма Фрейндлиха.
Рис.
7. Изотерма Фрейндлиха.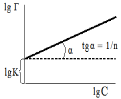 Рис.
8. Определение параметров уравнения
Фрейндлиха.
Рис.
8. Определение параметров уравнения
Фрейндлиха.