Раздел I. Поверхностные явления
Процессы, протекающие на границе раздела фаз называются поверхност-ными явлениями. Причиной поверхностных явлений служит особое состоя-ние молекул в слоях, непосредственно приле-гающих к поверхности раздела фаз, т.к. эти слои отличаются от внутренних слоев своими физико-химичес-кими свойствами (удельной энергией, плотностью, вязкостью, электропро-водностью, составом). Причем, чем больше удельная энергия системы, тем сильнее отличаются свойства и сильнее влияние поверхностных явлений на поведение системы в целом.
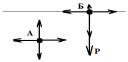
Молекулярное давление. Энергетическое состояние молекул вещества в объеме фазы и в поверхностном слое не одинаково. Молекулы, находящиеся в объеме фазы, испытывают одинаковое притяжение (и отталкивание) со сто-роны окружающих её молекул и поэтому равнодействующая молекулярных сил равна нулю. Например, молекула жидкости в точке А. На молекулу (точ-ка Б), находящуюся на границе раздела фаз, со стороны разных (прилегаю-
|
щих) фаз действуют силы разной ве-личины, и их равнодействующая Р не уравнена (не компенсирована) и она направлена перпендикулярно к поверхности в объем одной из фаз. В случае системы «жидкость – газ», она направлена внутрь жидкости, т.к. силы притяжения жидкости |
|
больше чем сил притяжения газовой фазы. Если притяжением со стороны мо-лекул газа можно пренебречь, то сила притяжения поверхностных молекул жидкости, занимающей площадь 1 м2, молекулами глубинных слоев равна внутреннему (молекулярному) давлению жидкости, т.е. силе притяжения между молекулами жидкости в объеме. Величина внутреннего давления жид-кости очень велика и зависит от полярности жидкости. Чем полярнее ве-щества, и чем больше притяжение их молекул, тем больше внутреннее дав-ление. Например, для воды 14800 атм., а для бензола – 3800 атм.
Поверхностное натяжение. Свободная поверхностная энергия. Для уве-личения поверхности жидкости (т.е. переноса вещества из объема фазы в поверхностный слой) нужно преодолеть силу внутреннего давления и совер-шить работу. Эта работа тем больше, чем больше площадь создаваемой поверхности и чем выше поверхностное натяжение. Одностороннее натяже-ние поверхностного слоя молекул называется поверхностным натяжением (σ). Оно является выражением сил сцепления между молекулами данного вещества в данном состоянии.
Энергия, затраченная на создание поверхности, пойдет на увеличение энергии молекул для вывода их из глубины фазы на поверхность. Избыток энергии поверхностных молекул по сравнению с энергией внутренних моле-кул, приходящийся на единицу площади поверхности называется свободной поверхностной энергией: F= σ.S (измеряется в Дж/м2 или эрг/см2). Как видно
6
из
формулы, поверхностное натяжение
численно равно работе образования
единицы площади поверхности или удельной
свободной энергии:
 .
Это естьэнергетическое
выражение
поверхностного натяжения. Силовое
оп-ределение поверхностного
натяжения: это сила, действующая на
поверхность по касательной к ней и
стремящаяся сократить свободную
поверхность тела до наименьших пределов.
В этом случае оно измеряется в Н/м.
.
Это естьэнергетическое
выражение
поверхностного натяжения. Силовое
оп-ределение поверхностного
натяжения: это сила, действующая на
поверхность по касательной к ней и
стремящаяся сократить свободную
поверхность тела до наименьших пределов.
В этом случае оно измеряется в Н/м.
Согласно II закону термодинамики свободная поверхностная энергия сис-темы самопроизвольно стремится к минимуму. Значит, свободная поверх-ностная энергия может снижаться за счет уменьшения площади поверхности или за счет снижения поверхностного натяжения. Уменьшение площади поверхности под действием сил молекулярного давления возможно только для жидкостей, т.к. силы сцепления её молекул не слишком велики. Поэтому мелкие капли сливаются в более крупные и капли жидкости в аэрозолях, туманах, эмульсиях имеют сферическую форму.
Снижение свободной поверхностной энергии за счет уменьшения поверх-ностного натяжения присуще как жидкости, так и твердому телу. Поверх-ностное натяжение может снижаться за счет накопления на поверхности мо-лекул другого вещества, в частности, ПАВ. Эти молекулы своим притяже-нием частично компенсируют втяжение поверхностных молекул данной фазы в глубь объема и система приобретает большую устойчивость.
Свободная поверхностная энергия и поверхностное натяжение зависят от температуры, природы фаз, природы и концентрации растворенных веществ.
С повышением температуры поверхностное натяжение снижается, т.к. уменьшается взаимное притяжение молекул. В критической точке поверх-ностное натяжение достигает нуля, т.к. при этом исчезают различия и граница раздела фаз.
Повышение давления снижает поверхностное натяжение только в системе «газ-жидкость», т.к. при этом газ по физико-химическим свойствам сбли-жается к жидкости.
Следует также отметить, что можно измерить поверхностное натяжение только жидкостей. У твердых тел это невозможно, т.к. невозможно искусственно растягивать поверхность твердого тела из-за его разрушения. По-верхностное натяжение твердых тел определяют расчетным путем. Для изме-рения поверхностного натяжения жидкостей применяют статические (методы капиллярного поднятия, лежащей или висящей капли), полустатические ме-тоды (метод максимального давления пузырька газа, метод отрыва кольца, сталагмометрический метод (метод взвешивания или счета капель). Из них прост и достаточно точен сталагмометрический метод. Он основан на том, что в момент отрыва под действием силы тяжести от конца капилляра капли жидкости, её вес практически равен силе поверхностного натяжения, прило-женной к окружности капилляра.
Для
разбавленных растворов, плотность
которых мало отличается от плотности
воды, поверхностное натяжение можно
вычислить по уравнению (мДж/м2):
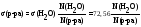 .
.
Адгезия и когезия. Поверхностные явления имеют важное значение в фармации, т.к. большинство лекарств − порошки, таблетки, эмульсии, сус-пензии, аэрозоли, мази и др. являются дисперсными системами. В производ-стве лекарств чаще всего приходится сталкиваться с такими явлениями, как адсорбция, смачивание, адгезия.
Притяжение, возникающее между двумя разнородными (твердыми или жидкими) телами при их соприкосновении называется адгезией (от лат adhaesio притяжение, сцепление»). Она характеризует силу сцепления разно-родных веществ и измеряется работой, затраченной на отрыв молекул одной фазы от молекул другой фазы (измеряется в Дж/м2). Эта работа рассчиты-вается по уравнению Дюпре-Юнга: WA = σж-г (1 + cosӨ). На явлениях адгезии основано действие клеев, связующих веществ, покрытий. Она влияет на рас-падаемость таблеток, прочность оболочек, растворение твердых лекарствен-ных форм, используется для характеристики материалов, применяемых в хирургии и стоматологии.
Сцепление однородных молекул, атомов, ионов, которое включает все ви-ды межмолекулярного, межатомного и межионного притяжения внутри од-ной фазы называют когезией (лат.«связь»). Она характеризует прочность ве-щества и измеряется работой, необходимой для разрыва вещества (преодоле-ния сил сцепления между молекулами) и создания двух новых единиц поверхностей. Величина сцепления численно равна удвоенному значению поверхностного натяжения: Wког. = 2σ.
Основные понятия адсорбционных процессов. Твердое тело или жид-кость, на поверхности которых происходит адсорбция, называется адсорбен-том, а адсорбирующееся вещество – адсорбатом или адсорбтивом. Процесс самопроизвольного накопления вещества на границе раздела фаз называется адсорбцией (Г). Она выражается количеством вещества, адсорбированного единицей поверхности или массы (моль/м2 , моль/г). Адсорбция, осуществ-ляющая под действием сил Ван-дер-Ваальса и водородных связей, называется физической. Адсорбция, в основе которой лежит возникновение ковалентных связей между молекулами адсорбента и адсорбтива, называется химической или хемосорбцией. Физическая адсорбция представляет обратимый процесс и сопровождается десорбцией (освобождением поверхности от адсорбирован-ного вещества). Между адсорбцией и десорбцией устанавливается динами-ческое равновесие, положение которого зависит от температуры. Повышение температуры понижает физическую адсорбцию и усиливает химическую адсорбцию. Десорбция осуществляется разрушением адсорбента, изменением температуры и снижением сил адсорбционного взаимодействия. Последняя широко используется в виде элюции. Элюция – это смена граничащей с ад-сорбентом фазы, например раствора, в целях десорбции вещества. При элю-ции адсорбированное вещество вытесняется с адсорбента молекулами нового растворителя или в результате понижения адсорбционного сродства веществами, растворенными в новом растворе (чаще всего путем изменения заряда молекул адсорбента и адсорбтива вследствие изменения рН или ионной силы раствора).
Характерным признаком адсорбции является её избирательность (специ-фичность). Это означает, что каждый адсорбент адсорбирует одно или нес-колько определенных веществ. Избирательность адсорбции предполагает случайное совпадение в распределении электронной плотности молекул адсорбента и адсорбтива по типу «ключ – замок», т.е. химическое сродство между адсорбентом и адсорбтивом.