
konspect_lectsiy-ln_lm
.pdfПроцеси, апарати та машини галузі –3. Масообмінні процеси
Конспект лекцій.
Лектор: Я.М. Корнієнко

Розділ 1 Основи теорії масообміну
Тема 1.1 Вступ. основні визначення. Стан рівноваги.
Основи масопередачі. Загальні відомості
Технологічні процеси, швидкість перебігу яких визначається швидкістю переносу речовини із однієї фази до іншої називають масообмінними процесами, а апарати, призначені для проведення цих процесів – масообмінними апаратами.
Види процесів масопередачі
1.Абсорбція – поглинання газу рідиною, характеризує перехід речовини з газової фази
врідку. Зворотній процес виділення газу з рідини називається десорбція.
2.Ректифікація – розділення гомогенних рідких сумішей, які відрізняються температурою кипіння, багаторазового взаємного обміну компонентами між рідкою і паровою фазами, що рухають протитечії.
3.Адсорбція – поглинання компоненту газу, пари, або розчину твердим пористим поглиначем.
4.Екстракція – вилучення речовини з твердого тіла або рідини розчинником, до якого переходить вилучена речовина.
5.Кристалізація – виділення твердої фази з розчинів або розплавів.
6.Розчинення – перехід твердої фази до рідкої.
Фізична суть процесів масопередачі
У макроскопічній системі, яка знаходиться у нерівноважному стані, виникають термодинамічні потоки.
Термодинамічні потоки, пов’язані з переносом речовини чи енергії імпульсу з однієї частини середовища в іншу, виникають у випадку, якщо значення тих чи інших фізичних параметрів різні в різних точках середовища. При наявності в середовищі різної концентрації якої-небудь домішки виникають дифузійні потоки, у випадку різної температури – теплові потоки, при різній швидкості плину – потоки імпульсу, чи кількості руху. У першому випадку говорять про явище дифузії, в другому – про явище теплопровідності, в третьому – про явище в’язкості.
Дифузією називається процес мимовільного вирівнювання концентрацій речовин у сумішах, яка спостерігається в різних середовищах, але її швидкість сильно залежить від агрегатного стану речовини. У газах це явище відбувається досить швидко, що можна, зокрема, спостерігати по тому, як відбувається поширення запахів у повітрі. У рідинах явище дифузії відбувається значно повільніше і виявляється, наприклад, при розчиненні в них твердих тіл чи при взаємному змішуванні різних рідин. Для спостереження дифузії у твердих тілах звичайно необхідний дуже великий час.
Процеси переходу речовини з однієї фази до іншої здійснюються за рахунок конвективної і молекулярної дифузій в напрямку досягнення рівноваги. Ці процеси відбуваються в роздільній апаратурі за такою схемою:
сировина, яка не прореагувала
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Масооб- |
|
|
сировина |
|
|
Реактор |
|
|
|||
|
продукти |
мінний |
продукти |
|||||
|
|
|
|
|
||||
|
|
|
|
|
реакції |
апарат |
розділення |
|
|
|
|
|
|
|
розділення |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 17.1. Структурний зв’язок реактора з масообмінним апаратом
Метою даного розділу курсу є вивчення фізичних і технологічних засад в апараті розділення (масообмінний апарат) і аналіз конструктивних особливостей цих апаратів, розгляд підходів щодо їх технологічного та конструктивного розрахунку.
Розрахунок масообмінних апаратів ґрунтується на механізмі переносу маси речовини, для чого необхідно знати:
-основні закони розподілення компонентів;
-робочі режими процесу;
-кінетику процесу дифузії.
Розв’язок такої задачі ґрунтується на відповідній математичній моделі, яка враховує всі сторони процесу і ґрунтується на:
-рівнянні матеріального балансу;
-рівнянні рівноваги;
-рівнянні гідродинаміки потоків;
-рівнянні кінетики процесу;
-рівняннях граничних і початкових умов.
Основні визначення
Масопередача – процес переносу речовини з однієї фази до іншої через межу розділу
середовищ до досягнення стану рівноваги.
Масовіддача – процес переносу речовини в межах однієї фази.
Впроцесах масообміну розрізняють речовину, яка переходить із однієї фази до іншої
–цільовий компонент, та речовину, яка не приймає участь у масопередачі – носій.
Приклад: Із газової суміші аміак – повітря при контакті з водою відбувається поглинання аміаку. Тобто аміак є цільовим компонентом, а повітря – носієм.
При переносі речовини концентрація цільового компонента в кожній із фаз змінюється. Швидкість зміни концентрації цільового компонента визначає швидкість перебігу процесу і називається кінетикою процесу масопередачі.
Кінетика процесу характеризує залежність між рушійною силою процесу і кількість перенесеної речовини:
М = f (x),
де х – поточна концентрація цільового компонента.
Якщо записати кількість переданої речовини через дифузійний потік, як кількість речовини М, яка буде передана за час через поверхню F:
q M f ( x )
F
Таким чином, для визначення кількісних характеристик дифузійного потоку необхідно визначити функцію f(x), що пов’язано з визначенням концентрацій компонентів в потоках окремих фаз.
Основне рівняння масопередачі
Основне рівняння масопередачі ґрунтується на кінетиці процесу, яка визначає швидкість переносу речовини. Запишемо рівняння кінетики хіміко-технологічних процесів стосовно масообмінних процесів:
dFddM R ,
де dM – кількість цільового компонента, яка переходить із однієї фази до іншої; dF –поверхня контакту фаз; d – час контакту фаз; – рушійна сила процесу; R – опір процесу масопередачі (дифузійний опір).
Тобто: швидкість процесу масопередачі прямо пропорційна рушійній силі процесу і обернено пропорційна дифузійному опору.
Виконавши заміну R1 K - коефіцієнт масопередачі, основне рівняння масопередачі в загальному виді можна записати

dM* K dFd |
(17.1) |
Якщо кількість переданої речовини dM* віднести до d , тоді рівняння (17.1) набуває вигляду
dM dM * K dF d
Для розрахунку розмірів апаратів необхідно визначити загальну поверхню контакту фаз F, для цього необхідно визначити кількість перенесеної речовини М, розрахувати коефіцієнти масопередачі К та визначити рушійну силу процесу .
Способи вираження концентрацій бінарних сумішей
Бінарна суміш складається з компонентів А і В, можна визначити такими способами: 1. Масова частка. Позначимо масу компонента А - mA, а масу компонента В – mВ. Тоді
маса суміші двох компонентів виразиться
m = mA + mB
Звідси масові частки компонентів А і В відповідно розраховується:
a A |
m |
A |
|
m |
A |
|
|
|
|
||||
m |
|
|
||||
|
|
mA mB |
||||
|
mB |
|
mB |
|
||
aB |
|
|
||||
m |
|
|
|
|||
|
|
|
|
|||
|
|
mA mB |
||||
При цьому виконується умова aA + aB = 1.
Відповідно масові відсотки компонентів А і В розраховується за виразами:
a |
|
|
mA |
100 ; |
a |
|
|
mB |
100 |
A |
|
B |
|
||||||
|
|
m |
|
|
m |
||||
|
|
|
|
|
|
||||
2. Мольна частка.
Якщо nA і nB – відповідно число кіломолей компонента А і компонента В, то сумарне число кіломолей:
n = nA + nB
Мольні частки компонентів А і В розраховується за виразом:
x |
|
|
nA |
; |
x |
|
|
nB |
A |
|
B |
|
|||||
|
|
n |
|
|
n |
|||
|
|
|
|
|
|
|||
При цьому хA + хB = 1.
Примітка: Зазвичай позначають через х концентрацію цільового компонента в рідкій фазі, а через y – концентрацію цільового компонента в газовій (паровій) фазі.
Формули перерахунку масової концентрації в мольну.
Позначимо молекулярну масу компонентів А і В відповідно А і В. Візьмемо 1 кг суміші цих двох компонентів, що містять масові частки аА і аВ. Тоді число кіломолей компонента А визначиться як:
nA 1 aA ,A
а число кіломолей компонента В
nB 1 aB
B
Загальне число кіломолей в суміші буде:
n nA nB aA aB
A B
Звідси мольна частка компонента А:
|
|
|
|
|
a A |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
||||
xA |
|
|
|
|
|
|
|
|
||||
a A |
|
|
|
aB |
|
|||||||
|
|
|
|
|
|
|
||||||
|
|
|
A |
|
B |
|
|
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||
і компонента |
|
|||||||||||
|
В |
|||||||||||
|
|
|
|
|
aB |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
B |
|
|
|
|
|||
xB |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
a A |
|
|
aB |
|
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
A |
|
|
|
|
B |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
Умови нормування: хА+хВ=1.
Зворотній перерахунок мольної частки у масову проводиться за формулою:
|
aA |
|
A xA |
; |
|
|
A xA |
B xB |
|||
|
|
|
|
||
тобто M A A xA ; M B |
B xB |
|
|
|
|
3. Об’ємна концентрація Об’ємна масова [кг/м3] та об’ємна мольна [кмоль/м3] концентрації.
Нехай маса 1м3 суміші дорівнює М. Тобто це густина, яка виражається за формулою:
CA CB C ,
звідси масова частка компонента А дорівнює
aA CA ; aB CB .
4. Відносна масова і мольна концентрації В процесі абсорбції при складанні рівняння матеріального балансу зручніше виражати
концентрації у вигляді відношення маси речовини цільового компонента до маси речовини
|
кг NH 3 |
|
кмоль NH 3 |
|
носія. Наприклад: суміш NH3 – повітря: |
|
або |
|
. |
кг повітря |
кмоль повітря |
|||
Якщо масова частка компонента А цільовий компонент позначити через – аА, а масову частку компонента В (носій) то аВ = 1 – аа,
тоді відносна масова частка компонента А визначається за виразом
X A |
|
|
aA |
|
aA |
||
|
1 |
||
êã À :êã Â
Якщо через ха позначати мольну частку компонента, а через ха = 1 - ха, тоді відносна
кмольА мольна частка компонента А виразиться:
кмольВ
|
|
|
|
|
xA |
|
X A |
|
; |
||||
|
xA |
|||||
|
|
|
1 |
|
||
Зворотній перерахунок відносної концентрації в мольну проводиться за виразом:
X
xA A ;
1X A
5.Вираження концентрації через парціальний тиск компонентів. Парціальний тиск в суміші газів пропорційний концентрації компонентів.
Згідно закону Дальтона тиск суміші газів дорівнює сумі парціальних тисків
компонентів:
Р = рА + рВ

де Р і V – величини пропорційні, тобто РАV = РVА і тоді об’ємна частка компонента
А:
VA VA PA V P
Враховуючи те, що об’єм кілограм молекул газу займає 22.4 м3, то об’ємна частка дорівнює мольній, тобто
A y A , звідки
yA VA PA V P
і парціальний тиск компонента А:
рА = РyA
Формули перерахунку парціального тиску у відносні концентрації
Р– тиск суміші газів:
Р= рА + рВ
рА – парціальний тиск компонента А; рВ = Р – РА – парціальний тиск компонента В.
Газові константи компонентів А і В визначаються за виразами:
RA R ; RB R ,
A B
де R – універсальна газова константа, А і В – молекулярна маса компонентів А і В. Запишемо рівняння газового стану для цільового компонента А:
PAV M A R T
A
і компонента В (носія): P V M |
|
R |
T , |
|
B |
|
|||
B |
B |
|
||
|
|
|
|
|
якщо РВ = Р – рА, тоді:
P pA M B R T
B Розділимо почленно рівняння (17.2) і (17.3)
pA |
|
M A B |
P pA |
M B A |
Враховуючи те, що
M A YA M B
відносна масова концентрація, вираз (17.4) приводимо до виду:
M A |
|
pA |
|
A |
|
|
|
||
M B |
( P pA ) |
B |
||
З урахуванням виразу (17.5) остаточно одержимо:
YA |
|
pA A |
|
( P pA ) B |
|||
|
|
Ці формули широко застосовуються при розрахунку процеса абсорбції.
(17.2)
(17.3)
(17.4)
(17.5)
Рівновага при масопередачі Правило фаз
При масопередачі має місце наявність двох фаз. Цільовий компонент переходить з однієї фази до іншої до встановлення стану рівноваги.
Кінець процесу масопередачі (теоретичний) визначається станом рівноваги, який залежить від умов проведення процесу – температури, і тиску. Умови, при яких система знаходиться в стані рівноваги, можуть змінюватись.
Для визначення умов стану рівноваги застосовується правило фаз, яке визначає кількість параметрів N, які можна змінювати довільно, не порушуючи стану рівноваги в системі:
К + 2 = Ф + N
де К – число компонентів системи; Ф – число фаз;
N – число ступенів свободи (число змінних параметрів, які можна змінювати без порушення стану рівноваги).
Розглянемо деякі випадки:
1.Для води при t = 0,0075 С і Р = 6100 Па існують всі три фази, так звана потрійна точка. Для цього випадку число компонентів К = 1, число фаз Ф = 3, число ступенів свободи:
N = К + 2 – Ф = 1 + 2 – 3 = 0
Тобто не можна змінювати жодного параметра без порушення стану рівноваги.
2.Система вода – насичена пара: К = 1; Ф = 2. Число ступенів свободи:
N = К + 2 – Ф = 1 + 2 – 2 = 1
Одна ступінь свободи. Тобто не порушуючи стану рівноваги, можна змінювати або температуру, або тиск. Змінюючи температуру, змінюємо тиск, зберігаючи рівновагу в системі, тобто забезпечуючи існування як рідини, так і пари.
Для води широко застосовуються залежності Р = f(t) і t = f(P), які характеризують рівноважний стан системи і наведені в термодинамічних таблицях.
3. При масопередачі часто зустрічаються випадки, коли К = 3 (абсорбція) – цільовий компонент і два носії в двох фазах; і К = 2 (ректифікація) коли інертний носій відсутній. Число фаз в обох випадках Ф = 2.
Для цих випадків:
N1 = 3 + 2 – 2 = 3
N2 = 2 + 2 – 2 = 2
Тобто стан рівноваги може бути збережений при N1 = 2 і N2 = 3 параметрів. До цих параметрів відносяться: температура t, тиск Р та концентрація цільового компонента в одній із фаз у або х.
Таким чином при Р = const i t = const зберігається рівновага, тобто кожній
концентрації в одній фазі відповідає рівновага в другій: |
|
yP = f(x) |
(3.30) |
Зазвичай при проведенні процесів масопередачі підтримують |
постійним один із |
незалежних параметрів (Р = const) або (t = const). Якщо Р = const, то кожній температурі t буде відповідати цілком визначена концентрація х або у. І кожному значенню тиску (при t = const) відповідає певне значення х або у.
Криві рівноваги
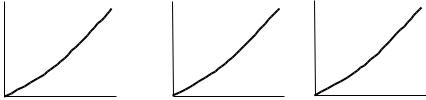
Таким чином, умови існування стану рівноваги при масопередачі можна описати за допомогою залежностей тиск-концентрація: P = f(x) при t = const; температура-концентрація: t =f(x) при Р = const і концентрація в одній фазі – рівноважна концентрація в іншій – yP = f(x). Ці залежності можуть бути виражені за допомогою фазових діаграм, рис. 17.2, 17.3.
P |
|
t |
Y |
|
|
|
|
t=f(x) |
YP=f(X) |
|
P=f(x) |
|
|
|
|
|
|
|
|
a) |
X |
б) |
X в) |
X |
Рис. 17.2. Фазові діаграми рівноваги:

а) P = f(x) при t = const; б) t =f(x) при Р = const; в) yP = f(x) при Р = const, t = const.
Y |
Y |
t1 |
P3 |
t2 t3 |
P2 P1 |
a) |
X |
б) |
X |
Рис. 17.3. Залежність yP = f(x) при різних значеннях температури і тиску:
а) yP = f(x) при Р = const і t1 > t2 > t3.б) yP = f(x) при t = const, і Р1 > Р2 > Р3.
Криві рівноваги являють собою геометричне місце точок, які характеризують стан рівноваги між двома фазами Тобто, кожна точка на кривій рівноваги визначає кінцевий стан системи, або з точки зору технології, кінець процесу масопередачі на даній ділянці.
Найбільш поширена залежність, яка наведена на графіках
YP = f(x)
по яких, знаючи концентрацію в одній фазі х та умови проведення процесу – знаходять рівноважну концентрацію, а тому час перебігу процесу, розміри та об’єм апаратів.
Відношення концентрацій в двох фазах при рівновазі називається коефіцієнтом розподілення
m Y P x
і є тангенсом кута нахилу лінії рівноваги. Якщо лінія рівноваги крива, то m – величина змінна.
Для конкретних випадків масопередачі побудова ліній рівноваги проводиться на підставі законів, які характеризують цю рівновагу – закона Генрі і закона Рауля.
Закон Генрі
Закон Генрі характеризує залежність між розчинністю газу і його парціальним тиском. Застосовується при абсорбції, коли із суміші газів (2 компоненти – цільовий
компонент і носій) цільовий компонент переходить до іншої фази – рідкого поглинача. Тобто К = 3; Ф = 2. Число ступенів свободи N = К + 2 – Ф = 3 + 2 – 2 =3.
Тобто 3 параметра, які характеризують стан рівноваги системи: температура, концентрація цільового компонента в рідині і тиск (парціальна пружність парів над рідиною).
При t = const і P = const (загальний тиск) парціальний тиск компонента розчиненого
газу А – рА пропорційний його мольній частці в розчині - хА. |
|
рА = хА, |
(17.6) |
де – константа Генрі.
З іншої сторони парціальний тиск компонента – це частка загального тиску Р.
Якщо в стані рівноваги YР – рівноважна концентрація в суміші, то за законом Дальтона
|
|
|
рА =YРР |
(17.7) |
Прирівнявши праві частини рівняння (17.6) і (17.7): |
|
|||
|
|
|
YРР = хА |
|
y P |
xA , позначимо |
|
m , запишемо закон Генрі у формі: |
|
|
P |
P |
|
|
yP mxA
Тобто залежність концентрації цільового компонента в рідині і рівноважної концентрації в газі є лінійною і характеризується прямою лінією з тангенсом кута нахилу m,
рис. 17.4.
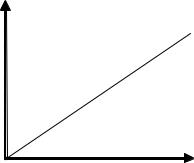
Y
YP=mX
X
Рис. 17.4. Залежність yP mx
Закон Генрі для розбавлених розчинів
Якщо система не підлягає закону Генрі то m const , а лінія рівноваги – крива, яка будується за дослідними даними.
Якщо виразити концентрацію цільового компонента у відносних концентраціях, то закон Генрі запишеться:
|
|
|
Y p |
m |
|
X |
, |
|
|
|
|
1 Y p |
1 X |
||||
звідки |
|
|
|
|
|
|
|
|
Y p |
|
|
mX |
|
|
|
mX |
|
|
|
|
|
|
|
|||
|
X mX |
1 ( 1 m )X |
||||||
1 |
|
|
||||||
При незначних концентраціях газу в рідині
(1 – m)X 0
і рівняння кривої рівноваги запишеться як yP mX
що є рівнянням прямої лінії.
Закон Рауля
Закон Рауля визначає умови стану рівноваги системи рідина – насичена пара, що має місце в процесах ректифікації та дистиляції.
Для бінарної суміші двох рідин, які містять компоненти А і В, згідно закону Рауля, визначається:
Парціальний тиск компонента в парах над рідиною дорівнює пружності насиченої пари даного компонента помноженого на його мольну частку в рідині.
|
|
pA |
|
|
|
|
|
|
||
PA xA , |
(17.8) |
|||||||||
|
|
|
|
|
|
|
|
|||
де PA – пружність насиченої компонента А; |
|
|||||||||
хА – мольна частка компонента в рідині. |
|
|||||||||
Згідно закону Дальтона парціальний тиск компонента А в рідині |
|
|||||||||
|
|
pА = уР Р, |
|
|||||||
звідки |
|
|
|
|
|
|||||
|
|
y P |
|
PA |
|
|
(17.9) |
|||
|
|
|
P |
|||||||
|
|
|
|
|
|
|
||||
Враховуючи те, що Р = pА + pВ, то вираз (17.9) запишеться |
|
|||||||||
|
|
y P |
|
pA |
|
(17.10) |
||||
|
|
pA |
pB |
|||||||
|
|
|
|
|||||||
Виконавши підстановку в рівняння (17.10) парціальних тисків компонентів і застосувавши співвідношення (17.8) одержимо:
|
|
|
|
|
|
|
|
|
|
|
|
|
y P |
|
|
|
|
PA xA |
|
|
(17.11) |
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
P x |
A |
P ( 1 x |
A |
) |
|||||||
|
|
A |
|
|
|
B |
|
|
||||
Примітка: хА + хВ = 1
Рівняння (17.11) описує криву рівноваги для ідеальних рідких систем.
|
|
|
|
|
|
Позначивши |
|
PA |
– відносна леткість пари чистих компонентів і розділивши |
||
|
|
|
|||
PB |
|||||
|
|||||
почленно на PB праву частину виразу (17.11), одержимо:
yP |
|
xA |
|
|
xA |
( 1 xA ) |
|||
|
||||
y |
yP=f(x) |
x |
Рис. 17.5. Крива рівноваги системи рідина – насичена пара для ідеальних систем.
Примітка: Леткий компонент – це компонент, який має найбільшу пружність пари при даній температурі в порівнянні з іншим компонентом і має найменшу температуру кипіння.
Для ідеальних систем з будь-яким числом компонентів можливо записати рівняння:
уА + уВ + уС + … +yN = 1
звідки
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
y P |
|
|
|
|
|
|
PA xA |
|
PA |
|||||
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PA xA |
PB xB |
PC xC ... PN xN |
|
P |
||||||||||
|
|
|||||||||||||
Тема 1.2 Дифузійне перенесення маси в рухомих середовищах
Матеріальний баланс процесів масообміну Робоча лінія
Розглянемо схему протиточного апарату ідеального витіснення, в якому неперервно проходить зміна робочих концентрацій по висоті, причому робочі концентрації не дорівнюють рівноважним (рис. 17.6).
