
konspect_lectsiy-ln_lm
.pdf
P P
x |
x |
t |
t |
tB |
А |
А |
tB |
|
|
|
tA |
tСМ |
tСМ |
x |
x |
y |
y |
|
|
А |
|
|
А |
x |
x |
xА |
xА |
|
|
а |
б |
Рис. 19.5. Фазові діаграми рівноваги рідина – пара для реальних систем:
а (мінімальна) характерна для сумішей типу етиловий спирт – вода, спирт – бензол; б (максимальна) характерна для сумішей азотна кислота – вода.
Рідини взаємно нерозчинні одна в одній
До таких систем можливо віднести бінарні системи: вода-бензол, вода-сірковуглець, тощо. Бінарна суміш таких рідин утворює два шари. Для такої системи існує тільки одна ступінь
свободи, розрахована за виразом:
N = K+2-Ф=2+2-3=1,

де Ф – число фаз, Ф = 3.
Тобто існує тільки один параметр, який можна змінювати без зміни стану рівноваги. Зазвичай вибирають тиск, температуру або склад пари.
При заданій температурі кожний компонент має тільки той тиск, якщо він був би ізольований. Тобто окремий компонент поводить себе незалежно, та заданий тиск пари суміші дорівнює
сумі тисків чистих компонентів при даній температурі. Суміш закипає при тиску:
Р = РА + РВ
Парціальний тиск компонента не залежить від концентрації, а дорівнює пружності насиченої
пари
рА=РА
Концентрація пари над киплячою сумішшю є незмінною і не залежить від концентрації компонентів в рідині:
y |
|
|
pA |
|
PA |
const, i y |
|
|
PB |
A |
|
|
B |
|
|||||
|
|
P P |
|
P |
|||||
|
|
|
|
|
|||||
Звідси
yA PA const yB PB
Або, якщо перейти до масових співвідношень (GA=yAMA)
GA |
|
yAM A |
|
PAM A |
|
, |
|||
|
|
( P P )M |
|
||||||
G |
|
y |
B |
M |
B |
B |
|||
B |
|
|
|
A |
|||||
де МА, МВ – молекулярні маси компонентів А і В.
Фазові діаграми таких сумішей мають такий вигляд:
P |
t |
|
y |
|
P=PA + PB |
|
|
|
pA = PA |
|
|
|
tB |
a |
b |
|
|
||
|
pB = PB |
|
tA |
|
|
|
|
|
|
|
tCM |
|
x |
|
x, y |
|
|
|
|
|
а |
|
б |
a |
|
|
b |
xаз |
x |
|
|
|
в |
Рис. 19.6. Діаграми рівноваги для рідин, що не розчиняються одна в одній
аР –Х, б t – X,Y, в Y – X.
Здіаграми рис. 19.6б видно, що температура кипіння суміші tCM менше температури кипіння чистих компонентів - tА і tВ і при Р = const не залежить від хімічного складу рідкої фази (пряма аb – паралельна вісі Х б)). Цю властивість використовують при перегонці з водяним паром.
Визначення температури кипіння суміші рідин, що не змішуються
Температура кипіння такої суміші може бути визначена за графіком (рис. 19.7). На вісі абсцис відкладаємо температуру, а по вісі ординат – тиск.

P=Pабс
P
D
PA=f(t)
PB
F
PA
PB=f(t)
0 |
tk |
t |
Рис 19.7. Визначення температури кипіння рідин, які не змішуються
Наносимо пунктиром допоміжну пряму загального тиску для суміші двох компонентів А і В – Р. Будуємо криву залежності тиску від температури для компонента А РА = f(t).Криву залежності РВ = f(t) для другого компонента відкладаємо обернено від точки D. В точці перетину F загальний тиск Р дорівнює сумі тисків РА + РВ. Абсциса точки перетину визначить температуру кипіння суміші tк.
Ця температура буде зберігатися, доки в суміші є навіть мінімальна (сліди) другого компонента.
Рідини, які частково змішуються
Ці рідини займають проміжне місце між добре і нерозчинними рідинами і до них відносяться, наприклад, вода-фенол, вода-анілін, тощо.
Однорідність рідини зумовлюється концентрацією. Додавання ефіру до води утворює однорідну суміш.
З моменту утворення насиченого розчину ефіру у воді і води в ефірі утворюється суміш двох нерозчинних рідин. Подальше додавання ефіру приводить знов до утворення рідини, що являє собою розчин води в ефірі.
Зазвичай такі суміші розділяються екстрагуванням.
y
а |
b |
|
|
x
x1 |
x2 |
Рис. 19.8. Діаграма y-x для рідин, що частково змішуються
Крива рівноваги в діаграмі y-x для таких рідин наведена на (рис. 19.8.) В межах значень концентрації x1xx2 – рідини не розчинні, в межах 0 x x1 та x > x2 – розчинні.

Проста перегонка
При перегонці здійснюється часткове розділення компонентів. Процес ґрунтується на відмінності концентрації низько киплячого компоненту в рідині та утворенні пари.
Рідину, яка підлягає перегонці, випаровують в кубі колони, а утворену пару відводять і конденсують. Пара знаходиться в рівновазі з рідиною, що залишилась. При простій перегонці неможливо отримати дистилят з високим вмістом низько киплячого компоненту. Зазвичай, цей процес використовують для попереднього розділення сумішей (нафтохімія або у випадку, якщо температура кипіння компонентів суттєво відрізняється)
До основних видів перегонки відноситься: однократне випаровування, проста перегонка, перегонка з дефлегмацією, перегонка з водяною парою та в струмені інертного газу, молекулярна перегонка.
Однократне випаровування
Сутність процесу полягає в тому, що частина рідини, яка підлягає розділенню, випаровується і вся утворена пара знаходиться в рівновазі з рідиною, що залишиться.
Схема наведена на рис. 19.9.
D2y
y
F1x1
y |
B |
C |
|
||
W1x2 |
|
A |
|
|
x2 |
x1 |
x |
а |
б |
Рис. 19.9. Схема процесу однократного випаровування
З рисунку видно, що в апараті повного змішування рівноважний склад пари відповідає складу рідини, яка відводиться з апарату.
Рівняння матеріального балансу запишеться :
Fx1 = Wx2 + Dy = Wx2 +(F – W)y.
або |
|
|
|
|
F(x1 – y) = W(x2 – y), |
|
|||
звідки |
|
|
|
|
W |
|
x1 |
y |
(19.4) |
F |
|
x2 |
y |
|
Останнє рівняння разом з рівнянням рівноваги Yp = f(x) може бути розв’язано шляхом підбору, або графічно.
З рівняння (19.4) і (рис. 19.9а) випливає
F |
|
y x2 |
або |
F W |
|
x1 x2 |
K tg |
|
W |
y x |
W |
y x |
|||||
|
|
|
|
|||||
|
1 |
|
|
1 |
|
|||
Графік, (рис. 19.9б), дає можливість визначити величину К, а за її допомогою і кількість кубової рідини
W |
F |
|
|
. |
|
K 1 |
||

Фракційна перегонка
Це періодичний процес, в якому по мірі перегонки зменшується концентрація низько киплячого компонента в кубі, і, як наслідок, зменшується вміст летких компонентів в парі і, відповідно, в кожній послідуючій порції дистиляту вміст летких компонентів зменшується.
|
2 |
Вихідна |
|
суміш |
Продукт |
|
|
Пара |
|
3
Конденсат
1
Рис. 19.10. Схема установки для простої (фракційної) перегонки
1 – куб колони, 2 – конденсатор, 3 – збірники дистиляту
При простій перегонці, яка проводилася періодично, суміш завантажується до куба 1, який обігрівається паром через змійовик або рубашку, або димовими газами (рис 19.10).
Після нагріву суміші до температури кипіння, пари, що утворюється, відводяться з куба, конденсуються в теплообміннику 2 і конденсат надходить до збірників 3. Залишок видаляється з кубу після закінчення процесу.
З часом вміст леткого компонента (низько киплячого) в дистиляті безперервно зменшується і набуває максимальних значень на початку і мінімальних в кінці перегонки. Це дозволяє у випадку необхідності одержувати декілька фракцій з різним вмістом низько киплячого компоненту,
називають фракційною перегонкою.
Розрахунок процесу простої перегонки
До кубу завантажують вихідну масу W з концентрацією низько киплячого компоненту x. За час d маса рідини зменшиться на величину dW і концентрація в кубі колони зменшиться на величину dх. До парової фази перейде з рідкої фази dW летких речовин з рівноважною концентрацією НК – у. В пар перейде dWу летких речовин. Тобто на початку процесу в суміші було летких речовин W x. В кінці процесу в суміші залишилось летких речовин (за час d )
(W – dW)(х-dx).
Тоді рівняння матеріального процесу по леткому (низько киплячому) компоненту
Wx = (W –dW)(х-dx) + dW y.
Виконавши перетворення та нехтуючи нескінченно малою величиною dW dх, одержимо:
Wdx = (y – x)dW.
або
dW |
|
dx |
|
W |
y x |
||
|
Позначивши початкову кількість в кубі W0 з концентрацією низько киплячого компонента Х0. Кількість рідини, яка залишилася після перегонки - W1 з концентрацією – Х1.
Виконавши інтегрування правої частини в межах від W0 до W1 і правої від Х0 до Х1

|
|
W1 dW |
X1 |
dX |
|
|
|
|||||||
|
|
W |
|
|
X |
|
|
|
|
|
|
|
||
|
|
W |
y x |
|
|
|
||||||||
|
|
0 |
|
|
0 |
|
|
|
|
|
|
|
||
|
W |
|
X1 dX |
|
|
W |
|
|
|
|||||
1 |
|
|
|
|
|
1 |
|
|
|
|||||
ln |
|
|
|
|
2.3lg |
|
|
|
|
(19.5) |
||||
W |
y x |
W |
|
|
||||||||||
0 |
|
X 0 |
|
|
0 |
|
|
|
||||||
Звідси знаходимо кількість кубового залишку W1 і кількість отриманого дистиляту: |
||||||||||||||
|
|
|
|
|
D = W0 – W1 |
|
|
|
||||||
Інтеграл в правій частині визначається методом графічного інтегрування. |
|
|||||||||||||
Це площа F під кривою, побудована в координатах |
|
1 |
та в межах від Х0 |
до Y1. Значення (y |
||||||||||
|
|
|||||||||||||
y x |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
– x) визначається за допомогою y – x – діаграми, m – масштаб діаграми.
1
y x
|
x1 |
dx |
|
|
|
|
|
|
Fm |
|
|
|
y x |
|
|
||
|
x |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
х |
х1 |
|
|
х0 |
||
Рис. 19.11. Графічне інтегрування
Проста перегонка з дефлегмацією
Ступінь розділення в умовах простої перегонки може бути підвищена із застосуванням дефлегмації, (рис. 19.12).
В цьому випадку, речовини, які відводяться з кубу 1, надходять до дефлегматора 2, в якому вони частково конденсуються.
При частковій конденсації конденсується переважно менше леткий компонент, а пара збагачується летким компонентом. Конденсат, що утворюється в дефлегматорі, повертається до кубу і піддається багатократному випаровуванню.
Вивід рівняння (19.5) вірний і для перегонки з дефлегмацією, тільки з тією різницею, що у всіх рівняннях концентрація пари Y є рівноважною з концентрацією НК в рідині х, необхідно замінити на концентрацію пари у', яка виходить з дефлегматора, рівняння (19.5) набуває вигляду
X
2,3lg F F dX (19.6)
W XW y' x

 2
2
Вихідна
суміш 
Пара
Конденсат
1
3 |
Дистилят
4
|
|
Рис. 19.12. Схема установки з простою дефлегмацією |
|
|||
|
1 – куб, 2 – дефлегматор, 3 – конденсатор, 4 – збірники продукту. |
|
||||
Концентрація |
у' |
визначається |
з |
матеріального |
балансу |
дефлегматора, |
(рис. 19.13).
y
|
|
|
y' |
|
Пара з куба |
|
Дистилят |
y |
|
Дефлегматор |
||||
|
|
|||
|
|
|
||
(Ф+Р), у |
|
P1, y' |
|
|
|
|
y'–y
B
A D C
Флегма |
Ф, x' |
y–x'
0 |
x |
x' y |
x |
Рис. 19.13. До визначення матеріального балансу простої перегонки з дефлегмацією.
Нехай кількість флегми – Ф, а концентрація НК – х', але х' і у' знаходяться у рівновазі. Кількість пари, яка надходить з кубу до дефлегматора, буде (Ф + Р), а концентрація пари у знаходиться у рівновазі із складом рідини в кубі х.
Матеріальний баланс дефлегматора:
(Ф+Р)у = Рy' + Фx'
Розділивши обидві частини рівняння на Р і вводячи флегмове число R, одержимо:
(R+1)y = y' +Rx', звідки
R ( y' y) y x'
На (рис. 19.13) точка А відповідає стану пари перед дефлегматором, а точка В – стану пари після дефлегматора.
Проведемо через точку А горизонтальну лінію АС до перетину з діагоналлю, точку С з’єднаємо з точкою В, а з т. В проведемо вертикальну лінію до перетину з лінією АС. Довжина відрізка ВD дорівнює (y' – y), а довжина відрізка DC дорівнює (y – x'). Таким чином,

tg y' y , y x'
Порівнюючи цей вираз з рівнянням (3.176), знаходимо: tg = R
Звідси випливає, для побудови точки В потрібно з точки А провести горизонтальну лінію до перетину з діагоналлю, а через одержану на діагоналі точку провести пряму під кутом до вісі абсцис, тангенс якого дорівнює R. Точка перетину цієї прямої з лінією рівноваги і буде точкою В, яку потрібно визначити, ордината цієї точки В дорівнює концентрації пари після дефлегматора y'.
1
Виконуючи таку побудову для різних значень х, розраховують для цих значень, після чого y' x
графічно визначають інтеграл в правій частині рівняння (19.6)
Перегонка в струмені водяної пари
Перегонку в струмені водяної пари застосовують з метою вилучення компонентів із сумішей, компоненти яких мають дуже малу летючість . В цих процесах компонент, який відганяється, одержують, зазвичай, у вигляді суміші з водою при температурі кипіння, в умовах атмосферного тиску, меншій ніж температура кипіння води.
Водяна
1
пара
2 |
3
До збірників
Рис. 19.14. Перегонка з водяною парою
1 – куб, 2 – конденсатор, 3 – сепаратор.
Схема процесу наведена на (рис. 19.14) Вихідну суміш завантажують в куб 1, де підігрівають до температури перегонки. Потім через суміш пропускають водяну пару, яка взаємодіє з компонентами.
Врезультаті цієї взаємодії утворюється парова суміш, яка надходить до конденсатора 2 і потім до сепаратора 3.
Вцьому апараті нерозчинні одна в одній рідини розшаровуються і стікають у відповідні збірники, не вказані на схемі.
Співвідношення між кількістю введеної водяної пари і відповідного компоненту можливо виразити наступним чином.
Згідно закону Дальтона
Yê PPê ; YB PPB ,
де Рк і РВ – тиск пари відігнаного компоненту і води;
Yк, YB – мольна концентрація компонента і водяної пари.
На підставі викладеного одержимо:

Yê |
|
Pê |
àáî |
Gê |
|
Pê M ê |
(19.7) |
|
|
|
|
||||
YB |
PB |
GB |
|
PBM B |
|
||
де Gк – маса відігнаного компоненту;
Мк, МВ – молекулярні маси компоненту і води; GВ – маса водяної пари.
Якщо тепер прийняти, що парціальний тиск водяної пари
РВ=Р – Рк,
де Р –загальний тиск ;– ступінь насичення.
то з рівняння (19.7) випливає:
GB Gê (P Pê )M BPê M ê
Молекулярна перегонка
Молекулярну перегонку застосовують в техніці для розділення компонентів, які киплять при високих температурах і не мають необхідної термічної стійкості.
Цей процес проводять під глибоким вакуумом з тиском 103-102 Па.
При такому вакуумі молекули легко долають сили внутрішнього притягування, а довжина вільного пробігу різко зростає.
Якщо відстань між поверхнями випаровування і конденсації менше довжини вільного пробігу молекул, то молекули леткого компоненту, які відриваються від поверхні випарювання, безпосередньо попадають на поверхню конденсації і вловлюються нею.
Відстань між поверхнями випаровування і конденсації становить 20÷30 мм, а різниця температур між ними на рівні 100°С.
На (рис. 19.15) наведена схема найпростішого апарата для молекулярної перегонки. Циліндр 1 має всередині спіраль для електронагріву і є випарником. Циліндр 2 має рубашку 3, по якій рухається охолоджуючий агент, і є конденсатором. Вихідна суміш вводиться через патрубок до воронки 4 і стікає плівкою по зовнішній поверхні випарника. Залишок і дистилят, які збираються на внутрішній поверхні конденсатора, відводяться через патрубок в нижній частині апарата. В кільцевому просторі між випарником і конденсатором підтримується необхідний вакуум за допомогою насосу глибокого вакууму, приєднаного до верхнього патрубку.
До вакуумнасосу
|
|
|
|
а |
|
|
|
|
н |
|
|
ід |
|
|
|
х |
|
іш |
|
В |
и |
|
|
|
|
|
м |
||
|
|
у |
|
|
|
с |
|
|
|
|
4 |
|
|
|
|
|
3 |
|
|
2 |
|
|
агент |
|
1 |
|
|
|
Охолоджуючий |
|
|
|
|
т |
|
|
|
я |
|
|
|
л |
|
|
|
|
ти |
|
|
Д |
и |
с |
|
|
|
|
|
|
|
Залишок
Рис. 19.15 Схема апарату для молекулярної перегонки
Ректифікація
Фізична модель ректифікації
Ректифікація – процес розділення однорідної суміші рідин на складові шляхом протитечійного двостороннього тепломасообміну між нерівноважними потоками парової і рідкої суміші.
Схема протитечійної взаємодії потоків пари та рідини на тарілках ректифікаційної колони показана на (рис. 19.16а).
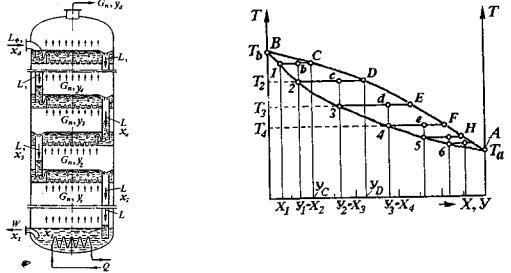
Якщо в кубову частину колони підвести тепло в кількості Q, то рідина з концентрацією Х1 закипить і виділить парову фазу в кількості Gп складу Y1, збагачену НКК. Парова суміш надходить на контактний пристрій – тарілку і барботує через шар рідини, що перебуває на тарілці. У процесі взаємодії пари з рідиною відбувається часткова або повна конденсація пари, при цьому конденсація НКК у рідині підвищується до величини Х2 (при повній конденсації пари). Одночасно при конденсації пари виділяється теплота конденсації, під дією якої рідина на тарілці закипає й виділяє нову парову фазу, збагачену НКК, при цьому рідина збіднюється НКК і одночасно збагачується ВКК та по переливному пристрою перетікає на нижню тарілку. Потік пари з концентрацією Y2 надходить на розміщену вище тарілку, і процеси конденсації пари – кипіння рідини повторюються.
Після багаторазового повторення процесу по висоті колони з верхньої тарілки виводиться пара з концентрацією НКК, що дорівнює Yд. Пара надходить у холодильник-конденсатор, де конденсується, утворюючи дистилят. Одночасно з нижньої частини колони відводиться кубовий залишок Gw, що представляє собою практично чистий ВКК.
Таким чином, контактні пристрої – тарілки ректифікаційної колони можна розглядати як свого роду тепломасообмінні елементи конденсаторів-випарників, у яких одночасно протікають теплообмінні процеси (конденсації парової фази та випаровування рідини), і відбуваються масообмінні процеси між взаємодіючими паровою і рідкою фазами.
На (рис. 19.16б) показаний хід процесів фазового переходу (випаровування і конденсації) на тарілках ректифікаційної колони в координатах діаграми температура-концентрація (t-X-Y) за певного тиску.
Нижня крива Тb-1-2-3-4-5-6-Та, (рис 19.16 б), відображає зміну температур кипіння бінарного розчину на тарілках залежно від концентрації розчину.
а |
б |
Рис. 19.16. Ректифікація бінарної суміші
асхема процесів конденсації-випарювання на тарілках ректифікаційної колони
бхід процесів на тарілках у діаграмі t – X,Y.
Потоки: L – рідка фаза; Gп – парова фаза; W –кубовий залишок; Q – теплоносій.
Верхня крива BCDEFA відображає температури конденсації та концентрацію компонентів у паровій фазі, що має рівноважний склад з киплячою рідиною. Горизонтальні лінії – ізотерми між кривими відображають процеси фазового переходу, що протікають на тарілках залежно від температури й концентрації речовин у фазах.
Розглянемо роботу однієї з тарілок ректифікаційної колони (наприклад, другої тарілки знизу). На цю тарілку знизу надходить парова фаза складу y1 з температурою Т2 (т.2 рис. 19.16б). При контакті пари з рідиною на тарілці відбувається її часткова (процес 2 - с) або повна (процес 2 - D) конденсація, при цьому залежно від степеня конденсації пари на тарілці утворюється конденсат складу x3 = y2 (при частковій конденсації) або yD (при повній конденсації пари). Процес конденсації супроводжується виділенням тепла, тому рідина нагрівається та починається процес її випаровування. Відповідно до інтенсивності процесів тепломасообміну на тарілці змінюється (звичайно знижується знизу вверх) температура кипіння рідини. На реальній тарілці положення точки с визначає співвідношення між робочими концентраціями речовини у фазах,при цьому за правилом
