
konspect_lectsiy-ln_lm
.pdf
Вплив температури вихідної суміші
У випадку, коли вихідна суміш не нагріта до температури кипіння, то на тарілці живлення збільшується кількість сконденсованої пари, необхідне для нагрівання суміші до температури кипіння. Концентрація НКК на тарілці внаслідок цього збільшується. Це доцільно враховувати при побудові робочої лінії для нижньої частини колони.
Типові конструкції ректифікаційних апаратів
Ректифікаційні апарати поділяються на 4 групи:
1)апарати тарілчастого типу;
2)насадкові колони;
3)плівкові колони;
4)роторні плівкові апарати;
Розрахунок ректифікаційних колон
Розрахунок числа тарілок ректифікаційних колон
Алгоритм розрахунку ректифікаційних колон аналогічний алгоритму розрахунку масообмінних апаратів, який розглядався раніше.
Основним завданням розрахунку є визначення діаметра та висоти колони. Розрахунок висоти пов'язаний з визначенням числа дійсних тарілок. В реальній колоні не досягається рівновага між фазами і для переходу до дійсного числа тарілок необхідно вводити поправочний коефіцієнт.
Існують три методи визначення величини цих поправочних коефіцієнтів: а) визначення загального ККД тарілок в колоні; б) визначення локальних ККД (метод Мерфі);
в) визначення коефіцієнтів через коефіцієнти масо передачі.
а) загальний ККД тарілок це відношення числа теоретичних до числа дійсних тарілок:
Nò .
Nä
де η – залежить від властивостей суміші, умов проведення процесу та конструкції колони.
Значення ККД змінюються в широких межах від η = 0,2÷0,9 в спиртовій промисловості до η = 0,5÷0,7 в нафтохімічній.
Ефективність тарілок в колоні можливо розраховувати за емпіричними залежностями:
0,49( |
p |
') 0,245 , |
(19.16) |
|||||
|
|
|
|
|
|
|
|
|
де μр – в’язкість рідини в мПа∙с; |
|
|
|
|
|
|
|
|
α’ – відносна леткість компонентів: |
|
|
|
|
|
|
|
|
|
' |
PÍ .Ê . |
|
|
|
|
||
|
PÂ.Ê . |
|
|
|
|
|||
|
|
|
|
|
|
|||
б) Розрахунок за методом Мерфі. |
|
|
|
|
|
|
|
|
Цей метод ґрунтується на визначенні ККД Мерфі ηМ, який виражається через середні |
||||||||
концентрації компонентів на тарілці. |
|
|
|
|
|
|
|
|
ККД за Мерфі знаходиться за виразом: |
|
|
|
|
|
|
|
|
|
yn yn 1 |
ac |
|
|||||
Ì |
|
|
|
|
|
|
||
y p y |
n 1 |
|
ab , |
|
||||
|
n |
|
|
|
|
|
|
|
де ynp – рівноважна концентрація НКК в парі.
Теоретична тарілка відповідає трикутнику Aab. Дійсний процес закінчується не на лінії рівноваги (точка b), а точці яка не доходить до кривої рівноваги – точка с. Дійсна тарілка – трикутник acd. Число дійсних тарілок можна знайти графічно визначивши положення точки с через ККД за Мерфі.
ac ab· Ì
де ηМ – залежить від локального ККД тарілки:
ηл – визначається екпериментально, що пов’язано із значними труднощами.
Найбільш зручним є метод запропонований А.Г. Кататкіним та А.Н.Плановським, який ґрунтується на визначенні числа дійсних тарілок через коефіцієнти масопередачі.

Цей метод розглядався раніше і зводиться до побудови кінетичної кривої, яка визначає закінчення реального процесу масопередачі. Розглянемо схему тарілки.
Р
озгл
яне
мо
про
цес
на n-
ній
тарі лці,
у
якій
поч
атк
ова а б кон
цен
тра ція yп = yn+1 і кінцева yк = yn. При барботуванні пари, рівновага не досягається і ур > yк. Концентрація пари змінюється від yп = yn+1 до yк = yn. Це відповідає це відповідає відрізку ac. Початкова рушійна сила процесу yп - ур, тобто yn+1 - ур або відрізку – ab. Кінцева рушійна сила yк - ур або відрізок bc, (рис.
19.33)
Рис. 19.33. – До визначення числа дійсних тарілок за кінетичними кривими
Середня рушійна сила на n-тій тарілці:
|
|
y y |
( y p y |
n 1 |
) ( y p |
y ) |
|
||||
y |
|
б |
|
м |
n |
|
n |
n |
|
||
|
|
|
|
|
|
|
|||||
сер |
|
ln |
yб |
ln |
|
y p y |
1 |
|
|
||
|
|
yм |
|
y p y |
|
|
|||||
|
|
|
|
|
|
|
n n |
|
|
||
|
|
|
|
|
|
|
|
n |
n |
|
|
yn yn 1 |
. |
|
|||
|
(19.17) |
||||
|
p |
yn 1 |
|
|
|
ln |
yn |
|
|
|
|
y p y |
|
||||
|
|
||||
|
n |
n |
|
||
Виконавши перетворення рівняння (19.17) одержимо вираз для числа одиниць переносу для n- ої тарілки:
|
|
|
|
y |
n |
y |
n 1 |
ln |
|
y p y |
n 1 |
|
|||||||||||
m |
|
|
|
|
|
|
|
|
n |
|
, |
||||||||||||
y m |
|
|
y |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
сер |
|
|
|
|
|
|
y p y |
n |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|||
звідки: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
y |
|
y p |
y |
n 1 |
|
|
|
ab |
|
|
|
|
|||||||
|
|
e |
|
|
|
n |
|
|
|
|
|
|
. |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
y p y |
n |
|
|
|
bc |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|||
Положення т. с знаходиться як

ab bc. emy
Ступінь acd відповідає реальній тарілці. Для розрахунку числа тарілок знаходимо число одиниць переносу з виразу:
my m ky f , G
де G – кількість пари, що піднімається в колоні в молекулярних частинках.
G Wпар F c,
с – коефіцієнт перерахунку в колоні.
При розрахунках можливо прийняти f/F ≈ 0,8, де f – робоча поверхня тарілки, F – поверхня контакту фаз.
Коефіцієнт масопередачі ky визначається через коефіцієнти масовіддачі βy і βх із критеріальних залежностей.
1 |
|
1 |
|
m |
|
y |
x |
||
k y |
|
|||
де m – тангенс кута нахилу кривої рівноваги.
Загальна висота колони:
H Nä h,
де h – відстань між тарілками.
Зазвичай в колонах при D = 1,5÷2,0м h ≥ 450 мм, при D <2,0м h ≥ 600 мм. Діаметр колони вибирається в залежності від швидкості парової фази.
Після розрахунку розмірів колони розраховують основні розміри тарілок, гідравлічний опір, переливні та дренажні пристрої та інше. орієнтовно визначається винос рідини з тарілки на тарілку е:
eäî ï 0, 2...0,32êã/êã.
Розрахунок насадкових колон
Особливості розрахунку насадкових колон були наведені в главі 17 розділ 17.22.
Тепловий баланс ректифікаційної колони
Тепловий баланс ректифікаційної колони безперервної дії має вигляд:
Qкип QF QФ QG QW Qвт , |
(19.18) |
де Qкип – прихід теплоти з теплоносієм у кип’ятильнику; QF – надходження теплоти з вихідною сумішшю; QФ – прихід теплоти з флегмою; QG – витрати теплоти з парою, що виходить з колони; QW – витрати теплоти з кубовим залишком; Qвт – втрати теплоти в навколишнє середовище.
Зважаючи на те, що GF GD GW , G GD R 1 i GÔ RGD , маємо:
Qêèï GD GW HF GDRHÔ GD R 1 HG GW HW Qâò ,
де HF, HФ, HG і HW – ентальпії відповідних потоків.
Враховуючи, що різниця ентальпій HG –HФ=rФ, де rФ – питома теплота пароутворення флегми, остаточно отримуємо:
Qкип GD RrФ GD HG HF GW HW HF Qвт . |
(19.19) |
Якщо HÔ HF , то рівняння (19.19) спрощується:
Qкип GD R 1 rФ GW HW HF Qвт .
звідки видно, що витрати теплоти на ректифікацію суттєво залежать від флегмового числа R.
Екстрактивна та азеотропна ректифікація
Коли коефіцієнт відносної леткості PA  PB компонентів А і В суміші незначний,
PB компонентів А і В суміші незначний,
крім ректифікації під вакуумом, можна застосовувати методи, які ґрунтуються на введенні в
розділювану суміш додаткового (розділювального) компонента. У цьому додатковому
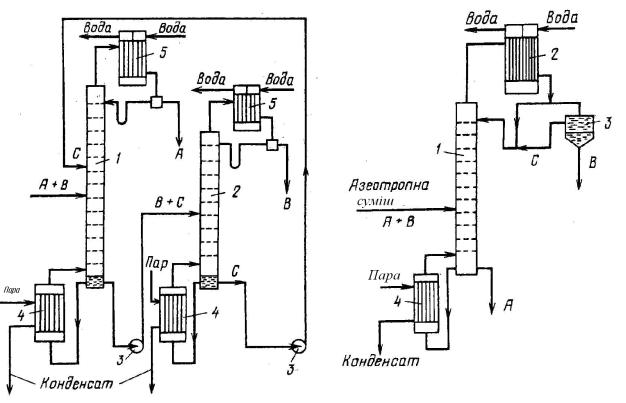
компоненті, який є висококиплячим відносно одного з компонентів суміші, останній легко розчиняється, а другий компонент вихідної суміші є нерозчинним або практично нерозчинним. Наявність третього (додаткового, або екстрагувального) компонента збільшує відносну леткість компонента вихідної суміші, нерозчинного в утворюваній трикомпонентній суміші.
Підвищення полегшує розділення вихідних компонентів, але передбачає наступне розділення суміші НКК вихідної суміші – екстрагувальний компонент, яка видаляється з кубовим залишком. Цей метод розділення називається екстрактивною ректифікацією (рис.
19.35).
Азеотропна ректифікація ґрунтується на наявності в колоні розділювального компонента, який найчастіше відбирають з колони у вигляді дистиляту (рис.19.35).
Вихідна азеотропна суміш А+В, яка надходить на живильну тарілку колони, контактує з додатковим компонентом С, у результаті чого утворюється нова азеотропна суміш практично взаємно нерозчинних рідин В+С, пара якої після конденсації розділяється у відстійнику на компоненти В і С. Кубовий залишок при цьому являє собою практично чистий компонент А.
Якщо як розділювальний компонент використовують розчинні тверді речовини, то такий процес називають сольовою ректифікацією.
Рис.19.34. Схема установки для екстрактивної |
Рис.19.35. Схема установки для азеотропної |
ректифікації бінарної суміші : |
ректифікації : |
1 – колона для екстрактивної ректифікації; 2 – колона |
1 – колона; 2 – конденсатор; 3 – відстійник; |
для розділення продукту В та екстрагенту С, 3 – |
4 – кип’ятильник |
насоси, 4 – кип’ятильники, 5 – конденсатори. |
|
Низькотемпературна ректифікація
Низькотемпературна ректифікація застосовується для розділення скраплених газів. Наприклад для розділення скрапленого повітря на азот і кисень. Серед багатьох серед багатьох існуючих методів, розглянемо схему подвійної ректифікації.
Повітря, яке підлягає розділенню, після стиснення до 9÷10 МПа і охолодження, проходить

по змійовиковому теплообміннику і конденсується. Теплота конденсації відводиться в кубі нижньої частини колони. потім повітря дроселюється через вентиль 2 до 0,6 МПа – тиск в нижній частині колони і надходить на тарілку живлення нижньої колони. В кубі 1 збирається рідина збагачена киснем. Пари азоту на НКК збираються у верхній частині 3 – в дефлегматорі, який одночасно є кубом верхньої частини колони. Пара азоту конденсується в трубках , а теплота конденсації відводиться рідиною, що кипить між трубами. Азотна флегма з концентрацією N2 = 95% надходить на верхню тарілку. Частина флегми збирається в карманах 4, звідки відводиться, та через вентиль 5 подається на зрошення верхньої колони. Верхня колона живиться сумішшю, яка виходить з куба нижньої колони.
Ця рідина подається в колону через вентиль 6 на ректифікацію. У верхній колоні надлишковий тиск становить 0,13 МПа. В результаті ректифікації в кубі верхньої колони збирається рідкий кисень О2 = 99,3%, з верхньої відводиться азот N2 = 99%.
Різниця тисків в обох частинах колони призводить до того, що температура кипіння азоту в нижній частині при Р = 0,6 МПа становить 98 К. Температура кипіння О2 в верхній частині при Р = 0,15 МПа становить 93 К.
Різниця температур киплячого і конденсованого азоту складає 5 К. Цього достатньо для роботи конденсатора. Вилучення аргону та інших газів, які накопичуються в кисні, здійснюється за рахунок додаткової ступінчатої колони.
Заходи заощадження енергії ректифікаційних установок
1. Забезпечення мінімальних витрат теплоти в навколишнє середовище шляхом ретельної теплової ізоляції.
2. Витрати граючої пари та охолоджуючої води збільшуються при збільшенні коефіцієнту надлишку флегми α і досягають найменших значень при мінімальному флегмовому числі, тобто при α = 1. Внаслідок зменшення числа тарілок, вартість колони із збільшенням α або R = αRmin зменшується до деякого значення, а потім збільшується через випереджаюче збільшення діаметра колони, а також робочих надходжень дистиляційного куба колони і конденсатора.
Оптимальним в економічному відношенні флегмове число Rопт відповідає мінімальним сумарним витратам.
3. Значна економія гріючої пари та охолоджуючої води може бути досягнута внаслідок використання теплоти пари, що виходить з колони, дистилятора, кубового залишку та конденсатора гріючої пари для підігріву вихідних сумішей та інших потреб.
|
4. При ректифікації гомоазеотропних сумішей в двох колонах |
|
|
при двох різних тисках, пара з колони з більшим тиском може бути |
|
Рис. 19.36. Схема колони |
використана для обігріву колони за нижчим тиском. При цьому |
|
відпадає необхідність встановлення конденсатора першого ступеня. |
||
двухкратної ректифікації |
||
5. Велика економія теплоти може бути досягнута шляхом |
||
|
||
застосування принципу теплового насоса, (рис. 19.37) . |
||

Рис. 19.37. – Схема ректифікаційної колони з тепловим насосом
1 – ректифікаційна колона, 2 – компресор, 3 – лінія подачі флегми, 4 – лінія відбору дистиляту, 5 – подача вихідної суміші, вивід кубового залишку
Відповідно до запропонованої схеми, пара що відводиться з колони стискається в компресорі до тиску, що відповідає температурі граючої пари конденсації в кубі дистиляційної колони. При цьому не потрібно встановлювати конденсатор-дефлегматор. Це зумовлює зменшення витрати граючої пари та охолоджуючої води.
Наведена схема вигідна тоді, коли вартість енергії, яка споживається компресором, менша витрат на оплату граючої пари та охолоджуючої води. Економічність установки підвищується по мірі зменшення різниці температур кипіння компонентів вихідної суміші, що надходить на ректифікацію.
6. У випадку, коли кубовим залишком при ректифікації залишається вода, доцільно обігрівати колону гострою парою. Окрім здешевлення ректифікаційної колони, в даному випадку може бути значна економія теплоти шляхом використання принципу теплового насоса за допомогою параструменевого інжектора.
Схема установки наведена на (рис. 19.38).
Рис. 19.38. – Схема ректифікаційної установки з інжектором
1 – ректифікаційна колона, 2 – ємність, 3 – інжектор, 4 – інжекційна пара, 5 – потік кубового залишку, 6 – суміш стиснених парів
В цій установці кубовий залишок переходить із куба в ємність 2, в якій відбувається розширення завдяки приєднаного парового простору до всмоктувального штуцеру параструменевого інжектора 3. З інжектора суміш інжекційної пари подається під нижню тарілку вичерпної частини колони. Випарена та охолоджена частина кубового залишку відводиться із системи. Величина економії енергії залежить від різниці тисків в кубі колони і в ємності 2 та коефіцієнта інжекції.
Запитання для самоконтролю
1.В чому полягає фізична сутність дистиляції?
2.В чому полягає фізична сутність ректифікації?
3.У яких випадках доцільно застосовувати дистиляцію та ректифікацію?

4.Поясність фізичну сутність першого закону Коновалова і першого закону Вревського.
5.Поясність сутність дистиляції на фазових діаграмах бінарних суміших.
6.Реальні суміші. Поясніть сутність других законів Коновалова та Вревського.
7.Поясніть сутність основних видів перегонки: фракційної, з водяною парою та молекулярної.
8.Поясніть фізичну сутність процесу ректифікації.
9.Що означає флегмове число і як воно впливає на положення робочої лінії?
10.Як визначається мінімальне флегмове число?
11.Чим відрізняються схеми періодичної і безперервної ректифікації?
12.В чому полягає екстрактивна і азеотропна ректифікації?
13.Наведіть приклад низькотемпературної ректифікації для одержання кисню та азоту з повітря.
14.Наведіть способи інтенсифікації процесів ректифікації.
Тема 2.4 Масообмін при екстракції
Рідинна екстракція (від лат. extraho – витягаю, вилучаю) – це процес переходу однієї чи кількох розчинених речовин з однієї рідкої фази в іншу, таку, яка практично не розчиняється або обмежено розчиняється в першій фазі, але легко розчиняє зазначені речовини. Процес відбувається при безпосередньому контакті двох рідких фаз, одну з яких, щоб збільшити контакт фаз, а отже і інтенсифікувати масообмін, диспергують у іншій.
Рідинну екстракцію широко застосовують у хімічній, нафтохімічній, фармацевтичній та інших галузях промисловості, щоб видобути цінні або шкідливі речовини, одержати концентровані розчини цих речовин, а також очистити промислові й побутові стічні води. Разом з дистиляцією вона є одним з основних методів розділення однорідних рідких сумішей. Оскільки при екстракції немає потреби випаровувати всю суміш, то рідинна екстракція є набагато доцільнішим процесом порівняно з дистиляцією, особливо при малих концентраціях розподілюваної речовини. Крім того, екстракцію застосовують і разом з ректифікацією, яку використовують для регенерації екстрагувальної рідини (екстрагенту). При цьому густини екстрагенту й розділюваної рідини мають бути різними для їх подальшого розділення відстоюванням*. Зазвичай рідинній екстракції піддають органічні речовини, при цьому витрати енергії досить малі; екстракція же неорганічних сполук можлива тільки внаслідок хімічної взаємодії компонентів, що потребує значних витрат енергії.
Розчин здобутих речовин в екстрагенті називають екстрактом, а розчин, з якого вилучено екстраговані компоненти, – рафінатом.
На рис. 20.1 наведено основні схеми проведення екстракційних процесів. За схемою без регенерації екстрагенту (рис. 20.1,а) вихідну суміш Фх, яка складається з розчинника L і розподілюваної речовини М, та екстрагент G подають в екстракційний апарат – екстрактор, у якому речовина М переходить з вихідної суміші Фх в екстракт Фy, який складається з екстрагенту G і вилученої з фази Фх речовини М. У результаті процесу в екстракторі утворюється й рафінат, який являє собою розчинник вихідної суміші L. Зрозуміло, що наведений опис процесу умовний, оскільки загалом екстракт і рафінат є зазвичай трикомпонентними системами, які складаються з розчинника L, екстрагенту G і розподілюваної речовини М.
Схему з регенерацією екстрагенту застосовують значно частіше (рис. 20.1,б). Згідно з цією схемою з екстракту й рафінату регенерують екстрагент, який після очищення знову надходить на екстракцію.
Іноді в процесах екстракції органічних речовин після екстракції відбувається протилежний процес, який називають реекстракцією (рис. 20.1,в). При цьому органічний екстракт обробляють розчинами реактивів (реекстрагентом G1), які забезпечують досить
* Як екстрагенти часто використовують воду, етанол, бензин, бензол, чотирихлористий вуглець, ацетон, розчини кислот, лугів і солей.

повний перехід розподілюваної речовини М у водний розчин або осад і його концентрування. Одержаний при цьому продукт, який містить розподілювану речовину,
називають реекстрактом.
Як бачимо, процес екстракції завжди пов’язаний з додаванням до вихідної суміші екстрагенту, що забруднює продукти розділення, й, отже, потребує наступного очищення. Цей недолік екстракційних процесів суттєво обмежує сферу їх застосування.
|
|
Фх(L+M) |
|
|
|
|
L |
|
|
||
|
Екстракція |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
|
|
Фy(G+M) |
|
|
||
|
а |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
Екстракція |
||||
|
|
|
|
|
|
|
|
|
|||
Фх(L+M) |
|
|
|
L+G |
|
|
екстрагенту |
|
|
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Екстракція |
|
|
|
|
Регенерація |
||||
|
|
|
|
|
|
|
|
||||
G |
|
|
|
G+M |
|
|
екстрагенту |
|
|
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Очищення |
|
|
||
|
|
|
|
|
G |
|
екстракту від |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
домішок, що |
|
|
||
|
|
|
|
|
|
|
Домішки |
||||
|
|
|
|
б |
|
|
|
|
|
|
|
Фх(L+M) |
|
|
G+M |
|
|
|
|
Фy(G+M) |
|||
|
|
|
|
|
|
|
|
|
|||
|
|
Екстракція |
|
|
|
Екстракція |
|
|
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Очищення |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
G |
|
екстракту від |
|
|
|
||
|
|
|
|
|
домішок, що |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Домішки |
|
|
||
в
Рис. 20.1. Схема проведення процесів рідинної екстракції: а – без регенерації екстрагенту; б – з регенерацією екстрагенту; в – з поєднанням екстракції та реекстракції
Рівновага в системах рідина – рідина
Під час проведення рідинної екстракції температура зазвичай не змінюється, а тиск у системі рідина – рідина на процес майже не впливає, тому згідно з правилом фаз (С=К–Ф+N) для екстракції величина N дорівнює нулю. Тоді для трикомпонентної системи рідина –

розподілювана речовина – рідина С=К–Ф+N =3–2+0=1 і концентрацію однієї з фаз системи можна змінювати, не порушуючи рівноваги. При цьому певній концентрації х розподілюваної речовини в одній фазі у стані рівноваги відповідає певна концентрація у* цієї речовини у другій фазі: у*= f(x). Цей зв’язок підлягає так званому закону розподілу: відношення рівноважних концентрацій розподілюваної між двома рідкими фазами речовини при постійній температурі є величиною сталою:
m* y* x або |
y* m*x , |
(20.1) |
де у* і х – рівноважні концентрації розподілюваної речовини в екстракті й рафінаті відповідно; m* – коефіцієнт розподілу.
Отже, в координатах у–х при постійних температурі й тиску лінія рівноваги є прямою, що виходить з початку координат. Слід зауважити, що значення m* є сталим тільки для практично взаємно нерозчинних рідких фаз і завичай це значення залежить від концентрації розподілюваної речовини навіть при постійній температурі.
Лінії рівноваги на діаграмі у–х при постійній температурі називають ізотермами екстракції. Якщо відомо ізотерми для різних температур, то стає можливим вибір оптимальної температури екстракції (рис. 20.2).
У силу того, що найчастіше фази під час рідинної екстракції частково розчинні одна в одній, екстракт крім розподілюваної речовини містить ще деяку кількість розчинника вихідної суміші, а рафінат, крім зазначеного розчинника й деякої кількості розподілюваної речовини, – певну кількість екстрагенту. Обидві фази складаються з трьох компонентів. При цьому склад цих фаз зручно подавати на трикутній діаграмі (рис. 20.3).
y
1 2
0 |
x |
|
Рис. 20.2. Типові ізотерми екстракції
неелектролітів (1) та електролітів
M
1 0
xG
Фх(L+M)
Фy(G+M)
xM
xG
N
xM
0 |
|
|
1 |
|
L 1 |
|
|
G |
|
xL |
L+G |
xL 0 |
||
|
Рис. 20.3. Трикутна діаграма
Вершини G, L і M позначають чисті компоненти (екстрагент, розчинник вихідної суміші й розподілювана речовина відповідно). Сторони LM, MG i GL відповідають складу двокомпонентних розчинів, а точки всередині трикутника – складу трикомпонентних розчинів, причому концентрації компонентів визначають довжиною відрізків, проведених паралельно кожній із сторін трикутника до перетину з іншими сторонами (наприклад, точка N характеризує суміш, яка містить 20 % (молярних або масових) компонента L, 50 % компонента G і 30 % компонента М).

M M
N |
|
|
|
E |
|
|
R |
N |
|
|
|
|
|
|
P |
|
|
|
|
L |
G |
L |
|
G |
а |
|
|
|
б |
Рис. 20.4. Процеси розведення (а) і змішування (б) на трикутній діаграмі
Процес розведення розчину складу N, наприклад екстрагентом G, характеризує лінія NG (оскільки співвідношення кількостей компонентів М і L у цьому разі буде залишатися постійним) (рис. 20.4,а). Видобування же розподілюваної речовини М з розчину складу N характеризує лінія NР, що проходить через вершину трикутника М.
При змішуванні двох трикомпонентних розчинів складів R і Е (рис. 20.4,б) утворюється потрійна суміш, склад якої характеризує точка N, яка належить відрізку RЕ. При цьому положення точки N визначають за правилом важеля:
GR EN ,
GE RN
де GR i GE – кількості розчинів складів R і Е відповідно.
І навпаки, якщо суміш N будь-яким чином розділити на дві фази R і Е (наприклад розшаровуванням), то точки R, N і Е, які відповідають складам цих сумішей, мають лежати на одній прямій RNЕ. Якщо відомо кількість суміші GN , її склад і склади фаз після їх розшарування (відстоювання), то кількості цих фаз визначають за виразами:
GR |
|
EN |
|
EN |
; |
GE |
|
RN |
|
RN |
. |
|
RN EN |
|
|
RN EN |
|
||||||
G |
|
|
RE |
|
G |
|
|
RE |
|||
N |
|
|
|
|
|
N |
|
|
|
|
|
Розраховуючи рідинну екстракцію, як і будь-який масообмінний процес, необхідно знати рівноважні концентрації, які для трикомпонентних систем рідина–рідина можна подати на трикутній діаграмі.
Нехай компоненти L i M, M i G необмежено взаємно розчинні, а компоненти L і G – обмежено взаємно розчинні (тобто за наявності в системі певних кількостей компонентів L і G може утворюватися двофазна рідка система).
Якщо до розчинів компонентів L і G, склад яких на рис. 20.5 зображено точками R і Е, додати компонент М, то склад трикомпонентних розчинів, які розшаровуються, будуть відповідати точкам R1 і Е1. Хорда, яка з’єднує точки R1 і Е1, відповідає розчинам, які знаходяться в рівновазі один з одним. При подальшому додаванні компонента М одержують розчини, які розшаровуються й характеризуються точками R2 і Е2 і т.д. Поступово ці точки зближуються, оскільки додавання компонента М до системи поліпшує взаємну розчинність компонентів L і G. Нарешті, при певній концентрації компонента М взаємна розчинність компонентів L і G зростає настільки, що утворюється однофазний розчин, який характеризується критичною точкою К. З’єднуючи точки Ri , K i Ei , одержують рівноважну, або біноїдальну, криву, вище якої система однофазна, і тому область над кривою рівноваги для екстракції не використовують.
Хорди RЕ, RіЕі на кривій рівноваги називають конодами, які найчастіше не паралельні одна одній, тому що компонент М нерівномірно розподілений між компонентами L і G. Будь-яка точка N всередині області, обмеженої кривою рівноваги, відповідає двофазній системі, склад якої R2 і Е2 виражається кінцями хорди, що проходить через точку N.
Для того, щоб знайти положення будь-якої хорди, а також критичної точки К, використовують
