
- •Лабораторная работа №1
- •Определение свободной и общей щелочности
- •Контрольные вопросы и задачи
- •Лабораторная работа №2 Определение растворенного кислорода
- •Количественное определение хлоридов
- •1. Определение примерного содержания ионов сг в исследуемой пробе воды.
- •Лабораторная работа №6 Жесткость воды.
- •Определение общей и временной жесткости воды комплексонометрическим методом.
- •Лабораторная работа №7 определение содержания железа в воде
- •Количественное определение железа с роданидом Ход работы:
- •1. Построение калибровочного графика
- •2. Анализ исследуемой воды и контрольного раствора Ход работы:
- •Ход работы:
- •4. Обработка результатов
- •Количественное определение железа сульфосалициловым методом
- •Ход работы:
- •Ход работы:
- •Контрольные вопросы
- •Лабораторная работа №8 Колориметрическое определение меди в воде.
- •Ход работы:
- •1. Построение калибровочного графика
- •2. Анализ исследуемой воды и контрольного раствора Ход работы:
- •3. Обработка результатов
- •Плотность растворов некоторых веществ при 200с, г/мл
4. Обработка результатов
4.1. Концентрацию железа (Х) в мг/л вычисляют по формуле:
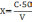 ,
,
где С – концентрация железа, найденная по калибровочному графику, мг/л;
V – объем пробы, взятый для анализа, мл.
4.2. Концентрацию Fe2+ найти по разнице между общей концентрацией Fe2+и Fe3+ и концентрацией Fe3+.
Количественное определение железа сульфосалициловым методом
Этот метод основан на образовании окрашенных комплексов железа с сульфосалициловой кислотой или сульфосалициловокислым натрием. В слабокислой среде (pH>4) сульфосалициловая кислота взаимодействует только с ионами Fe3+, образуя комплекс красного цвета, устойчивый при рН=4 – 8. В щелочной среде (рН=8 – 11,5) сульфосалициловая кислота реагирует с ионами Fe2+ и Fe3+, образуя комплекс желтого цвета. Содержание Fe2+ находят по разности общего содержания железа и Fe3+.
Растворы комплексов железа с сульфосалициловой кислотой, как и с роданидом, подчиняются закону Бера: поглощение потока излучения прямо пропорционально концентрации поглощенного вещества, через которое проходит данный поток излучения. Этот закон выражает зависимость коэффициента поглощения (К) от молярной концентрации поглощающего вещества (С, моль/л): К=Е∙С, где Е – молярный коэффициент поглощения не зависящий от концентрации.
Объединенный закон Бугера – Ламберта – Бера выражается уравнением : It=Io ∙ 10-ECℓ или в логарифмической форме: lg(Io/It)= ECℓ , где Io – интенсивность падающего потока излучения; It – интенсивность потока, прошедшего через раствор; ℓ – толщина поглощающего слоя, см.
Величину lg(Io/It) т.е. логарифм величины обратной пропусканию, называют оптической плотностью поглощающего вещества (А).
A = lg ( I0 / It ) =ECℓ
Оптическая плотность является основной величиной, характеризующей поглощение раствора вещества с определенной концентрацией при определенной длине волны ( λ ) и толщине поглощающего слоя ( ℓ ). В этой величине дается градуировка шкалы фотометрических приборов и, следовательно, она может быть определена экспериментально.
1. Анализ исследуемой воды и контрольного раствора на содержание Fe3+
Ход работы:
Взять три мерные колбы на 50 мл. В одну отмерить пипеткой 25 мл. исследуемой воды, в другую 25 мл стандартного раствора, с концентрацией Fe3+ , равной 1мг/л.
В каждую колбу прибавить по 5 мл 1н HCl и по 15 мл сульфосалициловой кислоты. Довести объем раствора в мерных колбах с дистиллированной водой до 50 мл.
Через 5 мин измерить оптическую плотность каждого раствора на ФЭКе при λ = 490-500 нм в кюветах с толщиной оптического слоя 2,3 или 5 см по отношению к дистиллированной воде. Измерение оптической плотности ( A ) проводить три раза. Для расчета использовать средний результат от трех измерений. Данные эксперимента занести в таблицу 3.
Расчет. Вычислить концентрацию иона Fe3+ в исследуемой воде и контрольном растворе, применить аналитический метод – метод сравнения:
Acm. /A =Ccm. (Fe3+)/C (Fe3+) ,
C
(Fe3+)
=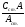
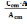
где Acm – оптическая плотность стандартного раствора;
A – оптическая плотность исследуемого или контрольного раствора;
Ccm(Fe3+) – концентрация стандартного раствора, мг/л;
C(Fe3+) – концентрация исследуемого или контрольного раствора мг/л.
2. Анализ исследуемой воды и контрольного раствора на общее содержание железа (Fe2+ и Fe3+)
