
- •Лабораторная работа №1
- •Определение свободной и общей щелочности
- •Контрольные вопросы и задачи
- •Лабораторная работа №2 Определение растворенного кислорода
- •Количественное определение хлоридов
- •1. Определение примерного содержания ионов сг в исследуемой пробе воды.
- •Лабораторная работа №6 Жесткость воды.
- •Определение общей и временной жесткости воды комплексонометрическим методом.
- •Лабораторная работа №7 определение содержания железа в воде
- •Количественное определение железа с роданидом Ход работы:
- •1. Построение калибровочного графика
- •2. Анализ исследуемой воды и контрольного раствора Ход работы:
- •Ход работы:
- •4. Обработка результатов
- •Количественное определение железа сульфосалициловым методом
- •Ход работы:
- •Ход работы:
- •Контрольные вопросы
- •Лабораторная работа №8 Колориметрическое определение меди в воде.
- •Ход работы:
- •1. Построение калибровочного графика
- •2. Анализ исследуемой воды и контрольного раствора Ход работы:
- •3. Обработка результатов
- •Плотность растворов некоторых веществ при 200с, г/мл
Количественное определение железа с роданидом Ход работы:
1. Построение калибровочного графика
1.1. Для построения калибровочного графика в ряд мерных колб объемом 50 мл внести пипеткой 0 – 0,5 – 1 – 2 – 3 – 4 – 5 – 6 – 8 – 10 мл эталонного раствора с концентрацией 0,01 мг/мл, что соответствует содержанию железа 0 – 0,1 – 0,2 – 0,4 – 0,6 – 0,8 – 1 – 1,2 – 1,6 – 2 мг/л. В каждую колбу добавить по 1 мл соляной кислоты плотностью 1,12 г/мл, 1 мл 50% роданида аммония и довести объем до 50 мл дистиллированной водой. Содержимое перемешать.
1.2. Измерить оптическую плотность (А) на ФЭКе, применяя сине-зеленый светофильтр (λ=490-500 нм) в кюветах с толщиной оптического слоя 2,3, или 5 см по отношению к дистиллированной воде, в которую добавлены реактивы (первая колба). Измерение оптический плотности проводить три раза для каждого раствора. Для построения калибровочного графика брать средний результат от трех измерений. Данные эксперимента занести в таблицу №3.
Таблица №3
|
№ колбы |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Объем эталонного раствора, мл |
0 |
0,5 |
1 |
2 |
3 |
4 |
5 |
6 |
8 |
10 |
|
Концентрация Fe3+ , мг/л |
0 |
0,1 |
0,2 |
0,4 |
0,6 |
0,8 |
1 |
1,2 |
1,6 |
2 |
|
|
1. |
|
|
|
|
|
|
|
|
|
|
А |
2. | |||||||||
|
|
3. | |||||||||
|
Среднее значение А |
|
|
|
|
|
|
|
|
|
|
1.3. По полученным данным построить калибровочный график, откладывая по оси абсцисс концентрацию железа (СFe3+ , мг), а по оси ординат - значения оптической плотности (А).
При построении графика следует учитывать:
1. График должен выходить из нулевой точки координат.
2. График должен идти, примерно, под углом 45о.
2. Анализ исследуемой воды и контрольного раствора Ход работы:
2.1. В мерную колбу на 50 мл отобрать пипеткой 25 мл исследуемой воды, содержащей по качественной пробе не более 2 мг/л железа, добавить 1 мл раствора HCl плотностью 1,12 г/мл, 1 мл 50% роданида аммония. Довести объем до 50 мл дистиллированной водой и тщательно перемешать содержимое колбы.
2.2. В мерную колбу на 50 мл с контрольным раствором добавить те же реактивы, что и при анализе исследуемой воды. Довести объем до 50 мл дистиллированной водой.
2.3. Измерить оптическую плотность исследуемой воды и контрольного раствора. Данные эксперимента занести в таблицу №4.
3. Анализ исследуемой воды и контрольного раствора на общее содержание железа: Fe2+и Fe3+
Ход работы:
3.1.
В мерную колбу на 50 мл отобрать пипеткой
25 мл исследуемой воды, содержащей не
более 2 мг/л железа. Довести 1 мл раствора
HCl
плотностью 1,12 г/мл, несколько кристаллов
персульфата аммония (NH4)2S2O8,
перемешать и добавить 1 мл 50% раствора
роданида аммония. При добавлении
персульфата аммония Fe2+окисляется
в Fe3+: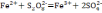
3.2. В мерную колбу с контрольным раствором добавить те же реактивы, что и при анализе исследуемой воды.
3.3. Измерить оптическую плотность исследуемой воды и контрольного раствора на ФЭКе. Данные эксперимента занести в таблицу №4.
Таблица №4
|
|
V пробы, мл |
А |
А ср |
|
Концентрация, мг/л |
| ||
|
|
|
|
|
Fe3+ |
Fe2+и Fe3+ |
Fe2+ | ||
|
Исследуемая вода |
|
1. 2. 3. |
|
|
|
| ||
|
Контрольный раствор |
|
1. 2. 3. |
|
|
|
| ||
