
Molekulyarna_Fizika
.pdf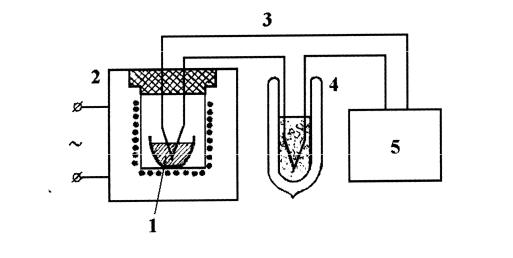
Введемо позначення:
M – маса тигля, в якому плавиться досліджувана речовина; С0 – питома теплоємність матеріалу тигля;
СР і СТ – питомі теплоємності досліджуваної речовини відповідно у рідкому і твердому станах;
m – маса досліджуваної речовини.
Потужності втрат тепла в момент початку тверднення і відразу після закінчення процесу кристалізації відповідно дорівнюють:
|
dQ1 |
C |
Р |
m C |
M q |
|
і |
|
|
dQ2 |
C |
m C M q |
2 |
.(9) |
||||||||||||
|
dt |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
0 |
|
|
1 |
|
|
|
dt |
|
|
T |
|
0 |
|
||||||||
Середня потужність втрат тепла під час затвердіння з |
||||||||||||||||||||||||||
урахуванням виразів (8) і (9) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
1 |
|
dQ |
|
|
|
dQ |
|
1 |
C |
|
|
|
m |
1 |
C M q q |
|
. |
|
|
|||||||
P |
|
|
|
1 |
|
|
2 |
|
|
|
q |
C q |
2 |
|
|
2 |
|
(10) |
||||||||
|
dt |
|
dt |
|
2 |
|
||||||||||||||||||||
2 |
|
|
|
|
|
|
2 |
|
P 1 |
T |
|
|
0 |
1 |
|
|
|
|||||||||
Кількість |
|
|
теплоти, |
що |
розсіялась |
|
|
під |
час |
|
тверднення |
|||||||||||||||
Q P t3 t2 P τ. За цей час при кристалізації температура тіла не змінюється (горизонтальна ділянка, рис. 5), отже така ж кількість теплоти виділяється при утворенні кристалічної фази: Q λm. Прирівнюючи ці теплоти, одержуємо робочу формулу для обчислення питомої теплоти кристалізації:
λ |
τ |
[ C q |
C q |
C |
M |
q |
q ] |
(11) |
|
m |
|||||||
|
2 P 1 |
T 2 |
|
1 |
2 |
|
||
Рис. 6. Схема установки для дослідження процесів плавлення і кристалізації.
210

ДОДАТКИ
I.Деякі фізичні сталі
1.Об’єм 1 моля ідеального газу за нормальних умов
V0=22,4207 л
2.Універсальна газова постійна
R=8,314 Дж/(моль∙К)
3. Число Авогадро
NA = 6,02209 моль-1
4. Число Лошмідта
n0 = 2,68719 м-3
5. Постійна Больцмана
k = 1,38066∙10-23 Дж/К =0,86∙10-4 еВ/К
ІI. Густина деяких речовин1
Речовина |
Густина, |
Речовина |
Густина, |
кг/м3 |
кг/м3 |
||
Азот |
1,25 |
Керосин |
0,78∙103 |
|
|
|
|
Алюміній |
2,69∙103 |
Кисень |
1,43 |
|
|
|
|
Вода |
0,998∙103 |
Лід |
0,9∙103 |
|
|
|
|
Вуглекислий |
1,98 |
Спирт |
0,77∙103 |
газ |
|
(етиловий) |
|
Водяна пара |
0,0048 |
Ртуть |
13,6∙103 |
|
|
|
|
Гелій |
0,18 |
Сталь |
7,85∙103 |
|
|
|
|
Гліцерин |
1,23∙103 |
Повітря |
1,29 |
|
|
|
|
1Для твердих тіл і рідин – за температури 20оС; для газів – за нормальних умов.
214
VIII. Коефіцієнт поверхневого натягу
Рідина |
Коефіцієнт поверхневого натягу |
за 20оС, 10-2 Н/м. |
|
Вода |
7,28 |
Гліцерин |
6,6 |
Керосин |
2,4 |
Ртуть |
49,0 |
Спирт |
2,2 |
IX. Температура кипіння і питома теплота пароутворення при температурі кипіння1
|
Температура |
Питома теплота |
Речовина |
кипіння , |
пароутворення при |
|
оС |
температурі кипіння, |
|
|
105 Дж /кг |
Азот |
-195,8 |
2,01 |
Вода |
100 |
22,6 |
Водень |
-252,7 |
4,61 |
Повітря |
-193 |
2,09 |
Гліцерин |
290 |
|
Кисень |
-183 |
2,14 |
Ртуть |
356,7 |
2,88 |
Спирт |
78,3 |
8,46 |
Вуглекислий газ |
-78,5 |
5,95 |
1Температуру кипіння і питому теплоту пароутворення наведено за нормального тиску.
217
Х. Критичні параметри і поправки Ван-дер-Вальса для реальних газів
|
|
|
Критичні |
Поправки |
|||
|
|
|
величини |
Ван-дер-Вальса |
|||
|
Газ |
|
pкр, |
Ткр, |
а, |
b, 10-5 |
|
|
|
105 Па |
К |
Н м4/моль2 |
м3/моль |
||
Азот |
|
33,9 |
126,1 |
0,133 |
4,0 |
|
|
|
|
|
|
|
|
|
|
Водень |
|
12,9 |
33,0 |
0,024 |
2,6 |
|
|
|
|
|
|
|
|
|
|
Водяна пара |
|
217,7 |
547 |
0,547 |
3,0 |
|
|
|
|
|
|
|
|
|
|
Повітря |
|
37,6 |
132,5 |
0,131 |
3,8 |
|
|
|
|
|
|
|
|
|
|
Гелій |
|
2,26 |
5,0 |
0,0033 |
2,3 |
|
|
|
|
|
|
|
|
|
|
Кисень |
|
49,7 |
154,2 |
0,137 |
3,0 |
|
|
|
|
|
|
|
|
|
|
Вуглекислий |
|
73,8 |
304,0 |
0,36 |
4,3 |
|
|
газ |
|
|
|
|
|
|
|
|
|
|
ХI. Коефіцієнт теплопровідності |
||||
|
|
|
|
|
|
||
|
Речовина |
Коефіцієнт теплопровідності |
|||||
|
за нормальних умов, Вт/(м К) |
|
|||||
|
|
|
|
|
|||
|
Азот |
|
|
2,37∙10–2 |
|
|
|
|
Алюміній |
|
|
2,01∙102 |
|
|
|
|
Водяна пара |
|
1,58∙10–2 |
|
|
||
|
Водень |
|
|
1,68∙10–1 |
|
|
|
|
Повітря |
|
|
2,37∙10–2 |
|
|
|
|
Гелій |
|
|
1,41∙10–2 |
|
|
|
|
Кисень |
|
|
2,39∙10–2 |
|
|
|
|
Лід |
|
|
2,51 |
|
|
|
|
Сталь |
|
|
4,61 |
|
|
|
|
Вуглекислий газ |
|
2,31∙10–2 |
|
|
||
|
|
|
|
|
218 |
|
|
ХІI. Насичена водяна пара
Температура |
Тиск, |
Густина, |
Питома теплота |
|
пароутворення, |
||||
оС |
105 Па |
кг/м3 |
||
|
|
|
кДж/кг |
|
0 |
0,00608 |
0,004843 |
2498,3 |
|
10 |
0,01228 |
0,009398 |
2468,1 |
|
20 |
0,02824 |
0,01730 |
2446,3 |
|
30 |
0,04246 |
0,03037 |
2425,0 |
|
40 |
0,07375 |
0,05118 |
2403,2 |
|
50 |
0,12337 |
0,08320 |
2378,1 |
|
60 |
0,19888 |
0,13026 |
2356,7 |
|
70 |
0,31136 |
0,1982 |
2332,5 |
|
80 |
0,47336 |
0,2936 |
2307,3 |
|
90 |
0,70098 |
0,4219 |
2281,8 |
|
100 |
1,01332 |
0,5974 |
2257,4 |
|
110 |
1,43245 |
0,8254 |
2228,8 |
|
120 |
1,98505 |
1,122 |
2213,5 |
|
130 |
2,70064 |
1,497 |
2169,6 |
|
140 |
3,61226 |
1,968 |
2139,0 |
|
150 |
4,75787 |
2,547 |
2109,3 |
|
160 |
6,16207 |
3,253 |
2079,2 |
|
170 |
7.91495 |
4,114 |
2049,9 |
|
180 |
9,83065 |
5,141 |
2018,9 |
|
190 |
12,53794 |
6,353 |
1997,5 |
|
200 |
16,21737 |
7,770 |
1955,3 |
|
210 |
19,05422 |
9,443 |
1920,9 |
|
220 |
23,26319 |
11,38 |
1884,9 |
ХІІІ. Співвідношення між деякими одиницями
1мм рт.ст.=0,01316 атм=133,3 Па 1атм=760 мм рт. ст.=1,013∙105 Па
1Дж=0,239 кал=6,6242∙1018 еВ
1еВ=1,602∙10–19 Дж=4,45∙10–26 кВт год
1атм л=101,3 Дж=24,1 кал
219
