
- •Научно-методический анализ темы «Основы термодинамики» в курсе физики средней общеобразовательной школы
- •Оглавление
- •Введение:
- •1.Методический анализ структуры и содержания темы «Основы термодинамики»
- •1.1. Основные задачи изучения темы «Основы термодинамики»
- •1.2. Структура темы «Основы термодинамики»
- •1.3. Формирование основных видов знаний
- •1.4. Формирование основных умений и навыков учебной работы учащихся при изучении темы.
- •1.5. Особенности изучения содержания темы «Основы термодинамики»
- •1.5.1.Термодинамический метод изучения тепловых явлений
- •1.5.2.Внутренняя энергия. Количество теплоты.
- •1.5.3.Первый закон термодинамики
- •1.5.4.Работа тепловых двигателей
- •1.6. Пути формирования познавательного интереса у учащихся и развитие их творческих способностей.
- •2. Методические разработки по теме «Основы термодинамики»
- •2.1. Технологическая карта урока по теме «Основы термодинамики»
- •2.2.Урок изучения нового материала по теме «Основы термодинамики»
- •1 Группа – адиабатный
- •2 Группа – изотермический
- •3 Группа – изохорный
- •4 Группа – изобарный
- •2.3.Урок систематизации и обобщения знаний. Нетрадиционный урок по теме «Основы термодинамики»
- •1. Вступительное слово учителя.
- •2.4.Урок решения задач по теме «Основы термодинамики»
- •2.5.Урок лабораторной работы по теме «Основы термодинамики»
- •2.6.Конспект урока контрольной работы по теме «Основы мкт»
- •Вариант 1
- •Вариант 2
- •Вариант 1
- •Вариант 2
- •2.7.Конспект проблемного урока по теме «Основы термодинамики»
- •III. Закрепление изученного материала.
- •IV. Итог урока.
- •Заключение:
- •Список использованной литературы
2.2.Урок изучения нового материала по теме «Основы термодинамики»
Тема урока: «Применение первого закона термодинамики к изопроцессам в газе»
Цели урока:
Сформировать умение использовать первый закон термодинамики для описания газовых процессов;
Ввести понятие - адиабатный процесс.
Рассмотреть теплоемкость газа для каждого процесса
План урока:
|
1 |
Оргмомент |
1 мин |
|
|
2 |
Актуализация знаний |
5 мин |
Постановка цели |
|
3 |
Изучение нового |
30 мин |
Работа по группам, лекция |
|
4 |
Рефлексия |
3 мин |
опрос |
|
5 |
Задание на дом |
1 мин |
|
Задание на дом: §11
Оборудование:
Компьютер, проектор мультимедийный – для учителя;
Ноутбуки с OMS – плеером -4 шт – для учащихся
Содержание:
Актуализация знаний:
Что называют изопроцессом?
Что называют изотермическим процессом?
Что называют изохорным процессом?
Что называют изобарным процессом?
Формула изменения внутренней энергии газа
Формула работы для газа
Первый закон термодинамики
Изучение нового:
Работу построим следующим образом: разделимся на 4 группы, каждая группа изучает один из процессов и рассматривает закон термодинамики применимо к этому процессу.
1 Группа – адиабатный
2 Группа – изотермический
3 Группа – изохорный
4 Группа – изобарный
|
Изопроцесс |
Постоянный параметр |
Переменные параметры |
Математическая запись закона |
1 закон термодинамики |
Теплоемкость |
|
Изотермический |
Т |
p, V |
pV = const |
Q=A |
|
|
Изобарный |
P |
T, V |
V/T= const |
Q= ΔU+A A= ΔU+Q |
|
|
Изохорный |
V |
p, T |
p/T= const |
ΔU=Q |
|
|
Адиабатный |
Q=0 |
P,V |
|
ΔU=A |
|
Обратите внимание, адиабата идет обязательно круче изотермы. Ведь при адиабатном процессе давление газа уменьшается не только за счет увеличения объема, как при изотермическом, но и за счет его температуры.
Если нагревать тело при постоянном давлении, то оно будет расширяться и совершать работу. Для нагревания тела на 1 К при постоянном давлении ему нужно передать большее количество теплоты, чем при таком же нагревании при постоянном объеме.
Как же определить количество теплоты, получаемое телом при нагревании или отданное при охлаждении?
Из 8 класса известно, сто Q=cmΔT, где с – удельная теплоемкость вещества. Теплоемкость зависит не только от свойств вещества, но и от процесса, при котором осуществляется теплопередача.
Теплоемкость газа при постоянном объеме
Найдем
молярную теплоемкость газа при постоянном
объеме. Согласно определению
теплоемкости
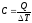 ,
гдеΔT
—
изменение температуры. Если процесс
происходит при постоянном объеме, то
эту теплоемкость обозначим через Cv.
Тогда
QV
= CVΔT.
,
гдеΔT
—
изменение температуры. Если процесс
происходит при постоянном объеме, то
эту теплоемкость обозначим через Cv.
Тогда
QV
= CVΔT.
При постоянном объеме работа не совершается. Поэтому первый закон термодинамики запишется так: CVΔT = ΔU.
Изменение
энергии одного моля достаточно
разреженного (идеального) одноатомного
газа равно
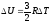 .
Следовательно, молярная теплоемкость
при постоянном объеме одноатомного
газа равна
.
Следовательно, молярная теплоемкость
при постоянном объеме одноатомного
газа равна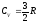 .
.
Теплоемкость газа при постоянном давлении
Согласно определению теплоемкости при постоянном давлении Ср Qp = СрΔТ.
Работа, которую совершит 1 моль идеального газа, расширяющегося при постоянном давлении, равна A' = RΔT.
Это следует из выражения для работы газа при постоянном давлении А' = pΔV и уравнения состояния (для одного моля) идеального газа. pV = RT.
Внутренняя энергия идеального газа от объема не зависит. Поэтому и при постоянном давлении изменение внутренней энергии ΔU = CVΔT, как и при постоянном объеме. Применяя первый закон термодинамики, получим СрΔТ = CVΔT + RΔT.
Следовательно, молярные теплоемкости идеального газа связаны соотношением Cp = Cy + R.
Впервые эта формула была получена Р. Майером и носит его имя.
В
случае идеального одноатомного газа
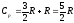
Теплоемкость идеального газа при изотермическом процессе
Можно формально ввести понятие теплоемкости и при изотермическом процессе. Так как при этом процессе внутренняя энергия идеального газа не меняется, какое бы количество теплоты ему ни было передано, то теплоемкость бесконечна.
Теплоемкость при адиабатном процессе равна 0, т.к. Q=0.
Сегодня на уроке мы изучили новый изопроцесс – адиабатный, научились использовать первый закон термодинамики для описания газовых процессов. На следующем уроке мы будем решать задачи на применение первого закона термодинамики.
Чтобы понять, на сколько интересен и полезен материал, который мы изучили на уроке, выполните задание:
Оцените сегодняшний урок: 0 –нет, 1- да.
Вам было интересно на уроке?
Вы узнали, что-то новое?
Был ли доступен изучавшийся материал?
Вы его поняли?
Готовы ли вы работать на материалом на следующем уроке?
Количество баллов
Ваша оценка урока.
Спасибо за урок.
Оценки за урок.
Список литературы:
Физика: учебное пособие для 10 класса общеобразоват. учреждений с рус. яз. обучения / Е.В.Громыко и др. — Минск: Адукацыя i выхаванне, 2013.- 272 с.
