
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Порядок выполнения работы.
Записать элемент в строку. Для этого по таблице стандартных потенциалов (см. приложение) определить знаки электродов в гальваническом элементе:
e0Zn2+|Zn = -0,763B; e0Cu2+|Cu = 0,337B.
Так как цинковый электрод отрицательный, а медный – положительный, то в соответствии с Международной конвенцией гальванический элемент следует записать следующим образом:
Zn|ZnSO4||CuSO4|Cu
C1 C2
Приготовить электроды. Для этого медную и цинковую пластинки зачистить мелкой наждачной бумагой. При зачистке электродов употреблять индивидуальную наждачную бумагу.
Промыть электроды дистиллированной водой, затем соответствующим для металла раствором электролита.
Погрузить электроды в специальные сосуды с соответствующими растворами требуемой концентрации.
Обмыть концы электролитического мостика дистиллированной водой и ввести в электродные сосуды специальные патрубки (рис.1).
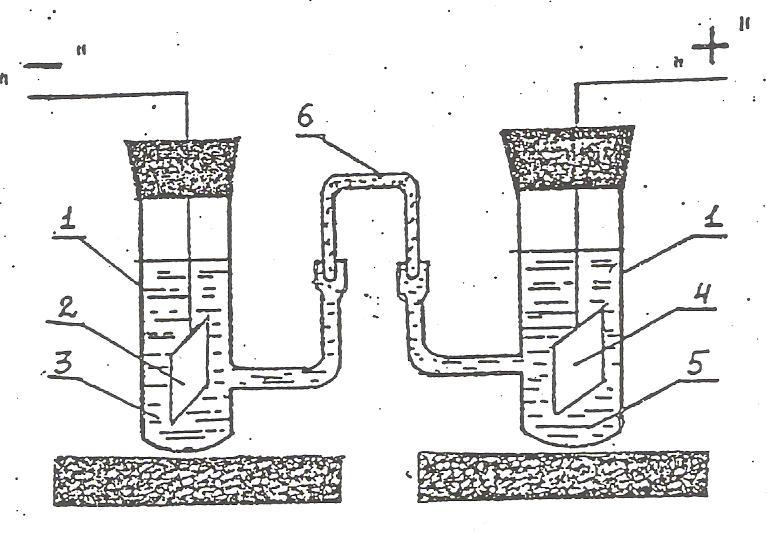
Рис.1 Схема гальванического элемента.
Стеклянный сосуд с патрубком для соединения с другим электродом;
Цинковая пластинка;
Раствор сульфата цинка;
Медная пластинка;
Раствор сульфата меди;
Электролитический мостик.
Подключить зажимы от цифрового вольтметра к соответствующим электродам и измерить ЭДС. Если на цифровом табло высветится отрицательное значение ЭДС, необходимо зажимы у электродов поменять местами. Занести измеренное значение ЭДС в таблицу 1.
Рассчитать теоретическое значение ЭДС воспользовавшись уравнением Нернста.
|
RT
E
= E0
+ · ln (aCu2+/aZn2+) zF |
или, подставив значения R( 8,31 Дж/моль·К ) и коэффициент пересчёта от натурального к десятичному логарифму (2,3), уравнением.
|
Т
Е
= Е0
+ 2·10-4
· ·lg(aCu2+|AZn2+) z |
При небольших концентрациях (с ≈ 0,001 моль/л) можно считать, что aZn2+(Cu2+) ≈ c Zn2+(Cu2+)
Если концентрация велика – больше 0,01 моль/л, необходимо рассчитать среднюю ионную активность электролита a+ = γ+· c+ ,где
γ+ - средний ионный коэффициент активности (см. приложение).
c+ - cредняя ионная концентрация, она связана с молярной соотношением
c+ = c(ν+ν+ · ν-ν-)1/ν ,где
ν+,ν- - число катионов, анионов, на которое распадается молекула электролита;
ν - общее число ионов.
Для сульфата меди и цинка ν+ = ν__ = 1
Значит, с+ = с и а+ = γ+ · с
Подобным образом измеряют и рассчитывают ЭДС других элементов. Полученные данные заносят в таблицу 1.
Таблица 1.
|
№ изме- рения |
Гальванический элемент |
Еизм., В |
Етеор, В |
Относительная ощибка измерений, 0/0 |
|
1. 2. 3. |
|
|
|
|
Лабораторная работа №2
Изменение потенциалов отдельных электродов.
Цель работы:
Составить полуэлементы и вычислить на основании экспериментальных данных потенциалы заданных электродов.
Рассчитать электродные потенциалы по уравнению Нернста и сравнить их значения с вычисленными на основании опытных данных.
Изучить влияние концентрации электролита и природы электрода на значение электродного потенциала.
Порядок выполнения работы.
В основе определения потенциалов электродов лежит измерение ЭДС гальванических элементов, состоящих из электродов, потенциалы которых нас интересуют, и электрода сравнения, например, хлорсеребряного
(е0Cl-|AgCl|Ag = + 0,222B) .
Для экспериментального определения электродных потенциалов составляют следующие гальванические элементы:
Ag | AgCl | KCl || CuSO4 | Cu,
С1
Zn | ZnSO4 || KCl | AgCl | Ag.
С2
Хлорсеребряный электрод по отношению к медному является отрицательным, по отношению к цинковому – положительным.
ЭДС составленных элементов (Ех) измеряют на установке, схема которой приведена на рис. 2.
1
– стеклянный сосуд с раствором и
патрубком для соединения с другим
электродом;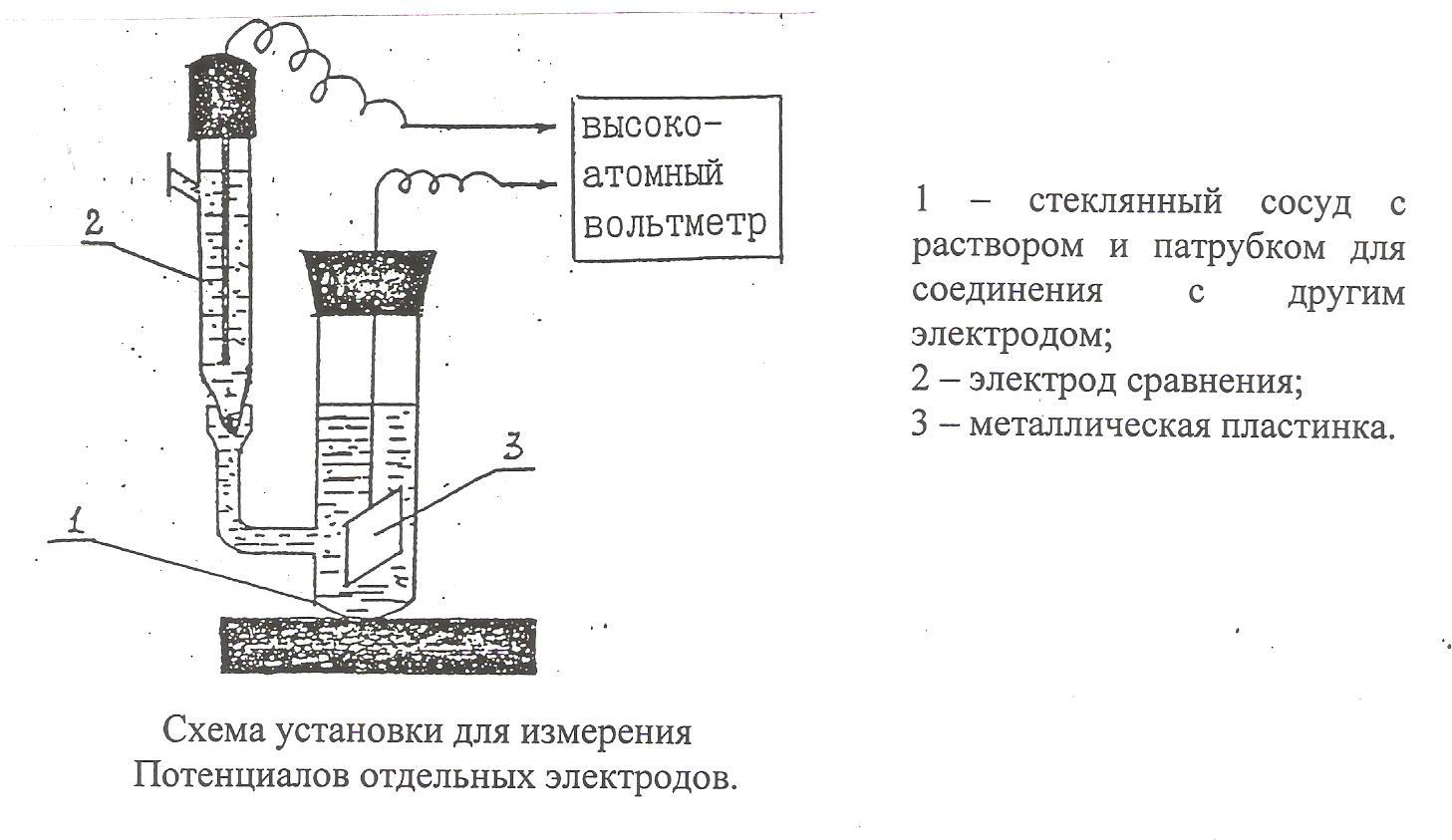
2 – электрод сравнения;
3 – металлическая пластинка.
Схема установки для измерения
