
- •Предисловие
- •Введение
- •Роберт Вильгельм Бунзен
- •Анри Луи Ле Шаталье
- •Вильгельм Фридрих Оствальд
- •Сванте Август Аррениус
- •Якоб Генрих Вант-Гофф
- •Иоханн Николаус Брёнстед и Михаил Ильич Усанович
- •Николай Николаевич Семенов
- •Химическая термодинамика учебно-целевые задачи – научить студентов:
- •Значимость темы
- •Основные понятия и определения химической термодинамики
- •Внутренняя энергия
- •Теплота и работа
- •Первый закон термодинамики
- •Применение I закона к простейшим процессам
- •Тепловые эффекты. Закон гесса
- •Теплоемкость
- •Второй закон термодинамики
- •Некоторые формулировки 2-го закона
- •Изменение энтропии при различных процессах
- •Пастулат планка
- •Термодинамические потенциалы
- •Соотношение между термодинамическими потенциалами
- •Закон действующих масс
- •Вопросы по теме: "термодинамика"
- •Примеры решения типовых задач
- •Пример решения контрольного задания по теме "Термодинамика"
- •Решение
- •Задачи для самостоятельной работы
- •Варианты заданий для домашней контрольной работы
- •Лабораторная работа №1.
- •Особые условия выполнения работы:
- •Устройство и настройка термометра Бекмана
- •Термодинамика фазовых превращений
- •Термодинамика фазовых равновесий
- •Основные понятия
- •Уравнение клайперона-клаузиуса
- •Диаграммы состояния однокомпонентных систем
- •Диаграмма состояния воды
- •Диаграмма состояния диоксида углерода
- •Бинарные системы Диаграммы плавкости
- •Взаимная растворимость жидкостей
- •Трехкомпонентные системы
- •Равновесие жидкость-жидкость в трехкомпонентных системах.
- •Распределение растворяемого вещества между двумя жидкими фазами. Экстракция.
- •Вопросы для подготовки к занятиям по теме: "термодинамика фазовых равновесий".
- •Примеры решения типовых задач.
- •Задачи для самостоятельной работы.
- •Лабораторная работа 1: построение диаграммы плавкости 2-х компонентной системы с простой эвтектикой.
- •Лабораторная работа № 2. Изучение взаимной растворимости фенола и воды.
- •Лабораторная работа № 3. Определение коэффициента распределения уксусной кислоты между водой и бензолом.
- •Свойства разбавленных растворов электролитов и неэлектролитов.
- •Повышение температуры кипения растворов.
- •Понижение температуру замерзания растворов.
- •Биологическое значение осмотического давления
- •Указания к выполнению работы.
- •Вопросы для самоконтроля по технике выполнения работы
- •Вопросы для самоконтроля при выполнении данного задания
- •Вопросы и задачи для самоконтроля усвоения темы
- •Вопросы для самоконтроля усвоения материала практической работы
- •Биологический статус изучаемой темы
- •Вопросы для подготовки:
- •Диссоциация воды
- •Водородный показатель
- •Механизм действия буферных систем
- •РН буферных систем
- •Влияние изменения объема буферных систем на рН.
- •Кислотно-щелочное равновесие крови
- •Роль внутренних органов в поддержании кислотно-щелочного резерва.
- •Изменение кислотно-щелочного равновесия при различных заболеваниях.
- •Задачи и задания для самостоятельной работы
- •Экспериментальная часть
- •Работа №3. Определение буферной ёмкости.
- •Электрохимия. Учебно-целевые задачи: Изучив этот раздел учебной программы, студент должен знать:
- •Значение электрохимических явлений для медицины.
- •Электродные процессы и электродвижущие силы.
- •Электрод и электродный потенциал.
- •Строение двойного электрического слоя на границе раствор-металл
- •Уравнение нернста
- •Гальванические элементы и их электродвижущие силы
- •Концентрационные гальванические элементы.
- •Диффузный потенциал.
- •Электроды первого рода.
- •Водородный электрод.
- •Ионоселективные электроды
- •Стеклянный электрод
- •Электроды второго рода.
- •Хлорсеребряный электрод Аg ׀ Ag Cl. KCl
- •Сопровождается реакцией растворения или осаждения соли АgСl:
- •Окислительно – восстановительные системы (ов) и ов –электроды.
- •Уравнение Петерса.
- •Классификация обратимых электродов.
- •Измерение эдс гальванических элементов.
- •Потенциометрия.
- •Прямые потенциометрические методы.
- •Приложение
- •Экспериментальная часть. Лабораторная работа №1. Измерение эдс гальванических элементов.
- •Порядок выполнения работы.
- •Изменение потенциалов отдельных электродов.
- •Потенциалов отдельных электродов.
- •Лабораторная работа № 3.
- •Лабораторная работа №4. Потенциометрическое измерение окислительно – восстановительных потенциалов. Редокс – системы.
- •Кинетика
- •Значение для медицины и фармации
- •Вопросы для подготовки к занятию
- •Введение
- •Понятие о скорости химического процесса
- •Основной закон химической кинетики
- •Кинетические уравнения реакций
- •Реакции первого порядка
- •Реакции второго порядка
- •Сложные реакции
- •Гетерогенные реакции
- •Температурная зависимость константы скорости реакции.
- •Методы расчета энергии активации и предэкспоненциального множителя а.
- •Основы молекулярной кинетики
- •Теория активных столкновений
- •Теория переходного состояния
- •Задачи и задания для самостоятельного решения.
- •Экспериментальная часть
- •Опыт № 1.Зависимость от концентрации.
- •Опыт №2. Зависимость от температуры
- •Учебно-методическое и информационное обеспечение дисциплины
- •По технике безопасности
- •И производственной санитарии при работе
- •В химических лабораториях
- •Медицинских учебных заведений
- •Содержание
Экспериментальная часть
Цель работы:
Научится готовить буферные растворы с заданным значением pH.
Изучить опытным путем важнейшие свойства буферных растворов.
Уметь определять буферную ёмкость различными методами (объёмным и потенциометрическим титрованием).
Научится определять pH раствора колориметрическим (буферным) методам.
Работа №1. ПРИГОТОВЛЕНИЕ БУФЕРНЫХ РАСТВОРОВ
ОПЫТ №1. Приготовить 20мл 0,1 М ацетатного буфера с заданным значением pH (задание даёт преподаватель) из 0,1 М раствора CH3COONa. Константа диссоциации уксусной кислоты при данной ионной силе равна 3×10-5
ОПЫТ №2. Приготовить 20 мл 0,02 М фосфатного буфера с заданным значением pH из 0,02 М раствора Na2HPO4 и 0,02 М раствора NaH2PO4.
Kд (H2PO4-) -при данной ионной силе равна 1,6×10-7. Проверить pH приготовленных буферных растворов при помощи индикаторной бумаги или при помощи pH-метра.
В отчете должен быть проведён подробный расчёт соотношения объёмов компонентов данной буферной смеси и описан метод определения pH.
Буферные
растворы полученные в данной работе не
выливать, а проделать с ними
 работу
№2.
работу
№2.
Работа №2 СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ.
ОПЫТ №1. Влияние разбавления на pH буферных растворов.
В один стакан налить 10 мл, в другой -1 мл одного из буферных растворов(например, ацетатного), приготовленного в работе №1.Раствор в первом стакане развести в 2 раза, а во втором – в 100 раз.
При помощи индикатора определить pH разведенных буферных растворов и сравнить с исходным значением pH. Для этого следует налить в пробирки по 2 мл исходного и разведенного буферных растворов и добавить по 2 капли соответствующего индикатора. Сравнить цвет индикатора в исходном буферном растворе и в разведенных растворах. В отчёте следует привести данные о наблюдаемых явлениях. Дать им объяснения.
Опыт №2. Зависимость буферной емкости ацетатных буферных смесей от буферного соотношения.
К пяти ацетатным буферным системам с различными соотношениями соли и кислоты добавляют одинаковое количество сильного основания или сильной кислоты, измеряют pH и вычисляют их буферную ёмкость.
В пять стаканчиков налить 20 мл приготовленных буферных смесей с буферным соотношением: 100; 10; 1; 0,1; 0,01.
Измерить
pH
исходных буферных систем при помощи
pH-метра
(после каждого измерения pH
электроды должны быть тщательно
вымыты). Измеренное значение pH
исходных смесей несколько отличается
от рассчитанного, так как в этих системах
 aH+
aH+
 cH+.
cH+.
Во все буферные смеси добавить по 2 мл 0,1M NaOH, тщательно перемешать и снова измерить pH.
Налить в стаканчики такое же количество буферных систем и при перемешивании добавить в каждый по 2 мл 0,1M HCl. Измерить pH систем после добавления кислоты.
Рассчитать в каждом отдельном случае буферную ёмкость по кислоте и основанию:
Bk=
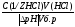 :
:
Bщ=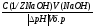
Полученные данные занести в таблицу 1 по образцу:
Таблица №1
|
Буферное соотношение |
Исходное значение pH |
pH после добавления NaOH |
|
Bщ. |
pH после добавления HCl |
|
Вк. |
|
100 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
|
0,01 |
|
|
|
|
|
|
|
Построить
на основании полученных данных график
зависимости буферной ёмкости по
кислоте и основанию от соотношения
количества соли и кислоты в буферной
смеси. На ось абсцисс нанести логарифм
соотношения соль/кислота, а на ось
ординат –B.
Ось ординат удобно проводить в
пересечении с точкой абсциссы, где
lg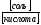 =0
и pH=pK.
=0
и pH=pK.
Кривые, относящиеся к буферной ёмкости по кислоте и основанию, начертить в цвете.
В отчете объяснить ход кривых зависимости буферной ёмкости по кислоте и основанию от соотношения количества соли и кислоты в системе и объяснить, почему ход кривых различный.

 pH
pH pH
pH