
- •Глава 1.Строение и основные характеристики атомных ядер
- •§1.1. Протонно-нейтронная структура ядра.
- •§1.2. Электрический заряд ядра
- •§1.4. Энергетические характеристики ядра
- •§1.5. Размер ядра
- •§1.6. Спин, магнитный и электрический моменты ядер
- •1. Спин ядра
- •2. Магнитный момент ядра
- •3. Электрический момент ядра
- •§1.7.Возбужденные состояния ядер
- •§1.8.Четность
- •§1.9. Ядерные силы
- •§1.10.Изотопический спин
- •§1.11.Статистика
- •Глава 2. Модели атомных ядер §2.1.Необходимость и классификация моделей
- •§2.2.Капельная модель
- •§2.3.Оболочечная модель
- •Глава 3. Радиоактивные превращения ядер §3.I. Определение, виды радиоактивности, радиоактивные семейства
- •§3.2.Основные законы радиоактивного распада
- •§3.3.Активация
- •§3.4. Альфа –распад
- •§3.5.Бета –распад
- •§3.6.Гамма–излучение ядер
- •Глава 4. Ядерные реакции §4.1.Основные понятия иклассификация
- •§4.2.Механизм ядерных реакций
- •§4.3.Сечения ядерных реакций
- •§4.4.Законы сохранения в ядерных реакциях
- •§4.5.Кинематика ядерных реакций. Импульсная диаграмма
- •§ 4.6.Реакции под действием заряженных частиц
- •1. Общие свойства
- •2. Реакции под действием α-частиц
- •3. Реакции под действием протонов
- •4. Реакции под действием дейтонов
- •§4.7.Термоядерный синтез
- •§4.8.Фотоядерные реакции
- •§4.9. Реакции под действием нейтронов
- •1. Основные свойства нейтронов
- •2. Источники нейтронов
- •3. Энергетические группы
- •4. Взаимодействие нейтронов с ядрами
- •5. Резонансные процессы
- •Глава 5. Деление ядер §5.1. Открытие и капельная модель
- •§5.2. Основные свойства вынужденного деления

![]()
Обнинский государственный технический университет
атомной энергетики
Кафедра ядерной физики
Л.Н. Пустынский
Конспект лекций по ядерной физике
Учебное пособие по курсу «Ядерная и нейтронная физика».
Электронная версия.
Обнинск, 2003
Пустынский Л.Н. Конспект лекций по ядерной физике. Учебное пособие по курсу «Ядерная и нейтронная физика».Электронная версия. –Обнинск, ИАТЭ, 2003. –215с.
П особие
представляет электронную версию
конспекта лекций, которые автор читал
по курсам «Ядерная физика» и «Ядерная
и нейтронная физика» в 1999 – 2003 учебных
годах для различных специальностей
университета. Пособие написано в полном
соответствии с рабочими программами и
может быть рекомендовано как основное
пособие при подготовке к сдаче экзамена
по читаемым курсам. Автор выражает
признательность проф. В.С. Ставинскому
за ценные и полезные замечания и чтит
его память.
особие
представляет электронную версию
конспекта лекций, которые автор читал
по курсам «Ядерная физика» и «Ядерная
и нейтронная физика» в 1999 – 2003 учебных
годах для различных специальностей
университета. Пособие написано в полном
соответствии с рабочими программами и
может быть рекомендовано как основное
пособие при подготовке к сдаче экзамена
по читаемым курсам. Автор выражает
признательность проф. В.С. Ставинскому
за ценные и полезные замечания и чтит
его память.
Автор заранее выражает признательность всем прочитавшим данное пособие и сделавшим замечания автору.

© Л.Н. Пустынский, 2003
Глава 1.Строение и основные характеристики атомных ядер
В настоящее время твердо установлено и нет сомнений в том, что атом состоит из электронов (Дж. Томсон, 1897), и ядра (Э. Резерфорд, 1911). Атомные ядра обладают целым рядом индивидуальных свойств, которые позволяют отличать ядра отдельных химических элементов друг от друга, и в то же время являются общими характеристиками для всех ядер.
Атомные ядра могут быть стабильными, т.е. живущими неограниченно долго, инестабильными, испытывающие спонтанные (самопроизвольные) радиоактивные превращения.
Все атомные ядра имеют следующие характеристики: число нуклонов в ядре; электрический заряд ядра; масса ядра; энергия связи ядра; размер ядра; спин ядра; магнитный и электрический моменты ядра; четность волновой функции; изотопический спин; статистику.
Нестабильные ядра имеют ряд дополнительных характеристик, таких как тип радиоактивного превращения, среднее время жизни, энергия, выделяемая при распаде.
Ядра могут находиться в различных энергетических состояниях и как любая квантовая система имеют свою индивидуальную, присущую только ядру данного нуклида, систему энергетических уровней. Состояние ядра с наименьшей энергией называется основным,остальные –возбужденными. Ядра в возбужденных состояниях неустойчивы и, в отличие от основных состояний, могут находиться в возбужденных состояниях ограниченное время, испытывая спонтанные переходы в состояния с меньшей энергией.
Ниже будет показано (см. §1.7), что разделение на стабильные, нестабильные и возбужденные ядра является до некоторой степени условным, так как они могут характеризоваться рядом общих свойств.
§1.1. Протонно-нейтронная структура ядра.
Все вещества состоят из молекул. Молекулы, в свою очередь, состоят из атомов. Атом же состоит из ядра и электронной оболочки. Размер атома определяется электронной оболочкой и равен ≈ 10-8см. Ядро – центральная массивная часть атома имеет размеры ≈ 10-131012см(1 – 10Фм(ферми)). Следовательно, размер ядра меньше атома в 104 – 105раз.
Ядро состоит из особых частиц (Гейзенберг, Иваненко) -протонов(Резерфорд, 1919) инейтронов (Чедвик, 1932). Протон имеет один положительный элементарный электрический заряд, а электрический заряд нейтрона равен нулю. Между этими частицами в любых парных комбинациях действуют особые (ядерные) силы, не зависящие от электрического заряда частиц, которые обеспечивают связь отдельных протонов и нейтронов с ядром. Поэтому в ядерной физике используют обобщающий терминнуклон, обозначающий любую из частиц, входящую в состав ядра, - как протон, - так и нейтрон.
Число нуклонов в ядре обозначается буквой А и называетсямассовым числом.
Число протонов в ядре обозначается буквой Z. Кроме этого Z– число электронов в атоме с ядром, имеющимZпротонов, поскольку атом является электрически нейтральным. Так как химические свойства элементов определяются числом электронов в атоме, тоZесть такжепорядковый илиатомный номерэлемента в таблице Менделеева.
Число нейтронов в ядре обозначают буквой N. Следовательно, число нейтронов в ядреN=A–Z.
Любая из трех пар чисел (Z,N), (N,A) или (A,Z) однозначно определяет состав ядра. Обычно, по причинам, которые будут указаны ниже, используют пару чисел (А,Z).
Атом
с ядром, имеющее конкретные значения A
иZ,называютнуклидом,
а совокупность нуклидов с одинаковымZ-химическим элементом.
ЧислоZполностью определяет
химический элемент, а числаZиA- нуклид. Для обозначения
нуклида используют две формы записи:
(А,Z) или![]() ,
где Х - символ химического элемента.
Например, (12,6) или
,
где Х - символ химического элемента.
Например, (12,6) или![]() -
соответствующий нуклид углерода.
Поскольку символ химического элемента
однозначно связан с Z,то
часто атомный номер в форме записи с
указанием символа химического элемента
опускают и пишут просто
-
соответствующий нуклид углерода.
Поскольку символ химического элемента
однозначно связан с Z,то
часто атомный номер в форме записи с
указанием символа химического элемента
опускают и пишут просто
![]() .
Такие же обозначения используются и
для ядер.
.
Такие же обозначения используются и
для ядер.
Нуклиды,
ядра которых имеют в своем составе
одинаковое число протонов Z,но различаются числом нуклонов А,
называютсяизотопами химического
элемента. Вещества, имеющие в своем
составе атомы изотопов, имеют одинаковые
химические свойства, но различную
плотность, температуру плавления,
кипения и пр., т.е. различаются физическими
свойствами. Например:![]() изотопы водорода.1Н - протий
(легкий водород);1Н - дейтерий
(тяжелый водород, употребляют также
символ D, для ядра -d);3Н - тритий (сверхтяжелый водород,
употребляют также символT,
для ядраd);233U,235U,238U- изотопы урана. Однако об изотопе имеет
смысл говорить, подразумевая его
принадлежность к химическому элементу.
Поэтому235U - делящийся
нуклид урана, а не делящийся изотоп
урана. Таким же образом3Н -
радиоактивный нуклид водорода, а не
радиоактивный изотоп, так как и в этом
случае подразумеваются физические
характеристики ядра, а не соответствующие
химические свойства атома.
изотопы водорода.1Н - протий
(легкий водород);1Н - дейтерий
(тяжелый водород, употребляют также
символ D, для ядра -d);3Н - тритий (сверхтяжелый водород,
употребляют также символT,
для ядраd);233U,235U,238U- изотопы урана. Однако об изотопе имеет
смысл говорить, подразумевая его
принадлежность к химическому элементу.
Поэтому235U - делящийся
нуклид урана, а не делящийся изотоп
урана. Таким же образом3Н -
радиоактивный нуклид водорода, а не
радиоактивный изотоп, так как и в этом
случае подразумеваются физические
характеристики ядра, а не соответствующие
химические свойства атома.
Нуклиды, ядра которых имеют одинаковое число нуклонов (одинаковое массовое число А), но различное число протонов Z,называютизобарами. Например:3Н и3Не -изобары трития и гелия,10Ве,10В,10С - изобары бериллия, бора и углерода.
Нуклиды с одинаковым числом нейтронов в составе ядра называют изотонами. Например,2Н и3Не-изотоны водорода и гелия.
С войства
ядер различных нуклидов можно
систематизировать с помощьюпротонно-нейтронной диаграммы(диаграммы Сегре) – таблицы, строки
которой соответствуют нуклидам с
одинаковым числом протонов, а столбцы
– нуклидам с одинаковым числом нейтронов.
На рис.1.1.1 показан принцип построения
протонно-нейтронной диаграммы на примере
нуклидов с легкими ядрами. П
войства
ядер различных нуклидов можно
систематизировать с помощьюпротонно-нейтронной диаграммы(диаграммы Сегре) – таблицы, строки
которой соответствуют нуклидам с
одинаковым числом протонов, а столбцы
– нуклидам с одинаковым числом нейтронов.
На рис.1.1.1 показан принцип построения
протонно-нейтронной диаграммы на примере
нуклидов с легкими ядрами. Протонно-нейтронная
диаграмма для всех известных нуклидов
приведена на рис.1.1.2.
Отметим следующие эмпирические факты и закономерности, которые следуют из протонно-нейтронной диаграммы атомных ядер.
1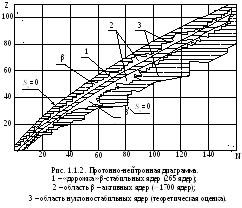 .
Известно более 2000 нуклидов, из них 265
нуклидов являются стабильными нуклидами.
.
Известно более 2000 нуклидов, из них 265
нуклидов являются стабильными нуклидами.
2.Нуклиды с официальными названиями имеютZот 0 (нейтрон) до 109 (мейтнерий). Для существующих в природе ядер Zменяется от 1(водород) до 92(уран).Остальные нуклиды получают искусственно. Не существует стабильных нуклидов с Z= 0, 43, 61 иZ84.
3.Известны нуклиды с числом нуклонов А от 1 до263включительно. Не существует стабильных нуклидов при А = 5, 8 и при А210.
4.Область
протонно-нейтронной
диаграмы, где располагаются β‑стабильные
нуклиды (заштрихованная полоса 1 на
рис.1.1.2), называется дорожкой
стабильности. Легкие
стабильные нуклиды (до Z≤ 20)содержат в составе
ядра примерно равное число протонов и
нейтронов. С ростом массового числа А
относительная доля нейтронов возрастает.
Например, у легкого нуклида
![]() N/Z
= 1;у среднего нуклида
N/Z
= 1;у среднего нуклида![]() N/Z =
1,15;у тяжелого нуклида
N/Z =
1,15;у тяжелого нуклида
![]() N/Z = 59.
Опережающий рост числа нейтронов при
больших А вызван действием дальнодействующих
кулоновских сил взаимного отталкивания
протонов в ядре.
N/Z = 59.
Опережающий рост числа нейтронов при
больших А вызван действием дальнодействующих
кулоновских сил взаимного отталкивания
протонов в ядре.
5.Большинство химических элементов имеет по несколько стабильных и -активных нуклидов. Некоторые элементы имеют (см. рис.1.1.1) всего по одному стабильному нуклиду (9Be,19F, 23Na),остальные -по 2 ÷ 3стабильных нуклидов. Олово (Sn) имеет десять стабильных нуклидов.
6. Выше дорожки стабильности располагаются β+‑активные нуклиды, ниже – β-‑активные нуклиды.
7. Свойства ядер существенно зависят от четности чисел ZиN. Наибольшее число стабильных нуклидов (155 из 265) имеют четно-четные ядра (Z– четно,N– четно), поровну стабильных нуклидов (по 53) с четно-нечетным и нечетно-четным количеством нуклонов в составе ядер. И имеется всего четыре стабильных нуклида (2Н,6Li,10В и14N), имеющих нечетно-нечетный состав ядер.
