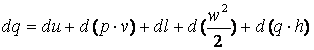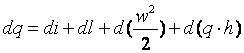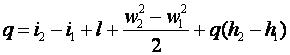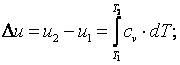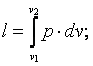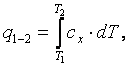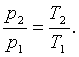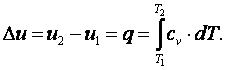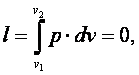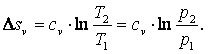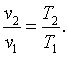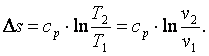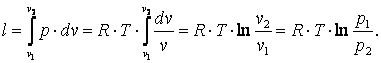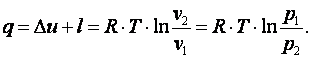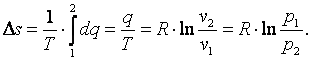- •1Техническая термодинамика
- •Тема 1. Основные термодинамические понятия и законы
- •1.1.Предмет и метод технической термодинамики
- •1.2.Термодинамическая система
- •1.3.Термодинамическое состояние и термодинамический процесс
- •1.4.Термические и калорические параметры состояния
- •1.4.1.Термические параметры состояния
- •1.4.2.Калорические параметры состояния
- •1.5.Законы идеальных газов
- •1.5.1.Закон Бойля-Мариота
- •1.5.2.Закон Гей-Люссака
- •1.5.3.Закон Авогадро
- •1.6.Уравнение состояния
- •1.7.Работа изменения объёма газа
- •Тема 2. Теплоёмкость газов
- •2.1.Массовая, объёмная и мольная удельные теплоёмкости
- •2.2.Средняя и истинная теплоёмкости
- •2.3.Теплоёмкости при постоянном объёме и давлении
- •2.4. Таблицы теплоёмкости
- •2.5.Теплоёмкость смеси рабочих тел (газовой смеси)
- •Тема 3. Первый закон термодинамики
- •3.1.Сущность первого закона термодинамики
- •3.2. Аналитическое выражение первого закона термодинамики для цикла и разомкнутого процесса
- •3.3. Уравнение первого закона термодинамики для движущегося рабочего тела
- •Тема 4. Термодинамические процессы
- •4.1.Схема анализа изменения состояния рабочего тела
- •4.2.Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
- •4.2.4.Адиабатный процесс
- •4.2.5. Политропный процесс
- •Тема 5. Второй закон термодинамики
- •5.1.Сущность и формулировки второго закона термодинамики
- •5.2.Обратимые и необратимые процессы
- •5.3.Круговые термодинамические процессы или циклы
- •5.4.Термический коэффициент полезного действия
- •5.5.Аналитическое выражение второго закона термодинамики
- •5.5.1.Цикл Карно
- •5.5.2.Соотношения, связанные с циклом Карно
- •5.6.Изменение энтропии в обратимых и необратимых процессах
- •Тема 6.Водяной пар
- •6.1.Основные понятия и определения
- •6.2.Схема парогенератора
- •6.3.Процесс парообразования в pv-координатах
- •6.4.Таблицы водяного пара
- •6.6.Процессы водяного пара на is-диаграмме
- •Тема 7. Тепловые двигатели
- •7.1.Классификация и принцип действия поршневых двигателей внутреннего сгорания
- •7.2.Цикл д. В. С. С подводом тепла при постоянном объёме (цикл Отто)
- •7.3.Цикл д. В. С. С подводом тепла при постоянном давлении (цикл Дизеля)
- •Тема 8. Паросиловые установки
- •8.1.Принципиальная схема паросиловой установки
- •8.2.Цикл Ренкина
- •8.3.Влияние параметров пара на термический к. П. Д. Цикла Ренкина
- •8.4.Пути повышения экономичности паросиловых установок
- •Тема 9. Теплопроводность
- •9.1.Основные понятия и определения
- •9.2.Закон Фурье
- •9.3.Коэффициент теплопроводности
- •9.4.Дифференциальное уравнение теплопроводности в плоской стенке при граничных условиях первого рода
- •9.4.1.Дифференциальное уравнение теплопроводности
- •9.4.2.Краевые условия
- •9.4.3.Теплопроводность через плоскую стенку при граничных условиях первого рода
3.3. Уравнение первого закона термодинамики для движущегося рабочего тела
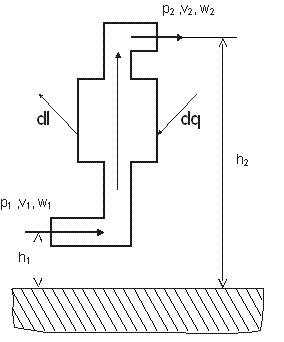
Уравнение первого закона для единицы массы стационарного потока (т. е. потока, параметры которого в любом сечении со временем не изменяются) можно вывести с помощью модели, показанной на рис. 3.2.
|
|
|
Рис. 3.2. К выводу уравнения первого закона термодинамики для движущегося рабочего тела |
|
|
(3.9) |
Так как по определению u+p*v=i, полученное выражение можно переписать следующим образом
|
|
|
|
|
(3.10) |
Выражение (3.10) и есть уравнение первого закона термодинамики для движущегося рабочего тела.
Тема 4. Термодинамические процессы
4.1.Схема анализа изменения состояния рабочего тела
При исследовании термодинамических процессов используются уравнение состояния идеальных газов и математическое выражение первого закона термодинамики.
При изучении термодинамических процессов идеальных газов требуется:
1) определить уравнение кривой процесса в pv-диаграмме;
2) установить связь между термодинамическими параметрами;
3) определить изменение внутренней энергии рабочего тела по формуле, справедливой для всех процессов идеального газа,
|
|
(4.1) |
4) определить величину внешней (термодинамической) удельной работы по формуле
|
|
(4.2) |
5) определить количество теплоты, участвующей в термодинамическом процессе, по формуле
|
|
(4.3) |
где cx– теплоёмкость процесса;
6) определить изменение энтальпии в термодинамическом процессе по формуле
|
h2-h1 = |
(4.4) |
7) определить изменение энтропии в термодинамическом процессе по формуле, справедливой для всех процессов идеального газа,
|
|
(4.5) |
В общем случае любые два термодинамических параметра из трех могут изменяться произвольно. Изучение работы тепловых машин показывает, что наибольший интерес для практики представляют следующие основные процессы: при постоянном объеме (V=const); при постоянном давлении (р=const); при постоянной температуре (Т=const); приdq=0(процесс, протекающий без теплообмена рабочего тела с окружающей средой); политропный процесс, который при определенных условиях можно рассматривать в качестве обобщающего по отношению ко всем основным процессам.
Чтобы получить обобщенные и простые формулы, уравнения первого закона термодинамики рассматриваются для 1 кг идеального газа.
4.2.Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
4.2.1.Изохорный процесс (v=const)
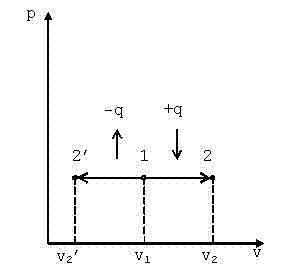
Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0илиv=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) приv=const. Вpv-координатах график процесса представляет собой прямую линию, параллельную осиp. Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’).
|
|
|
Рис. 4.1. График изохорного процесса в p-vкоординатах |
|
|
(4.6) |
Приращение внутренней энергии газа
|
|
(4.7) |
Работа газа
|
|
|
так как dv=0.
Энтальпия газа iv=u+p·v, а div=du+d(p·v)=du+p·dv+v·dp=du+v·dp. Поэтому
|
|
(4.8) |
Энтропия
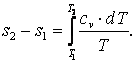
То есть
|
|
(4.9) |
4.2.2.Изобарный процесс (p=const)
В p-vкоординатах график процесса представляет собой прямую линию параллельную оси v (рис. 4.2). Изобарный процесс может протекать с увеличением объёма (процесс 1-2) и с уменьшением (процесс 1-2’). Запишем для точек 1 и 2 уравнения состояния:p·v1=R·T1;p·v2=R·T2.
|
|
|
Рис. 4.2. График изобарного процессав p-vкоординатах |
|
|
(4.10) |
Приращение внутренней энергии газа
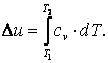 Работа
газа
Работа
газа
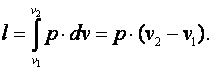 Так
какp·v2=R·T2,
аp·v1=R·T1, тоl=R·(T2-T1).
Следовательно, газовая постоянная имеет
определённый физический смысл: это
работа 1 кг газа в изобарном процессе
при изменении температуры на один
градус. Из выражения (4.3) следует, что в
изобарном процессеq=cp·(T2-T1).
В соответствии с первым законом
термодинамики для изобарного процесса
можно записатьdq=du+p·dv= du+d(p·v)=di.
Поэтому в изобарном процессеdi=q=cp·(T2-T1).
Из соотношений, характеризующих изобарный
процесс, вытекает известное уравнение
Майера. Так какdq=cp·dT=cv·dT+dl=cv·dT+R·dT,
тоR=cp-cv.
Так
какp·v2=R·T2,
аp·v1=R·T1, тоl=R·(T2-T1).
Следовательно, газовая постоянная имеет
определённый физический смысл: это
работа 1 кг газа в изобарном процессе
при изменении температуры на один
градус. Из выражения (4.3) следует, что в
изобарном процессеq=cp·(T2-T1).
В соответствии с первым законом
термодинамики для изобарного процесса
можно записатьdq=du+p·dv= du+d(p·v)=di.
Поэтому в изобарном процессеdi=q=cp·(T2-T1).
Из соотношений, характеризующих изобарный
процесс, вытекает известное уравнение
Майера. Так какdq=cp·dT=cv·dT+dl=cv·dT+R·dT,
тоR=cp-cv.
Используя выражение (4.5), можно показать, что в изобарном процессе энтропия газа
|
|
(4.11) |
4.2.3.Изотермический процесс (T=const)
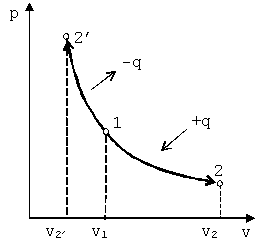
В p-vкоординатах график процесса изображается равнобокой гиперболой (рис. 4.3). Изотермический процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).
|
|
|
Рис. 4.3. График изотермического процесса в p-vкоординатах |
Приращение внутренней энергии газа
|
|
|
Работа газа
|
|
(4.12) |
Теплота, подводимая в процессе
|
|
(4.13) |
Изменение энтальпии газа Δi=Δu+Δ(p·v)=0.
Изменение энтропии газа
|
|
(4.14) |