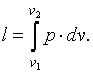- •1Техническая термодинамика
- •Тема 1. Основные термодинамические понятия и законы
- •1.1.Предмет и метод технической термодинамики
- •1.2.Термодинамическая система
- •1.3.Термодинамическое состояние и термодинамический процесс
- •1.4.Термические и калорические параметры состояния
- •1.4.1.Термические параметры состояния
- •1.4.2.Калорические параметры состояния
- •1.5.Законы идеальных газов
- •1.5.1.Закон Бойля-Мариота
- •1.5.2.Закон Гей-Люссака
- •1.5.3.Закон Авогадро
- •1.6.Уравнение состояния
- •1.7.Работа изменения объёма газа
- •Тема 2. Теплоёмкость газов
- •2.1.Массовая, объёмная и мольная удельные теплоёмкости
- •2.2.Средняя и истинная теплоёмкости
- •2.3.Теплоёмкости при постоянном объёме и давлении
- •2.4. Таблицы теплоёмкости
- •2.5.Теплоёмкость смеси рабочих тел (газовой смеси)
- •Тема 3. Первый закон термодинамики
- •3.1.Сущность первого закона термодинамики
- •3.2. Аналитическое выражение первого закона термодинамики для цикла и разомкнутого процесса
- •3.3. Уравнение первого закона термодинамики для движущегося рабочего тела
- •Тема 4. Термодинамические процессы
- •4.1.Схема анализа изменения состояния рабочего тела
- •4.2.Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
- •4.2.4.Адиабатный процесс
- •4.2.5. Политропный процесс
- •Тема 5. Второй закон термодинамики
- •5.1.Сущность и формулировки второго закона термодинамики
- •5.2.Обратимые и необратимые процессы
- •5.3.Круговые термодинамические процессы или циклы
- •5.4.Термический коэффициент полезного действия
- •5.5.Аналитическое выражение второго закона термодинамики
- •5.5.1.Цикл Карно
- •5.5.2.Соотношения, связанные с циклом Карно
- •5.6.Изменение энтропии в обратимых и необратимых процессах
- •Тема 6.Водяной пар
- •6.1.Основные понятия и определения
- •6.2.Схема парогенератора
- •6.3.Процесс парообразования в pv-координатах
- •6.4.Таблицы водяного пара
- •6.6.Процессы водяного пара на is-диаграмме
- •Тема 7. Тепловые двигатели
- •7.1.Классификация и принцип действия поршневых двигателей внутреннего сгорания
- •7.2.Цикл д. В. С. С подводом тепла при постоянном объёме (цикл Отто)
- •7.3.Цикл д. В. С. С подводом тепла при постоянном давлении (цикл Дизеля)
- •Тема 8. Паросиловые установки
- •8.1.Принципиальная схема паросиловой установки
- •8.2.Цикл Ренкина
- •8.3.Влияние параметров пара на термический к. П. Д. Цикла Ренкина
- •8.4.Пути повышения экономичности паросиловых установок
- •Тема 9. Теплопроводность
- •9.1.Основные понятия и определения
- •9.2.Закон Фурье
- •9.3.Коэффициент теплопроводности
- •9.4.Дифференциальное уравнение теплопроводности в плоской стенке при граничных условиях первого рода
- •9.4.1.Дифференциальное уравнение теплопроводности
- •9.4.2.Краевые условия
- •9.4.3.Теплопроводность через плоскую стенку при граничных условиях первого рода
1.5.Законы идеальных газов
1.5.1.Закон Бойля-Мариота
Бойль в 1662 году и Мариот в 1676 году
обнаружили, что при
![]()
![]() .
.
1.5.2.Закон Гей-Люссака
Гей-Люссак в 1802 году опытным путём
установил, что при
![]() ,v/T= const.
,v/T= const.
1.5.3.Закон Авогадро
В 1811 году Авогадро выдвинул гипотезу:
одинаковые объёмы различных газов при
одинаковых физических условиях содержат
одинаковые количества молекул. Эта
гипотеза, став после её доказательства
законом, приводит к одному важному
следствию, согласно которому при
одинаковых физических условиях для
любых газов произведение молекулярной
массы газа на его удельный объём есть
величина постоянная, т. е.
![]() .
.
Напомним, что молекулярной массой называется количество вещества в граммах, численно равное его молекулярной массе. Например, молекулярная масса углерода равна 12 граммам, а кислорода - 32 граммам.
Произведение
![]() представляет
собой объём одного моля газа, который
при нормальных физических условиях
равен 22,4 м3.
представляет
собой объём одного моля газа, который
при нормальных физических условиях
равен 22,4 м3.
Отметим, что нормальным физическим условиям соответствуют 760 мм рт. ст. и 00С, а нормальным техническим условиям - 735 мм рт. ст. и 100С.
1.6.Уравнение состояния
Сопоставление законов Бойля-Мариота и Гей-Люссака приводят к обобщённому закону Бойля-Гей-Люссака:
|
|
где R- характеристическая
постоянная идеального газа (при нормальных
физических условиях
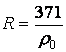
 ,
где
,
где
![]() -
плотность при нормальных физических
условиях).
-
плотность при нормальных физических
условиях).
Это уравнение, полученное Клапейроном в 1834 году, называется уравнением состояния идеальных газов или уравнением Клапейрона.
1.7.Работа изменения объёма газа
Выше отмечалось, что любое изменение состояния рабочего тела, которое происходит в результате его энергетического взаимодействия с окружающей средой, представляет собой термодинамический процесс. В общем случае энергообмен в термодинамическом процессе может осуществляться посредством работы Lлибо теплотыQ. Работа и теплота являютсяэнергетическими характеристикамитермодинамического процесса.
Механическая работа против внешних сил, связанная с изменением объема, определяется выражением
|
|
а удельная работа, т. е. работа, отнесенная к 1 кг вещества,— выражением
|
|
где
![]() —
абсолютное давление (потенциал
механического взаимодействия),
—
абсолютное давление (потенциал
механического взаимодействия),
![]() —
удельный объем (координата механического
взаимодействия).
—
удельный объем (координата механического
взаимодействия).
Для конечного процесса, при котором
объем изменяется от
![]() до
до
![]() ,
общее выражение удельной термодинамической
работы следует записать так:
,
общее выражение удельной термодинамической
работы следует записать так:
|
|
|
|
|
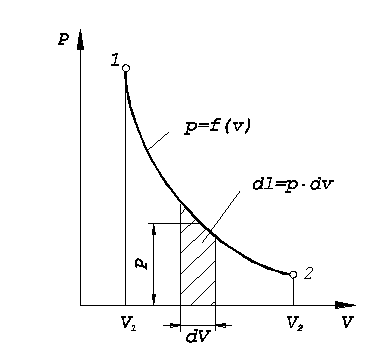
Рис. 1.2. К вычислению работы в термодинамическом процессе |
Очевидно, численно удельная работа
будет зависеть от характера кривой
процесса и изображается в
![]() -координатах
площадью, ограниченной кривой процесса,
двумя ординатами и осью абсцисс.
-координатах
площадью, ограниченной кривой процесса,
двумя ординатами и осью абсцисс.
При вычислении интеграла обнаруживается, что если объём рабочего тела уменьшается, то величина интеграла отрицательна, и наоборот. Поэтому если рабочему телу сообщается потенциальная энергия путём его сжатия, то работа изменения объёма есть величина отрицательная. Если же рабочее тело совершает работу расширяясь, то работа изменения объёма - положительна.

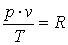 ,
,