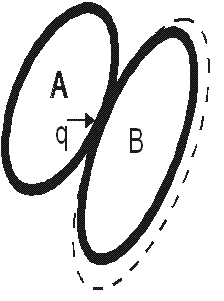- •1Техническая термодинамика
- •Тема 1. Основные термодинамические понятия и законы
- •1.1.Предмет и метод технической термодинамики
- •1.2.Термодинамическая система
- •1.3.Термодинамическое состояние и термодинамический процесс
- •1.4.Термические и калорические параметры состояния
- •1.4.1.Термические параметры состояния
- •1.4.2.Калорические параметры состояния
- •1.5.Законы идеальных газов
- •1.5.1.Закон Бойля-Мариота
- •1.5.2.Закон Гей-Люссака
- •1.5.3.Закон Авогадро
- •1.6.Уравнение состояния
- •1.7.Работа изменения объёма газа
- •Тема 2. Теплоёмкость газов
- •2.1.Массовая, объёмная и мольная удельные теплоёмкости
- •2.2.Средняя и истинная теплоёмкости
- •2.3.Теплоёмкости при постоянном объёме и давлении
- •2.4. Таблицы теплоёмкости
- •2.5.Теплоёмкость смеси рабочих тел (газовой смеси)
- •Тема 3. Первый закон термодинамики
- •3.1.Сущность первого закона термодинамики
- •3.2. Аналитическое выражение первого закона термодинамики для цикла и разомкнутого процесса
- •3.3. Уравнение первого закона термодинамики для движущегося рабочего тела
- •Тема 4. Термодинамические процессы
- •4.1.Схема анализа изменения состояния рабочего тела
- •4.2.Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
- •4.2.4.Адиабатный процесс
- •4.2.5. Политропный процесс
- •Тема 5. Второй закон термодинамики
- •5.1.Сущность и формулировки второго закона термодинамики
- •5.2.Обратимые и необратимые процессы
- •5.3.Круговые термодинамические процессы или циклы
- •5.4.Термический коэффициент полезного действия
- •5.5.Аналитическое выражение второго закона термодинамики
- •5.5.1.Цикл Карно
- •5.5.2.Соотношения, связанные с циклом Карно
- •5.6.Изменение энтропии в обратимых и необратимых процессах
- •Тема 6.Водяной пар
- •6.1.Основные понятия и определения
- •6.2.Схема парогенератора
- •6.3.Процесс парообразования в pv-координатах
- •6.4.Таблицы водяного пара
- •6.6.Процессы водяного пара на is-диаграмме
- •Тема 7. Тепловые двигатели
- •7.1.Классификация и принцип действия поршневых двигателей внутреннего сгорания
- •7.2.Цикл д. В. С. С подводом тепла при постоянном объёме (цикл Отто)
- •7.3.Цикл д. В. С. С подводом тепла при постоянном давлении (цикл Дизеля)
- •Тема 8. Паросиловые установки
- •8.1.Принципиальная схема паросиловой установки
- •8.2.Цикл Ренкина
- •8.3.Влияние параметров пара на термический к. П. Д. Цикла Ренкина
- •8.4.Пути повышения экономичности паросиловых установок
- •Тема 9. Теплопроводность
- •9.1.Основные понятия и определения
- •9.2.Закон Фурье
- •9.3.Коэффициент теплопроводности
- •9.4.Дифференциальное уравнение теплопроводности в плоской стенке при граничных условиях первого рода
- •9.4.1.Дифференциальное уравнение теплопроводности
- •9.4.2.Краевые условия
- •9.4.3.Теплопроводность через плоскую стенку при граничных условиях первого рода
2.4. Таблицы теплоёмкости
Данные о теплоёмкостях различных газов приводятся в табличной форме. Обычно в таблицах приводят для различных температур значения мольной истинной и средней теплоёмкости при постоянном давлении и постоянном объёме. Указывают также средние массовые и объёмные теплоёмкости при постоянном объёме и постоянном давлении.
Мольная теплоёмкость указывается в кДж/(кмоль · 0С), массовая – в кДж/(кг ·0С), объёмная – в кДж/(м3 ·0С). При этом значения объёмной теплоёмкости относят к массе газа, заключённой 1 м3 его при нормальных физических условиях.
Для газов, массовая теплоёмкость которых зависит как от температуры, так и от давления, приводят значения удельного объёма и энтальпии 1 кг газа при различных давлениях и температурах. С такого рода зависимостями приходится иметь дело при изучении свойств водяного пара.
2.5.Теплоёмкость смеси рабочих тел (газовой смеси)
Теплоемкость газовой смеси вычисляется по составу газовой смеси и теплоемкостям отдельных газов, входящих в данную газовую смесь. Газовая смесь может быть задана массовым, объемным и молярным составом. Пусть смесь газов задана массовым составом, тогда масса смеси
|
|
(2.10) |
где
![]() —
масса i-го компонента, входящего в смесь.
—
масса i-го компонента, входящего в смесь.
Очевидно, для увеличения температуры
газовой смеси на
![]() необходимо
увеличить температуру на
необходимо
увеличить температуру на![]() каждого
газа этой смеси. При этом на нагревание
каждого газа смеси необходимо затратить
количество теплоты
каждого
газа этой смеси. При этом на нагревание
каждого газа смеси необходимо затратить
количество теплоты![]() ,
где
,
где![]() —
массовая теплоемкость i-го газа смеси.
—
массовая теплоемкость i-го газа смеси.
Теплоемкость газовой смеси определяется из уравнения теплового баланса
|
|
где
![]() —
теплоемкость газовой смеси.
—
теплоемкость газовой смеси.
Разделив левую и правую части уравнения
на
![]() ,
получим
,
получим
|
|
(2.11) |
где
![]() —
массовая доля i-го газа, входящего в
смесь.
—
массовая доля i-го газа, входящего в
смесь.
Из выражения (2.11) видно, что теплоемкость смеси газов, заданной массовыми долями (массовая теплоемкость смеси), равна сумме произведений массовых долей на массовую теплоемкость каждого газа.
С помощью аналогичных рассуждений можно найти сходные по структуре с полученным выражением выражения для объёмной и мольной теплоёмкостей газовой смеси.
Тема 3. Первый закон термодинамики
3.1.Сущность первого закона термодинамики
Первый закон термодинамики является математическим выражением количественной стороны закона сохранения и превращения энергии в применении к термодинамическим системам. По этому закону теплота может превращаться в механическую работу или, наоборот, работа в теплоту в строго эквивалентных количествах.Это означает, что из данного количества теплоты в случае её полного превращения в работу получается строго определённое и всегда одно и то же количество работы, точно так же, как из данного количества работы при её полном превращении в тепло получается строго определённое и всегда одно и то же количество теплоты.
3.2. Аналитическое выражение первого закона термодинамики для цикла и разомкнутого процесса
Рассмотрим две системы: АиВ(рис. 3.1). Предположим, что системаАвзаимодействует с системойВтолько
в тепловом отношении. Пусть температура
системыАвыше температуры системыВ(TA>TB),
тогда разность температурTA-TBприведет к передаче теплоты от системыАк системеВ. Запишем уравнение
баланса энергии. Подводимая к системеВтеплота
![]() расходуется на изменение внутренней
энергии
расходуется на изменение внутренней
энергии
![]() и
на совершение всех видов работы
и
на совершение всех видов работы
![]() ,
то есть
,
то есть
|
|
|
Рис. 3.1. К выводу первого закона термодинамии |
|
|
(3.1) |
Если затрачивается бесконечно малое количество теплоты, при этом совершается бесконечно малая работа и будет бесконечно малым изменение внутренней энергии, то уравнение (3.1) можно записать в виде
|
|
(3.2) |
Так как нас интересует только механическая работа, совершаемая при изменении объёма рабочего тела, то естественно интересоваться только той частью подводимого к системе В тепла, которое расходуется на изменение внутренней энергии и на совершение механической работы изменения объёма рабочего тела. Поэтому запишем
|
|
(3.3) |
или
|
|
(3.4) |
Для 1 кг рабочего тела получим
|
|
(3.5) |
или
|
|
(3.6) |
Уравнения (3.5) и (3.6) являются математическим выражением первого закона термодинамики.
Для кругового процесса выражение первого закона термодинамики в интегральной форме запишется как
|
|
(3.7) |
Так как изменение внутренней энергии
термодинамической системы не зависит
от характера процесса и полностью
определяется её начальным и конечным
состояниями, то
![]() .
Следовательно, все количество теплоты,
подведенное к термодинамической системе
или отведенное от нее в таком процессе,
полностью расходуется на совершение
системой внешней работы
.
Следовательно, все количество теплоты,
подведенное к термодинамической системе
или отведенное от нее в таком процессе,
полностью расходуется на совершение
системой внешней работы
|
|
(3.8) |
То есть в круговом термодинамическом
процессе теплота и работа взаимопревращаются
в эквивалентных количествах. Если бы
оказалось, что
![]() ,
то можно было бы осуществить вечный
двигатель первого рода — двигатель,
который совершал бы работу без затраты
энергии.
,
то можно было бы осуществить вечный
двигатель первого рода — двигатель,
который совершал бы работу без затраты
энергии.
Таким образом, первый закон термодинамики, указывая на эквивалентность между теплотой и работой, свидетельствует о невозможности создания такой машины, которая бы производила работу, не затрачивая никакой энергии.

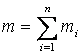 .
.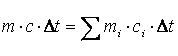 ,
,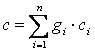 ,
,