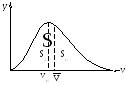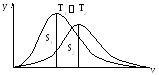- •Лекция №32. Основы молекулярно-кинетической теории.
- •I.Развитие представлений молекулярно-кинетической теории.
- •II.Термодинамические параметры.Масса и размеры молекул.
- •III.Статистические закономерности.Распределение Максвелла.Скорости молекул.
- •IV.Основное уравнение кинетической теории газов.
- •V.Число соударений между молекулами. Средняя длина свободного пробега молекул.
- •VI.Явление переноса.
III.Статистические закономерности.Распределение Максвелла.Скорости молекул.
В механике движение тела однозначно определяется заданными начальными условиями и силами, действующими на тело во время его движения. Такие явления описываются динамическими закономерностями.
В молекулярной физике рассматриваются явления, вызванные действием колоссального количества частиц (в 1см3газа при нормальных условиях 2,691019молекул). Каждая частица движется по своему пути с различной во времени скоростьюV. Рассчитать такой путь практически невозможно даже для отдельной молекулы. Для решения задач молекулярной физики, как уже говорилось, используютсястатистические закономерности.
В статистической физике рассматривается конкретная молекулярная модель и к ней применяются математические методы статистики, основанные на теории вероятности.
Статистические закономерности, в отличии от динамических, не определяются начальными условиями. Они не дают возможности вычислить какой-либо параметр, например, скорость в данный момент времени «меченой» молекулы, а позволяют вычислить, какой процент молекул газа при данной температуре имеют скорости, лежащие в интервале от Vдо (V+dV).
На основании теории вероятности Максвелл установил закономерность, по которой можно определить число молекул газа dN, скорости которых при данной температуре заключены в некотором интервале скоростей отVдо (V+dV).
dNdV
dN=ydV, (1)
где y=f(V) – называетсяфункцией распределения.
Максвелл вывел аналитическое выражение функции у:
![]() , (2)
, (2)
где N– общее число молекул газа;
Т – абсолютная температура;
V– скорость молекулы;
k– постоянная Больцмана;
m– её масса.
|
|
Если построить функцию распределения, то получим кривую Максвелловского распределения. Кривая Максвелла имеет max, которому соответствует скорость, называемаяневероятной скоростью Vн. Чтобы получить выражение Vн, надо взять первую производную от у поV(dy/dV) и приравнять её к нулю, тогда получим: |
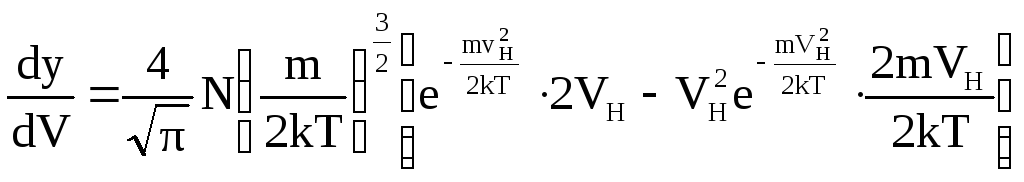 =0 (3)
=0 (3)
![]() (4)
(4)
Как видно из уравнений (2) и (4), конкретный вид кривой и величина Vнзависит лишь от массы молекулыmи температуры Т.
Площадь между кривой и осью Vпропорциональна общему числу молекулN.
Кривая Максвелла ассиметрична: правая часть кривой более полога чем левая, следовательно, площадь между пологоспадающей частью кривой и осью Vбольше, чем левая.Следовательно: в газе имеется большее число «быстрых» молекул со скоростями, превышающими наивероятнейшую, чем «медленных» молекул со скоростями, меньшимиVн.
|
|
Согласно уравнения (4), чем больше Т, тем больше Vн, тогда максимум кривой смещается вправо, т. е. с ростом температуры возрастает относительное число молекул, обладающих большими скоростями (т.к.S1=S2~ N). Ассиметрия кривой
Максвелла также означает, что
|
превышающими Vни следовательно![]() .
Решение Максвелловской функции у даёт:
.
Решение Максвелловской функции у даёт:
![]() (5)
(5)
Экспериментальная проверка закона распределения Максвелла была впервые осуществлена Отто Штерном в 1920 году, а затем Ламмертом в 1929.
Примеры: О2:![]() 500 м/с при Т = 3000К
500 м/с при Т = 3000К
Н2:![]() 2000 м/с при Т = 3000К
2000 м/с при Т = 3000К
Максвелловское распределение в системе молекул устанавливается всегда, если система приходит в равновесное состояние. Но оно является не единственным для систем частиц.
Существуют распределения:
а) Больцмана – распределение молекул по энергиям во внешнем поле;
б) Бозе-Эйнштейна – квантовое распределение молекул при низких температурах;
в) Ферми-Дирака – квантовое распределение для электронного газа (электронов в металле).