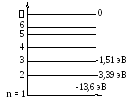Лекция №28. Строение атома. Введение.
Гипотеза о том, что все вещества состоят из огромного числа атомов, зародилась свыше 2000 лет тому назад (Демокрит, Лейкипп в Греции, Лукреций в Риме, Канада в Индии).
Атомы рассматривались как мельчайшие частицы вещества, которые не могут быть разложены на какие-либо составляющие. Греческое слово «атомос» означает неразложимый.
Сторонники атомистической теории считали, что все многообразие реального мира можно вывести из сочетаний неизменных частиц — атомов, т. е. видели в атомах «последнюю сущность» материи.
В середине века атомистическая теория имела мало сторонников. Однако уже в начале XVIII века было показано, что многим до того времени непонятным свойствам вещества удается дать объяснение в рамках атомистической гипотезы, исходя из общих законов механики. М. В. Ломоносов, наиболее полно развивший в свое время атомно-кинетическую теорию вещества, показал, что тепловые явления, а также способность газов заполнять предоставленный им объем обусловлены движением атомов.
В развитии атомистической теории выдающуюся роль сыграл Д.И. Менделеев, разработавший периодическую систему элементов. Периодическая закономерность в свойствах атомов различных элементов свидетельствует о некоей общности в их природе. По существу, Менделеев, открыв периодическую систему элементов, впервые на научной основе поставил вопрос о единой природе атомов.
Во второй половине XIX века стали накапливаться факты, показывающие, что атомы имеют сложное строение. Было обнаружено существование элементарного электрического заряда – электрона – и было показано, что электроны являются составной частью атомов.
Крупнейшие достижения современной атомной науки, техники и энергетики есть результат интенсивного развития атомной и ядерной физики. Не будет преувеличением, если мы скажем, что современная атомная и ядерная физика является основой учения о строении вещества. Больше того, не только вещество (газы, жидкости, твердые тела), но и электричество, свет и другие виды материи имеют атомистическую природу. Равным образом и движение материи определяется атомистическими законами. Из сказанного следует бесспорный вывод, что атомистическое учение о строении и движении материи является господствующим учением в современной физике.
Современная атомная и ядерная физика с особой остротой выдвигает перед учеными важнейшие философские проблемы, которые в конкретной форме проявляются в самых различных разделах учения об атоме и ядре.
Здесь следует в первую очередь назвать проблему прерывности и непрерывности материи, дуализм волн и частиц, взаимопревращаемость частиц из одних форм в другие. Все это с особой силой выражает то, что материя есть единство противоположностей. Важнейшей проблемой является также проявление всеобщей связи и взаимодействия в атомной и ядерной физике. Конкретно это сводится к проблеме взаимодействия частиц, соотношению частиц и полей, материальности пространства, проблеме электронно-позитронного вакуума и т.д.
I.Строение атома по Резерфорду-Бору.
До 1911 года широким признанием пользовалась модель английского физика Томсона, согласно которой внутри сферы размером 10-8 см равномерно распределен положительный заряд и находятся электроны, которые колеблясь около положений равновесия излучают электромагнитные волны. Суммарный отрицательный заряд равен положительному заряду сферы.
|
|
Основой современных представлений о строение атома явились опыты Резерфорда по рассеянию – частиц, в результате которых в 1911 году была предложена планетарная модель атома. Положительный заряд находится в ядре, где находится вся масса атома, а вокруг ядра по орбитам движутся электроны, которые не излучают энергию. |
Заряд ядра равен Z(числу электронов в атоме), умноженному на его заряд |е|. Чтобы объяснить устойчивость атома датский физик Нильс Бор постулировал основные положения (постулаты Бора), которые явили собой первую квантовую модель атома.
Постулаты Бора:
Электроны в атоме движутся по некоторым стационарным орбитам без излучения.
Стационарными орбитами будут те, для которых момент количества движения электрона mνnrnравен целому кратному величины
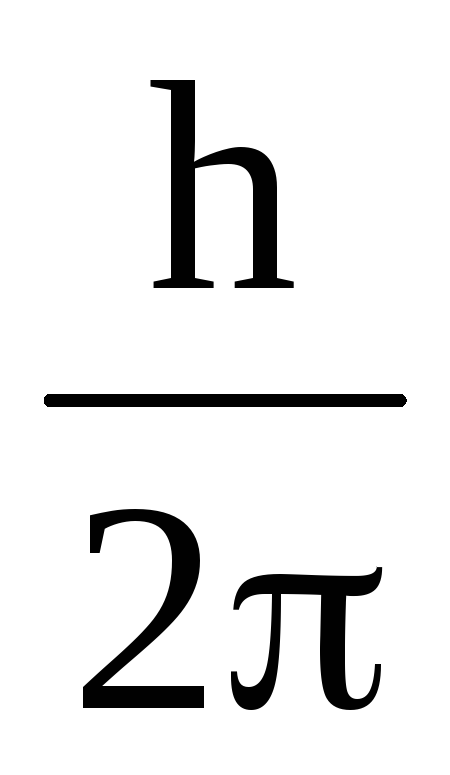 :
:
![]() , (1)
, (1)
где n= 1,2,3…– главное квантовое число (номер орбиты-уровня);
h= 6,62·10-34 Дж·с – постоянная Планка;
rn– радиусnойорбиты;
vn– скорость электрона на орбите.
При переходе электрона с одной стационарной орбиты на другую происходит поглощение или испускание фотона (кванта энергии):
Е2– Е1=Е =h(2)
Величина кванта =h зависит от того, с какой на какую орбиту перешел электрон.
Используя постулаты Бора, закон Кулона и вращение электрона по круговой орбите, можно рассчитать величину радиуса орбиты rnи скорость электрона на нейvn:
![]() (3)
(3)
![]() , (4)
, (4)
где m– масса электрона;
ε0– электрическая постоянная:
z– порядковый номер элемента;
е – заряд ядра.
Полная энергия Е орбитального электрона равна сумме его кинетической и потенциальной энергий:
Еn= Екинn+ Епотn
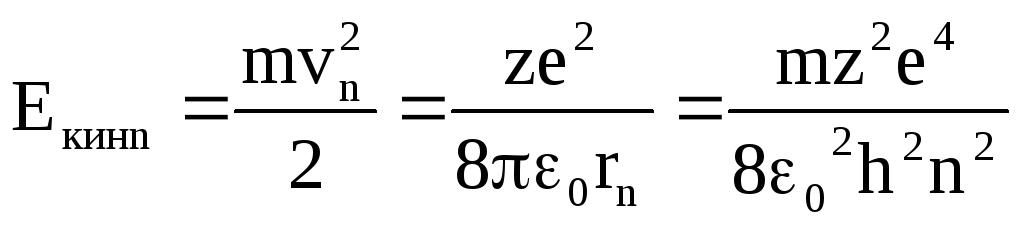
![]()
![]() (5)
(5)
Согласно уравнения (5) полная энергия электрона в атоме – величина отрицательная (Еn<0), т.е. электроны в атоме движутся как в потенциальной яме.
Электроны, находясь на стационарных орбитах, обладают потенциальной энергией, максимальная величина которой будет , то есть будет соответствовать ионизованному атому. Там она будет равна нулю, следовательно, потенциальная энергия электрона в атоме отрицательна.
|
|
Орбитам, на которых находится электрон, соответствует вполне определенная энергия – энергетические уровни атома. Для атома водорода их значения могут быть примерно рассчитаны по уравнению:
|
Используя третий постулат Бора и выражение для полной энергии (5), получим уравнение для вычисления набора длины волны, т.е. спектров атома:
![]()
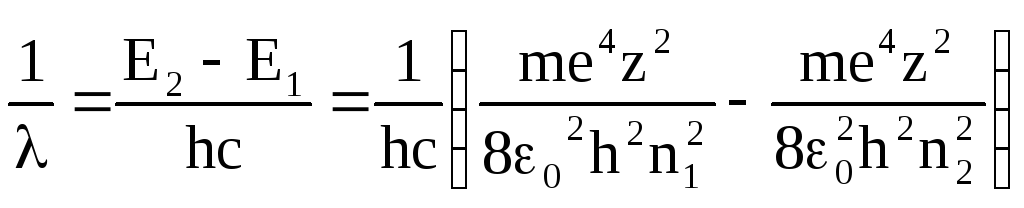 (7)
(7)
![]()
|
Постоянная Ридберга |
|
Иоганес Роберт – шведский физик – основные работы посвящены систематике атомных спектров и атомной физике.
Преобразуя уравнение (6), получаем:
|
Сериальная формула водородоподобных атомов |
|
Для водорода z= 1, тогда получим формулу, впервые эмпирически полученную швейцарским физиком Бальмером:
![]() , (9)
, (9)
где n1иn2– номера орбит на которую и с которой переходит электрон;
![]() –волновое число, выражающее
число длин волн, укладывающихся на
единицу длины.
–волновое число, выражающее
число длин волн, укладывающихся на
единицу длины.