
Принципы равновесия Гиббса
Для k-компонентной r-фазной системы при постоянстве ее внутренней энергии U, объема V и чисел молей компонентов ni (i = 1, 2, ..., k) условие термодинамического равновесия заключается в том, что при всех возможных изменениях параметров состояния энтропия 5 системы остается неизменной или уменьшается. Иными словами, энтропия изолированной системы при термодинамическом равновесии имеет условный максимум:
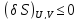
Буква
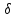 означает бесконечно малую вариацию
величины, в т.ч. флуктуацию, в отличие
от знака дифференциала, означающего
действительно малое изменение величины
в реальном процессе. Знак равенства
имеет место при протекании в системе
обратимых процессов, знак неравенства
необратимых (в случае изолированные
системы). Принцип равновесия можно
выразить также через термодинамические
потенциалы, внутреннюю энергию U,
энтальпию H, энергию Гиббса G, энергию
Гельмгольца F-при условиях, характеризуемых
постоянством соответствующих параметров
состояния. Термодинамическому равновесию
отвечает условный минимум термодинамических
потенциалов:
означает бесконечно малую вариацию
величины, в т.ч. флуктуацию, в отличие
от знака дифференциала, означающего
действительно малое изменение величины
в реальном процессе. Знак равенства
имеет место при протекании в системе
обратимых процессов, знак неравенства
необратимых (в случае изолированные
системы). Принцип равновесия можно
выразить также через термодинамические
потенциалы, внутреннюю энергию U,
энтальпию H, энергию Гиббса G, энергию
Гельмгольца F-при условиях, характеризуемых
постоянством соответствующих параметров
состояния. Термодинамическому равновесию
отвечает условный минимум термодинамических
потенциалов:
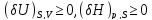
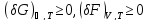
Переход системы из одного состояния термодинамического равновесия в другое может происходить через последовательность состояний, каждое из которых является также состоянием термодинамического равновесия. Это означает, что параметры состояния в течение всего процесса перехода бесконечно мало отличаются от своих значений при термодинамическом равновесии. Это - равновесный (квазистатический) процесс. Реальные процессы перехода всегда неравновесны; они изучаются химической термодинамикой.
Наряду с основным (глобальным) максимумом энтропии и минимумами термодинамических потенциалов, отвечающими стабильному термодинамическому равновесию, в пространстве параметров состояния возможны локальные максимумы энтропии и минимумы термодинамических потенциалов. Соответствующие им состояния системы наз. метастабильными равновесиями. Такие состояния, как и состояние стабильного термодинамического равновесия, локально устойчивы, т.е. устойчивы к бесконечно малым изменениям параметров состояния. Но метастабильные состояния термодинамического равновесия могут быть неустойчивыми при некоторых конечных изменениях параметров.
Под локальным термодинамическим равновесием в термодинамике неравновесных процессов подразумевается равновесие в очень малых (элементарных) объемах среды, содержащих все же достаточное число частиц (атомов, молекул, ионов), чтобы состояние этих объемов можно было характеризовать температурой, давлением, химическим потенциалом и др. термодинамическими потенциалами, но не постоянными, а зависящими от координат и времени. При локальном термодинамическом равновесии элементарных объемов состояние системы в целом неравновесное [7].
Расчет ликвидуса в системах SiO2 и p2o5
Метод Шредера – Ле – Шателье
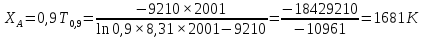
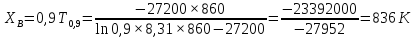
В таблице 2.1 представлены данные расчета по методу Шредера – Ле – Шателье.
Таблица 2.1- Данные расчета по методу Шредера – Ле – Шателье
|
SiO2, мол. % |
Тликв, К |
Р2О5, мол. % |
Тликв, К |
|
80 |
1426 |
80 |
812 |
|
70 |
1217 |
70 |
786 |
|
60 |
1040 |
60 |
758 |
|
50 |
888 |
50 |
727 |
|
40 |
753 |
40 |
693 |
|
30 |
630 |
30 |
653 |
Метод Эпстейна – Хоуленда
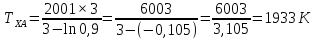

На рисунке 2.1 изображена диаграмма состояния SiO2 и P2O5 рассчитанная по методу Шредера – Ле – Шателье.
Рисунок 2.1 -Диаграмма состояния SiO2 и P2O5 рассчитанная по методу Шредера – Ле – Шателье
В таблице 2.2 представлены данные расчета по методу Эпстейна – Хоуленда.
Таблица 2.2 - Данные расчета по методу Эпстейна – Хоуленда
|
SiO2, мол. % |
Тликв, К |
Р2О5, мол. % |
Тликв, К |
|
80 |
1862 |
80 |
833 |
|
70 |
1788 |
70 |
818 |
|
60 |
1710 |
60 |
801 |
|
50 |
1625 |
50 |
782 |
|
40 |
1532 |
40 |
760 |
|
30 |
1429 |
30 |
734 |
На рисунке 2.2 изображена диаграмма состояния SiO2 и P2O5 рассчитанная по методу Эпстейна – Хоуленда.
Рисунок 2.2 - Диаграмма состояния SiO2 и P2O5 рассчитанная по методу Эпстейна – Хоуленда
