
2.2 Правило фаз Гиббса, правило рычага
2.2.1 Правило фаз Гиббса
Фазу определяют как однородную часть (однородность по составу и физическому состоянию) гетерогенной системы, отделенную от других частей поверхностью раздела.
Система характеризуется термодинамической степенью свободы или вариантностью – это число параметров, которые можно независимо менять, не меняя при этом числа и вида фаз данной системы, т.е. не нарушая равновесное состояние системы.
Одним из самых общих законов физической химии является закон равновесия фаз или правило фаз Гиббса. Правило фаз основано на 2 законе термодинамики и относится к системам, находящимся в равновесии.
Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов минус число фаз плюс 2:
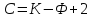
Цифра 2 обозначает, что на систему действует два внешних параметра – давление и температура. Если один из параметров постоянный, число уменьшается на единицу.
Система классифицируется:
По числу фаз: однофазные, двухфазные, трехфазные и т.д.;
По числу независимых компонентов: однокомпонентные, двухкомпонентные (двойные), тройные т.д.;
По числу степеней свободы: инвариантные (нонвариантные, безвариантные С=2), моновариантные (одновариантные С=1), дивариантные (С=2), тривариантные (С=3) и т.д. [4].
2.2.2 Правило рычага
Если одна фаза распадается на две фазы, то соотношение между ними обратно пропорционально отрезкам, соединяющим состав исходной фазы с составами полученных фаз:
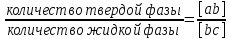
Левая
часть представляет собой соотношение
между количеством твердой и жидкой фаз
при температуре Т1
,
а в правой части – [ab]
– отрезок от состава исходной до состава
полученной жидкой фазы (пересечение
конноды с ликвидусом), [bc]
– отрезок состояния исходной до состояния
полученной твердой фазы (пересечение
конноды с солидусом). Использовав в
качестве второго уравнения
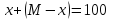 производят количественные расчеты
полученных фаз.
производят количественные расчеты
полученных фаз.
При построении кривых охлаждения необходимо учитывать следующие правила:
на кривой охлаждения чистого вещества (А,В и химическое соединение) присутствует горизонтальная площадка, соответствующая температуре плавления этого вещества;
на кривой охлаждения эвтектического или перитектического сплава присутствует горизонтальная площадка, соответствующая температуре эвтектики или температуре перитектики соответственно;
на кривой охлаждения сплава А с B наблюдается перегиб, соответствующий точке пересечения пути кристаллизации с линией ликвидуса и горизонтальная площадка, соответствующая температуре эвтектики;
на кривых охлаждения будут присутствовать только перегибы, соответствующие пересечению с линиями на пути кристаллизации, если путь не проходит через эвтектическую линию или эвтектика не диаграмме отсутствует.
Наклон линии свидетельствует о скорости набора или падения температуры [4].
2.3 Классификация видов равновесия
Термодинамические системы можно разделить на 2 группы:
Системы, в которых не протекают обратимые химические реакции;
Системы, в которых протекают обратимые химические реакции.
В первом случае равновесие (фазовое) устанавливается за счет перераспределения масс компонентов между отдельными фазами. Во втором случае достижение равновесия (химического), помимо указанного, связано с течением химической реакции. Равновесия в гетерогенных системах, в которых не происходит химического взаимодействия между компонентами, а имеют место лишь фазовые переходы (процесс перехода компонентов из одной фазы в другую), называются фазовыми равновесиями.
Равновесное состояние термодинамической системы называют устойчивым (стабильным), если любое бесконечно малое воздействие на нее вызывает бесконечно малое изменение состояния, а при устранении этого воздействия система возвращается в исходное состояние. Если при бесконечно малом воздействии происходит конечное изменение состояния - это неустойчивое (лабильное) равновесие. Для термодинамических систем неустойчивость равновесия означает его отсутствие, так как малые вариации состояний таких систем происходят самопроизвольно в связи с флюктуациями физических параметров.
Равновесное состояние термодинамической системы должно определяться совокупностью внешних и внутренних параметров. Если система переходит из одного состояния в другое, то в процессе перехода изменяются как внешние параметры, характеризующие окружающую среду, так и внутренние, характеризующие изучаемую систему. Для характеристики конкретных условий, в которых находится данная система (вещество), или процесса, идущего в системе, необходимо, прежде всего, знать такие распространенные внутренние параметры, как абсолютное давление, абсолютная температура, удельный объем или плотность.
Равновесное состояние термодинамической системы характеризуется при постоянных внешних условиях неизменностью параметров во времени и отсутствием стремления к самопроизвольному изменению состояния.Следовательно, переход из одного стабильного или метастабильного равновесного состояния термодинамической системы в другое проходит две стадии: стадию активируемого состояния и стадию самопроизвольного неактивируемого изменения состояния.
Важное значение имеет утверждение термодинамики о том, что равновесное состояние термодинамической системы, а, следовательно, и значения макроскопических свойств системы в состоянии равновесия вполне определяются ее внешними параметрами и температурой.
Равновесным (квазиравновесным, квазистатическим) называется процесс, состоящий из непрерывной последовательности равновесных состояний термодинамической системы.
По аналогии с первым и вторым началами термодинамики, каждое из которых (как это будет показано в последующем) устанавливает существование определенной величины - функции равновесного состояния термодинамической системы.
Второй закон термодинамики представляет собой ряд положений, относящихся к различным состояниям и процессам в термодинамической системе. Равновесным состоянием термодинамической системы называют состояние, при котором параметры состояния неизменны при неизменных внешних условиях.
