
echma_2011 (1)
.pdfТомский государственный университет Методическое пособие
Электрохимические методы анализа
В. В. Шелковников, В. Н. Баталова, А. Г. Зарубин
Томск 2011
Содержание |
|
Введение ................................................................................................. |
4 |
1. Потенциометрия и потенциометрическое титрование ............. |
5 |
1.1. Классификация электродных систем ........................................ |
8 |
1.1.1. Электроды I рода................................................................ |
9 |
1.1.2. Электроды II рода ............................................................ |
11 |
1.1.3. Окислительно-восстановительные электроды............. |
13 |
1.1.4. Ионоселективные электроды .......................................... |
14 |
1.2. Потенциометрическое титрование .......................................... |
17 |
1.2.1. Окислительно-восстановительные реакции .................. |
18 |
1.2.2. Реакции осаждения .......................................................... |
21 |
1.2.3. Реакции нейтрализации.................................................... |
22 |
1.3. Методы определения точки эквивалентности........................ |
23 |
1.3.1. Графические методы ....................................................... |
23 |
1.3.2. Дифференциальные методы ............................................ |
24 |
1.3.3. Метод Грана ..................................................................... |
25 |
1.4. Лабораторные работы .............................................................. |
26 |
1.4.1. Аппаратура и техника потенциометрических измерений |
|
...................................................................................................... |
26 |
1.4.2. Потенциометрическое титрование............................... |
29 |
1.4.2.1. Лабораторная работа 1.Определение цинка в |
|
контрольном растворе |
29 |
1.4.2.2. Лабораторная работа 2. Определение ионов Fe2+ в |
|
контрольном растворе |
32 |
1.4.2.3. Лабораторная работа 3. Потенциометрическое |
|
титрование со стеклянным электродом.Определение соды в |
|
контрольном растворе |
34 |
2. Кондуктометрические методы анализа...................................... |
37 |
2.1. Теоретические основы кондуктометрического метода анализа |
|
........................................................................................................... |
37 |
2.2. Зависимость электропроводности от экспериментальных |
|
параметров........................................................................................ |
40 |
2.3. Кондуктометрическое титрование .......................................... |
43 |
2.3.1. Реакции нейтрализации.................................................... |
44 |
2.3.2. Реакции осаждения .......................................................... |
49 |
2.3.3. Реакции комплексообразования ....................................... |
49 |
2.4. Особенности кондуктометрических методов анализа........... |
52 |
2.5. Лабораторные работы .............................................................. |
53 |
2
2.5.1. Аппаратура и техника кондуктометрических измерений
.................................................................................................... |
533 |
2.5.2. Порядок измерения сопротивления на приборе Р-38... |
544 |
2.5.3. Порядок измерения электропроводности на приборе |
|
«Мультитест КСЛ»................................................................. |
555 |
2.5.4. Математическая обработка данных |
|
кондуктометрического титрования ...................................... |
566 |
2.5.5.Кондуктометрическое титрование. |
|
2.5.5.1 Лабораторная работа 4. Определение |
|
хлороводородной кислоты ....................................................... |
577 |
2.5.5.2. Лабораторная работа 5. Определение сульфат-ионов |
|
методом осадительного титрования .................................... |
599 |
3. Основные закономерности электрохимической кинетики .. |
622 |
3.1. Основные понятия электрохимической кинетики ............... |
633 |
3.1.1. Ток .................................................................................... |
634 |
3.1.2. Стадии электрохимического процесса......................... |
644 |
3.1.3. Омическое падение напряжения ................................... |
655 |
3.1.4. Перенапряжение (поляризация)..................................... |
656 |
3.1.5. Обратимые и необратимые электрохимические |
|
процессы .................................................................................... |
677 |
4. Амперометрические методы анализа ....................................... |
699 |
4.1. |
|
4.2. |
|
4.3. |
|
4.3.1.Амперометрическое титрование. |
|
4.3.1.Лабораторная работа 6. Амперометрическое |
|
титрование с двумя поляризованными электродами. |
|
Определение йода...................................................................... |
777 |
5. Кулонометрия ............................................................................. |
8080 |
5.1. Кулонометрия при постоянном токе....................................... |
81 |
5.1.1. Индикация точки эквивалентности ............................... |
85 |
5.1.2. Преимущества кулонометрического титрования ........ |
87 |
5.1.3. Аппаратура и техника кулонометрических измерений 87 |
|
5.1.4.Лабораторные работы |
88 |
5.1.4.1.Лабораторная работа 7. Кулонометрическое |
|
титрование. Определение тиосульфата с помощью |
|
электрогенерирован-ного иода ................................................ |
888 |
5.1.4.2. Лабораторная работа 8. Определение фенола с |
|
помощью электрогенерированного брома |
90 |
Литература .......................................................................................... |
95 |
3
Приложение ......................................................................................... |
97 |
Введение
Электрохимические методы – это методы качественного и количественного анализа веществ, основанные на электрохимических явлениях в исследуемой среде или на границе соприкасающихся фаз и связанные с изменением структуры, химического состава или концентрации. В зависимости от измеряемого параметра в современной электрохимии выделяют следующие группы методов:
потенциометрия и потенциометрическое титрование (методы, основанные на измерении потенциала электрода);
кондуктометрические методы (измерение электропроводности);
кулонометрические методы (определение концентрации по количеству электричества);
электрогравиметрия (выделение вещества на электроде в процессе электролиза);
вольтамперометрические методы (определение вещества по величине тока).
Электрохимические методы являются не только методами анализа, но и методами физико-химического исследования. Благодаря им можно изучать термодинамические равновесия, кинетику и механизм протекания химических и электрохимических реакций, строение и состав неорганических и органических соединений. В качестве аналитических методов электрохимические методы используют при анализе различных объектов (экология, медицина, промышленность, технология и т. д.).
Материал данного учебно-методического пособия излагается на основе опыта авторов по преподаванию курса «Физико-химические методы анализа» студентам III курса химического факультета. Учебное пособие включает теоретические основы электрохимических методов анализа и исследования, лабораторный практикум, задания для самоподготовки и тестирующий модуль.
4

1. Потенциометрия и потенциометрическое титрование
Потенциометрический метод анализа основан на измерении практически в отсутствии тока электродного потенциала, возникающего между двумя электродами в гальванической цепи
электрод сравнения║исследуемыйраствор║индикаторный электрод,
и нахождении зависимости между его величиной и активностью потенциалопределяющих компонентов в растворе. Используя эту зависимость, можно определить не только активность ионов, но и ряд физико-химических характеристик: констант ионизации слабых кислот и оснований, констант устойчивости комплексных соединений, произведения растворимости малорастворимых веществ, стандартные и формальные окислительновосстановительные потенциалы и др.
Возникновение электродного потенциала связано с электрохимическим процессом, происходящим на границе раздела фаз электрод – раствор. Например, при опускании платинового электрода в раствор, содержащий какую-либо окислительновосстановительную пару, на границе раздела фаз протекает реакция:
Ox + ze Red.
Аналогичная реакция будет протекать и в системе металл, опущенный в раствор соли, содержащей одноименный ион:
Mz+ + zeM0.
Когда скорости отдачи и присоединения электронов компонентами Red/Ox пары становятся равными, вся система приходит к динамическому равновесию, а индикаторный электрод приобретает равновесный потенциал.
Условием равенства двух соприкасающихся фаз является равенство их потенциалов:
5

α β (1.1)
Если происходит обмен заряженных частиц, то условие равновесия характеризуется равенством электрохимических потенциалов:
α β . (1.2)
Так как химический потенциал равен
α α0 RT ln aα ,
а электрохимический потенциал
α α zFEα ,
где zFEα – работа против сил поля, которую нужно совершить, чтобы перенести заряженную частицу из объема в фазу α с потенциалом Eα .
Из условия равенства электрохимических потенциалов (1.2) и учитывая величины соответствующих химических потенциалов,
получаем: |
RT ln a |
zFE |
|
RT ln a |
zFE . (1.3) |
0 |
0 |
||||
α |
α |
α |
β |
β |
β |
Если за скачок потенциала между двумя фазами принять разность потенциалов двух фаз:
E Eα Eβ ,
где E – равновесный потенциал, то уравнение (1.3) примет вид:
|
|
|
|
β0 |
|
α0 |
|
|
RT |
|
a |
|
|||
|
|
E |
|
|
|
|
|
|
|
|
ln |
α |
. |
||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
zF |
|
|
zF |
|
a |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
β |
||
|
|
0 |
0 |
|
|
|
|
|
|
|
|
|
|||
Так как величина |
|
β |
|
α |
|
постоянная для данной системы, то ее |
|||||||||
|
|
zF |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
можно обозначить новой константой E0, в результате получим |
|||||||||||||||
выражение, которое носит название уравнения Нернста: |
|||||||||||||||
|
|
|
|
|
|
|
RT |
|
|
|
a |
|
|
|
|
E |
|
|
E0 |
|
|
|
ln |
Ox |
, |
(1.4) |
|||||
инд. |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
zF |
|
|
aRed |
|
|
|||
где E0 – стандартный электродный потенциал; R – универсальная газовая постоянная;
T – температура, К;
6
F – постоянная Фарадея;
z – число участвующих в электродном процессе электронов; aOx и aRed – активности окисленной и восстановленной форм
ионов в растворе.
Переходя от натуральных логарифмов к десятичным и объединяя в уравнении (1.4) все постоянные величины, получим (при температуре 25ºС):
|
|
0,059 |
a |
|
|
|
E |
E0 |
|
lg |
Ox |
. |
(1.5) |
|
|
|||||
инд. |
|
|
|
|
|
|
|
|
z |
aRed |
|
||
Абсолютную величину электродного потенциала измерить нельзя, поэтому для оценки ее относят к потенциалу электрода сравнения, при этом измеряемый потенциал гальванического элемента будет равен
Eгал.эл. Eинд Eср . |
(1.6) |
Величину электродного потенциала определяют все компоненты окислительно-восстановительных пар, находящиеся в растворе: молекулы или ионы окислителя и восстановителя, молекулы растворителя, газообразные вещества и компоненты, находящиеся в твердой фазе. При этом в уравнении Нернста не фигурируют те компоненты, активность которых постоянна или равна единице. К таким компонентам относятся: твердая фаза, газообразное вещество (если им насыщен раствор при давлении 1 атм.), а также растворитель из-за его большой концентрации, мало изменяющейся в результате протекания реакции.
По назначению потенциометрические методы анализа можно классифицировать как прямая потенциометрия (ионометрия) и потенциометрическое титрование.
Метод прямой потенциометрии основан на измерении точной величины электродного потенциала с использованием ионоселективных электродов и нахождении зависимости между его величиной и активностью потенциалопределяющих ионов в растворе. К ионометрии относятся рН-метрия, катионометрия и анионометрия. Нахождение активности потенциалопределяющих ионов проводится по уравнению Нернста (1.5), по градуировочному графику, построенному по результатам измерения потенциалов стандартных растворов различных концентраций (рис. 1.1) или по методу стандартных добавок.
7
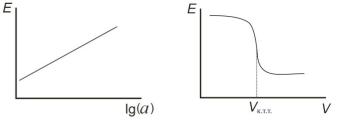
Рис. 1.1. Градуировочный график |
Рис. 1.2. Кривая потенциометрического |
|
титрования |
Потенциометрическое титрование основано на наблюдении за изменением равновесного потенциала электрода в процессе химической реакции между потенциалопределяющим компонентом в растворе и титрантом. По результатам измерения потенциала от объема добавленного титранта строят кривую титрования, на которой по резкому изменению потенциала (скачку потенциала) находят конечную точку титрования (рис. 1.2) и по закону эквивалентов рассчитывают концентрацию определяемого компонента.
1.1. Классификация электродных систем
Определить абсолютное значение потенциала невозможно. Потенциал отдельного электрода может быть измерен лишь по отношению к потенциалу другого электрода – электрода сравнения. В качестве электродов сравнения чаще всего используют идеально неполяризующиеся электроды, потенциал которых можно воспроизвести многократно с достаточной точностью. Это достигается обычно при постоянстве условий протекания электродной реакции и создании чрезвычайно развитой поверхности электрода.
В качестве электродов сравнения используют нормальный водородный электрод (потенциал НВЭ принят равным нулю при любых температурах), насыщенный каломельный, хлоридсеребряный, сернистосеребряный, сернистортутный и др.
Для проведения потенциометрических определений в паре с электродом сравнения используют индикаторный электрод. Индикаторный электрод реагирует на изменение концентрации (активности) ионов определяемого вещества, титранта или
8

образующихся продуктов в растворе и заменяет собой индикатор при обычном титровании. Выбор индикаторного электрода зависит от типа реакций, лежащих в основе титрования. При этом потенциал электрода должен устанавливаться практически мгновенно при изменении активности потенциалопределяющих ионов и не должен зависеть от присутствия других ионов в растворе.
Все электродные системы разделяют на электроды I рода, II рода, III рода, окислительно-восстановительные и ионоселективные (мембранные).
1.1.1.Электроды I рода
Кэлектродам I рода относятся системы, в которых потенциалопределяющие ионы принимают непосредственное участие в электродной реакции с образованием электроактивного
продукта:
Mz+ + ze = M0,
где M – металл, металлоид, газ.
Металлические электроды представляют собой металл, погруженный в раствор своей соли, например Cu2+/Cu0, Ag+/Ag0. Для таких электродов потенциал зависит только от активности ионов металла в растворе:
EEA0g /Ag0 RTF ln aAg
Вкачестве металлических электродов можно использовать металлы, стоящие в ряду напряжений после водорода. У неблагородных металлов на поверхности образуется оксидная или гидроксидная пленка, поэтому потенциал таких электродов зависит не только от активности металла, но и от рН раствора. Для предотвращения покрытия металла оксидной пленкой его растворяют в ртути.
Амальгамные электроды представляют собой металлы,
растворенные в ртути, погруженные в растворы, содержащие ионы данного металла Mz+/M0,Hg. В качестве амальгамных могут быть использованы все металлы, растворимые в ртути, например, Zn, Cd, Sn, Pb, Tl и др. Электродная реакция и уравнение Нернста для амальгамных электродов (на примере цинкового амальгамного электрода) имеют вид:
9

Zn2+ + 2 e + Hg = Zn(Hg),
|
0 |
|
|
RT |
aZn2 aHg0 |
|
|
E E |
2 |
/Zn |
0 |
|
ln |
|
|
|
|
||||||
|
Zn |
|
2F |
|
aZn(Hg) |
|
|
|
|
|
|
|
|
||
Так как активность чистой ртути равна 1, а активность металла в разбавленной амальгаме величина постоянная, уравнение Нернста при 25°С примет вид:
E E'0 |
|
0,059 |
lg a |
|
|
|
|
2 |
|
||||
ам |
2 |
|
Zn |
|
||
|
|
|
|
|
||
Металлоидные электроды – системы, содержащие металлоид, погруженный в раствор с анионами данного металлоида. Например,
Se0 + 2 e = Se2-,
E ESe0 0/Se2 RT2F ln aSe2
Газовые электроды представляют собой инертный металл, одновременно контактирующий с газом и раствором, содержащим одноименные с газом ионы. Наибольшее распространение в аналитической практике имеют водородный (H+/H2,Pt), кислородный (OH-/O2,Pt) и хлорный (Cl-/Cl2,Pt) электроды.
Водородный электрод представляет собой платиновую пластину, опущенную в раствор, содержащий ионы водорода. Через раствор под постоянным давлением пропускают газообразный водород. Если активность ионов водорода равна 1 моль/л, а газообразный водород пропускают под давлением 1 атм., то такой электрод называют стандартным водородным электродом. Потенциалопределяющая реакция и уравнение Нернста для водородного электрода имеют вид:
2H+ + 2 e = H2,
|
RT |
a |
2 |
|
|
|
E |
|
ln |
|
H |
|
|
|
|
|
|
|||
|
2F |
a |
H2 |
|
||
|
|
|
|
|||
Если газ подается под давлением 1 атм., условия стандартные, то
aH2 PH2 1
и уравнение Нернста принимает вид:
E 0.059lg aH 0.059pH
10
