
echma_2011 (1)
.pdf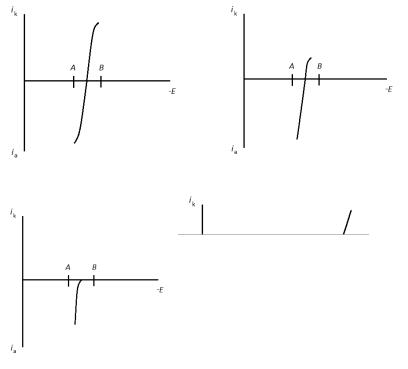
А) |
Б) |
В) Г)
Рис. 4.1. Поляризационные кривые системы I2/I- (А, Б, В) и S4O62-/S2O32- (Г) в процессе титрования йода раствором тиосульфата натрия
I2в водном растворе KI титруется раствором Na2S2O3.Так как система I2/I электрохимически обратима, на платиновых электродах одновременно протекают два процесса (рис. 4.1 А):
(–) I2 + 2 e = 2I-
(+)2I- – 2 e = I2
В процессе титрования концентрация I2 уменьшается, следовательно, уменьшается и катодный ток, обусловленный восстановлением йода (рис. 4.1 Б). В точке эквивалентности катодный ток становится равным нулю и через внешнюю цепь ток не протекает. После точки эквивалентности ток в системе должен определяться парой S4O62-/S2O32-, однако, приложенной разности
потенциалов недостаточно для одновременного протекания катодного и анодного процессов (поскольку система необратима), поэтому общий ток равен нулю. Кривая титрования йода тиосульфатом натрия представлена на рис. 4.2.
Рис. 4.2. Кривая титрования I2 раствором Na2S2O3
При обратном титровании кривая титрования имеет зеркальный вид.
Если в начальный момент титрования один из компонентов обратимой окислитено-восстановительной пары отсутствует в системе, кривая титрования имеет несколько иной вид, который также можно объяснить, опираясь на поляризационные кривые. Например, титрование ионов Fe2+ раствором KMnO4.
В начальный момент в растворе присутствует только ионы Fe2+, способные окисляться на аноде (рис.4.3а). Катодный ток, обусловленный восстановлением второго компонента обратимой пары отсутствует, поэтому общий ток равен нулю. При добавлении титранта в растворе протекает окислительно-восстановительная реакция, часть ионов Fe2+ переходят в Fe3+, наряду с анодным током протекает и катодный ток, поэтому через ячейку начинает идти ток (рис.4.3б). В момент времени, когда степень оттитрованности составляет 50 %, в растворе находится максимальное количество окислительно-восстановительных пар (рис.4.3 в), поэтому на кривой титрования наблюдается максимум (рис.4.3г) В промежутке 0.5<γ<1, анодный ток продолжает уменьшаться, а катодный
72
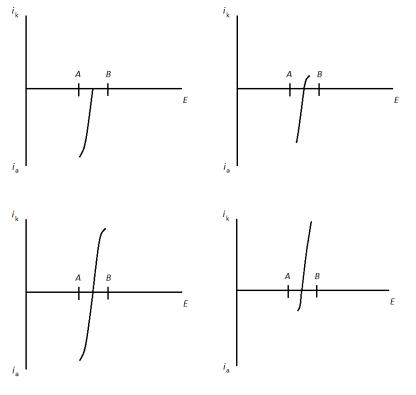
увеличиваться, при этом общее количество обратимых пар уменьшается, что приводит к уменьшению и общего тока протекающего через систему. В точке эквивалентности ток окисления Fe2+ отсутствует, в системе нет обратимых окислительновосстановительных пар (рис. 4.3д) способных обеспечить одновременное протекание катодного и анодного процессов, поэтому и общий ток равен нулю (рис 4.3е).
После точки эквивалентности приложенной разности потенциалов недостаточно для одновременного протекания катодного и анодного процессов (поскольку система необратима), поэтому общий ток равен нулю. Кривая титрования ионов Fe2+раствором KMnO4представлена на рис. 4.4.
73
Рис.4.3. Поляризационные кривые обратимой пары Fe3+/Fe2+ в различные моменты титрования Fe2+ раствором KMnO4 а, б, в, г, д, е
Рис. 4.4 Кривая амперометрического титрования Fe2+ раствором
KMnO4
4.2.2. Титрование необратимой системы обратимой
При титровании необратимой системы обратимой вид кривой будет зеркальным по отношению к титрованию обратимой системы необратимой при одновременном присутствии двух компонентов обратимой пары в растворе. Рассмотрим процесс титрования KMnO4 раствором соли Fe2+ в кислой среде. До точки эквивалентности будет возрастать только катодный ток, обусловленный появлением в системе ионов Fe3+. (рис. 4.5).
74
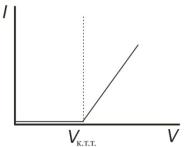
Рис. 4.5. Поляризационные кривые процесса титрования KMnO4 раствором соли Fe2+ в различные моменты титрования
Так как отсутствует сопряженная пара, то через электрохимическую ячейку ток протекать не будет. После точки эквивалентности в системе наряду с катодным появляется анодный ток, следовательно мы можем наблюдать и протекание общего тока через ячейку. Кривая титрования представлена на рис. 4.6.
Рис. 4.6. Кривая титрования KMnO4 раствором соли Fe2+
4.2.3.Титрование необратимой системы необратимой в присутствии электрометрического индиктора
Если определяемое вещество и титрант относятся к необратимым системам, но существуют обратимые пары, компоненты которых могут реагировать с избытком титранта, то такой процесс называется титрованием с электрометрическим индикатором. Например, определение Al3+ возможно путем титрования F- - ионами в присутствии обратимой окислительновосстановительной пары Fe3+/Fe2+. До точки эквивалентности протекание тока через ячейку обусловлено присутствием обоих компонентов обратимой пары. После точки эквивалентности катодный ток начинает уменьшаться вследствие протекания
реакции
Fe3+ + 5F- = FeF52-,
в результате чего начинает падать и общий ток. Изменение поляризационных кривых и кривая титрования представлены на рис. 4.7.
75
Рис. 4.7 Поляризационные кривые и кривая титрования Al3+ фторидионами в присутствии Fe3+/Fe2+.
4.3.Лабораторные работы
4.3.1.Порядок работы на приборе «Dead-stop» -
титриметр
1. В положении «Оff»
переключателя |
|
(1) |
|
проверить |
установку |
||
стрелки (2) |
|
на |
«0» |
шкалы. |
|
|
Если |
необходимо, |
|
стрелку |
|
выставляют |
на |
«0» |
|
винтом (3). |
|
|
|
2. Подключают |
|
|
к |
соответствующим |
|||
полюсам батарею (3 В). |
|||
Переключатель |
|
(1) |
|
поворачивают |
|
|
в |
положение «Bat», при |
|||
этом стрелка |
должна |
||
попадать в область красной метки шкалы. В противном случае необходимо заменить батарею.
3.Собирают ячейку: стакан с раствором, в который опущены два платиновых электрода, устанавливают на магнитную мешалку, проводники от электродов подсоединяют к прибору.
4.Для регулировки напряжения, необходимого для титрования, переключатель (4) переводят в положение 100 мВ (или 500 мВ), переключатель (1) переводят в положение
«mV». При помощи регулятора напряжения (5)
76
устанавливают необходимое для титрования напряжение, ориентируясь на шкалу (2).
5.После регулировки величины напряжения, переключатель
(1) переводят в положение 20 μА или 100 μА, в зависимости от величины тока, и начинают титрование, отсчитывая показывающую прибором силу тока. По полученным в результате титрования результатам строят зависимость I от V титранта.
4.3.2. Амперометрическое титрование
4.3.2.1.Лабораторная работа 6. Амперометрическое титрование с двумя поляризованными электродами. Определение йода
Цель работы:
1.Ознакомление с амперометрической системой индикации точки эквивалентности
2.Количественное определение йода в контрольном растворе.
Сущность методики.
Йод, растворенный в водном растворе KI, титруют раствором
тиосульфата. Конец титрования устанавливают по резкому уменьшению тока. Для сравнения проводят титрование с крахмалом.
Обоснование методики анализа
1.Что известно об обратимости системы I2/I- и S4O62-/S2O32-?
2.Какие реакции идут на электродах и в растворе?
3.Какое напряжение нужно подать на электроды, чтобы ток в системе был достаточно значительным?
4.Опираясь на поляризационные кривые, проведите обоснование вида кривой титрования йода раствором
Na2S2O3.
5.От каких факторов зависит ток в методе амперометрического титрования с двумя поляризованными электродами? Какие из них поддерживаются постоянными
во время титрования?
Экспериментальная часть Оборудование:
«Dead-stop» - титриметр;
Два платиновых электрода;
магнитная мешалка с якорьком;
штатив лабораторный;
77
стакан на 50 мл;
бюретка на 25 мл;
пипетка градуированная 0 – 5 мл;
колба для титрования на 50 мл;
колба мерная на 50 мл для приготовления контрольного раствора.
Реактивы:
рабочий раствор Na2S2O3(С1/2 = 0.5 моль/л);
1 % раствор крахмала
азотная кислота (1:1).
Порядок выполнения работы:
1.Внимательно ознакомьтесь с инструкцией к прибору. Соберите установку для титрования.
2.В колбу для титрования внесите 5 мл контрольного
раствора и проведите титрование раствором Na2S2O3 (С1/2 = 0.5 моль/л). Крахмал добавляется в конце титрования (после появления соломенно-желтой окраски). Титрование проведите минимум 3 раза, данные занесите в лабораторный журнал.
3.В стакан для амперометрического титрования внесите 5 мл контрольного раствора, добавьте ~ 40 мл дистиллированной воды. Опустите электродную систему таким образом, чтобы платиновые электроды были полностью покрыты раствором (платиновые электроды необходимо предварительно промыть азотной кислотой и дистиллированной водой).
4.Наложите на электроды небольшое напряжение ~ 40:60 мВ.
5.Проверьте влияние на ток таких факторов как напряжение, перемешивание, концентрация раствора. Для этого измерьте ток при 10, 20, 40, 60 мВ при включенной мешалке и без перемешивания раствора.
6.При постоянном напряжении и равномерном перемешивании раствора проведите «грубое» титрование, приливая из бюретки по 0,5 мл стандартного раствора, каждый раз записывая значение тока, до тех пор, пока ток не достигнет постоянного значения. Результаты всех
измерений занесите в таблицу:
Таблица 4.1. Результаты амперометрического титрования I2
V(Na2S2O3), мл |
I1, A |
I2, A |
I3, A |
78

График строят в координатах I–V(Na2S2O3) и находят к.т.т.
7.Второе и третье титрование проводят, приливая титрант Na2S2O3 порциями по 0.2 мл вблизи точки эквивалентности.
8.Проведите расчет концентрации I2- по закону эквивалентов.
9.Проведите статистическую обработку результатов анализа.
Обсуждение результатов
1.Сравните полученную на опыте зависимость V(Na2S2O3)–I с теоретически ожидаемой.
2.Сравните два способа (визуальный и амперометрический) индикации к.т.т. (точность, правильность, экспрессность).
3.Объясните, какие еще вещества можно определять, используя иодометрический метод
4.Сделайте краткие выводы по работе.
79

5. Кулонометрия
Кулонометрический анализ заключается в определении количества электричества, расходуемого в ходе электрохимической реакции.
Различают кулонометрию
1.при постоянном токе (кулонометрическое титрование) – гальваностатический метод;
2.при постоянном потенциале – потенциостатический метод. В кулонометрии количество электричества связанно с
количеством вещества по закону Фарадея:
zFQ n (моль)
При i const
Q It ,
при E const
t
Q Idt
0
Для проведения анализа методом кулонометрии и кулонометрического титрования необходимо соблюдать следующие условия:
1)электролиз следует вести при таких условиях, чтобы ВПТ был равен 100% (то есть, чтобы в системе не протекали побочные процессы). Для этого нужно знать поляризационные кривые i f (E) для всех веществ, присутствующих в растворе.
2)необходимо иметь способ обнаружения конца электрохимической реакции (или точки эквивалентности).
3)для вычисления массы электрохимически прореагировавшего вещества необходимо знать Q, A – атомный вес элемента и z – валентность (степень окисления), так как
m AQ .
96500z
80
