
echma_2011 (1)
.pdf1.1.2.Электроды II рода
Кэлектродам II рода относятся такие электродные системы, потенциал которых связан с активностью представляющего интерес иона косвенным образом; активность данного вещества связана только через одно химическое равновесие с активностью другого вещества, определяющего потенциал электрода. Потенциалопределяющими являются ионы, которые сами не принимают участия в электродной реакции, но участвуют в химической реакции в растворе. К электродам второго рода относятся металлы, покрытые малорастворимым соединением данного металла, опущенные в раствор, содержащий одноименные с малорастворимым соединением ионы. Наибольшее распространение имеют хлоридсеребряный, каломельный и металоксидные электроды.
Каломельный электрод Cl-/Hg2Cl2,Hg
Для приготовления каломельного электрода смешивают мелкозернистую каломель с ртутью до образования каломельнортутной пасты и наносят последнюю на поверхность ртути, пока она не покроется перламутровой каломельной оболочкой. Полученный стержень опускают в раствор хлорида калия определенной концентрации. В электрохимических измерениях используют каломельные электроды с содержанием KCl 0.1моль/л, 1 моль/л и насыщенный раствор. Их потенциалы при 25°С равны соответственно 0.3337, 0.2801 и 0.2412 В.
Потенциалопределяющая реакции для каломельного электрода:
Hg2Cl2 + 2 e = 2Hg + 2Cl-
Если раствор насыщен малорастворимой солью, то концентрация ионов металла может быть выражена из произведения растворимости:
Hg22 |
ПРHg Cl |
, |
2 2 |
||
Cl 2 |
и уравнение Нернста примет вид:
|
|
|
0,059 |
|
ПР |
|
|
|
0 0,059 lg Cl |
E E0 2 |
|
|
lg |
Hg2Cl2 |
|
E'0 |
|||
0 |
|
Cl |
2 |
||||||
Hg2 /Hg |
|
|
2 |
|
|
Hg2Cl2/Hg |
|
||
|
|
|
|
|
|
|
|
||
11
Хлоридсеребряный электрод |
|
||
Хлоридсеребряный |
электрод |
представляет |
серебряную |
проволочку, покрытую хлоридом серебра, опущенную в раствор с определенным содержанием KCl. Потенциалопределяющая реакция:
AgCl + 1 e = Ag + Cl-
Аналогично каломельному электроду уравнение Нернста можно представить в виде:
|
|
ПРAgCl |
|
0,059 lg Cl . |
||||
E E0 |
0,059 lg |
|
|
|
|
E'0 |
||
Cl |
|
|
||||||
Ag /Ag |
|
|
AgCl/Ag |
|
||||
|
|
|
|
|
|
|||
В электрохимических измерениях хлоридсеребряный электрод используется наиболее часто в качестве электрода сравнения. Потенциал хлоридсеребряного электрода при 25°С в 1 моль/л растворе KCl равен 0.222 В, а в насыщенном растворе KCl –
+0,201В.
Металлооксидные электроды
Металлооксидные электроды состоят из металла, покрытого тонким слоем оксида данного металла. В роли анионов малорастворимых соединений выступают ионы гидроксида. Примером металлооксидных электродов являются ртутно-оксидный
(OH-/HgO, Hg) и сурьмяный (OH-/Sb2O3, Sb) электроды.
Металлооксидные электроды обычно используют для определения рН растворов. Область измерения рН зависит от устойчивости оксидной пленки.
Сурьмяный электрод (OH-/Sb2O3, Sb)
= 2Sb + 6OH-
Потенциал сурьмяного электрода равен:
|
|
|
|
0,059 |
|
a |
|
|
|
|||
|
E E0 |
|
lg |
|
|
Sb2O3 |
|
|
|
|||
|
|
|
2 |
a6 |
|
|
||||||
|
|
Sb2O3/Sb |
6 |
|
a |
|
|
|
||||
|
|
|
|
|
|
Sb |
OH |
|
||||
Так как активность твердой фазы равна 1, |
aSb2O3 |
aSb 1 , то |
||||||||||
E E0 |
|
0.059lg a |
E0 |
|
|
0.059pOH |
||||||
Sb2O3/Sb |
|
|
OH |
|
|
Sb2O3/Sb |
|
|
|
|||
12

Сурьмяный электрод применяют для измерения активности ионов водорода в диапазоне рН от 1 до 12 с точностью ±0.2 единицы рН. Потенциал электрода устанавливается достаточно быстро, а поскольку электрод имеет низкое сопротивление и высокую механическую прочность, то может применяться для непрерывного контроля рН в производственных процессах.
1.1.3. Окислительно-восстановительные электроды
Потенциал электродов, изготовленных из благородных металлов (Pt, Ir, Au, Pd) чувствителен к наличию в растворе любой
окислительно-восстановительной системы, например:
Mz+, M(z-n)+/Pt.
Электродная реакция заключается в переносе электронов, при этом электрод не участвует в потенциалообразовании, а служит лишь переносчиком электронов. На таком электроде наблюдается только один потенциал, соответствующий равновесному потенциалу всех окислитено-восстановительных систем, присутствующих в растворе в условиях их совместного существования.
Например, в растворе, содержащем окислительновосстановительную пару Fe3+/Fe2+, на поверхности платинового электрода будет протекать реакция
Fe3+ + 1 e Fe2+,
при этом потенциал платинового электрода может быть рассчитан по уравнению:
E 0.77 0.059lg aFe3 .
aFe2
Хингидронный электрод
Для системы хинон-гидрохинон с реакцией
13
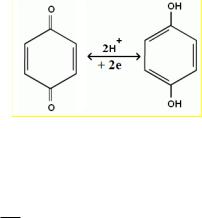
потенциал электрода зависит от активности трех компонентов:
E E |
0 |
|
0.059 |
lg |
aх |
aH2 |
. |
|
2 |
|
aгх |
||||
|
|
|
|
|
|
Если в раствор ввести эквимолярную смесь хинона и
гидрохинона, ax 1, потенциал платинового электрода
aгх
становится только функцией рН раствора
E E0 0.059pH.
1.1.4. Ионоселективные электроды
Ионоселективные электроды – электрохимические системы, в которых потенциал определяется распределением ионов между мембраной и раствором. При этом распределяются преимущественно ионы одинакового знака заряда. Поэтому мембрана имеет ионную проводимость.
Общая схема измерения потенциалов в селективных электродах представлена на рис. 1.3.
Мембрана разделяет 2 раствора – внутренний и внешний. После погружения электрода в раствор через мембрану начинается перемещение ионов определенного вида, так как есть градиент концентраций. За счет переноса заряженных частиц, возникает потенциал, который мешает дальнейшему перемещению частиц, и устанавливается равновесие. Прибор фиксирует потенциал, равный сумме всех потенциалов на границе раздела фаз
E 1 2 3 4 ,
const
где:
14
φ1 – скачок потенциала на внешней границе; φ2 – скачок потенциала на внутренней границе;
φ3 – скачок потенциала у вспомогательного электрода; φ4 – скачок потенциала у электрода сравнения.
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
φ3 |
|
φ4 |
2 |
|
|
|
|
|
|
|||||||
φ2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
aM |
|
|
|
|
|
|
|
|
Ka |
||||
1 |
aMxφ0 |
Рис. 1.3. Схема измерения потенциала с помощью ионоселективного электрода,
где
1 – мембрана, внутри находится ион, активность которого известна;
2– вспомогательный электрод (хлорсеребряный);
3– электрод сравнения (каломельный, хлорсеребряный);
4– высокоомное сопротивление (высокоомный вольтметр, pH-метр).
Стеклянный электрод
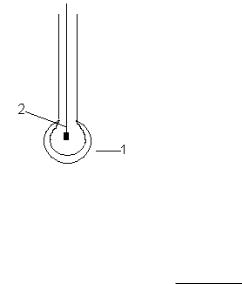
Стеклянный электрод (рис. 1.4) состоит из стеклянного шарика (мембраны (1) толщиной ~0.06–0.1 мм, имеющей следующий состав: SiO2 – 60–70%; Al2O3 – 17–30%; M2O – 3–16%, где М – Na, Li) и вспомогательного электрода (2).
Стекло представляет собой переохлажденную жидкость (силикат), в которой подвижные ионы Li+ и Na+ могут замещаться на H+-ионы. Ионы водорода проникая в стекло, образуют гель кремневой кислоты, таким образом, граница раздела насыщена ионами H+. Если электрод поместить в раствор с неизвестным рН,
15
то будет происходить перенос ионов H+ между стеклом и раствором, в результате чего возникает потенциал
a |
|
р р |
|
|
E E0 0.059lg |
|
H |
. |
|
|
|
|
||
|
aH ст. |
|
||
|
|
|||
Рис. 1.4. Стеклянный электрод. 1 – стеклянная мембрана, 2 – вспомогательный электрод
Наряду с обменом ионами водорода будет идти процесс обмена
H+ + M+ст.H+ст. + M+.
Этот процесс характеризуется константой обмена:
Kобм. aH aM ст. .
aH ст. aM
Так как
aH ст. aM ст. a const ,
то, выражая активность ионов металла в стекле через суммарную активность, получаем:
|
|
aH |
|
K aM |
aH |
. |
|
|
|
|
aH ст. |
a |
|
|
|
||
|
|
|
|
|
|
|
||
Подставим данное выражение в уравнение Нернста: |
|
|||||||
E |
E0 0.059lg a 0.059lg( a |
|
K a |
) . |
||||
ст. |
|
|
|
|
H |
M |
|
|
Так как E0 0.059lg a const для данного сорта стекла, то
16
Eст. E0ст. 0.059lg( aH K aM )
Константа обмена для стеклянного электрода имеет величину порядка 10-15–10-10, aM тоже мала в кислых, нейтральных и
слабощелочных растворах, поэтому можно принять, что
Eст.~pH
Главным недостатком стеклянных электродов является высокое омическое сопротивление ~106 Ом (рН-метры с высокоомным входом).
1.2. Потенциометрическое титрование
Потенциометрическое титрование основано на измерении потенциала электрода в процессе титрования и определении точки эквивалентности по резкому скачку потенциала. Потенциал электрода используется в качестве индикатора в потенциометрическом титровании, поскольку существует линейная зависимость между электродным потенциалом и логарифмом активности ионов. Количественным выражением этой зависимости является уравнение Нернста
|
RT |
|
a |
Ox |
|
Е E0 |
|
ln |
|
. |
|
|
|
|
|||
|
zF |
|
|
|
|
|
aRed |
||||
С помощью потенциометрического титрования могут решаться как аналитические так и физико-химические задачи:
1)определение концентрации одного или нескольких веществ, присутствующих в растворе;
2)определение кажущихся констант диссоциации слабых кислот и оснований;
3)определение константы нестойкости комплексных ионов;
4)определение произведения растворимости Ks;
5)определение нормальных окислительно-восстановительных потенциалов.
По типу реакций, протекающих в растворе, потенциометрическое титрование можно подразделить на следующие виды:
1)титрование окислительно-восстановительных систем;
2)титрование с образованием малорастворимых соединений;
17
3)титрование кислот, щелочей, солей, подвергающихся гидролизу;
4)титрование с образованием комплексных соединений. Чтобы измерить потенциал в потенциометрическом титровании
используется индикаторный электрод и электрод сравнения. Индикаторный электрод – это электрод, обратимый по отношению к определяемому иону, т. е. подчиняющийся уравнению Нернста. Потенциал электрода сравнения во время измерений остается постоянной величиной. Кроме этих двух потенциалов, в растворе существует еще и омическое падение напряжения iR, то есть:
E инд эл.ср. iR .
эл.ср. const.
Так как в данной главе рассматривается потенциометрическое титрование в равновесных условиях, то i=0, поэтому потенциал системы определяется только изменением потенциала индикаторного электрода.
1.2.1. Окислительно-восстановительные реакции
Любую реакцию, протекающую при окислительновосстановительном титровании можно записать в общем виде:
aOx1 bRed2 cRed1 dOx2 .
Данное уравнение можно представить и в виде двух сопряженных между собой процессов восстановления (A) и окисления (B):
aOx1 ze cRed1 , |
(А) |
bRed2 ze dOx2 . |
(В) |
В условиях равновесия потенциал индикаторного электрода будет зависеть от каждого окислительно-восстановительного процесса (A) и (B), поскольку электрод служит переносчиком электронов в обоих равновесных процессах. Следовательно, величина потенциала индикаторного электрода будет равна одновременно значению потенциала электрода для каждого RedOx процесса:
E EA EB . |
(1.7) |
18
Если процессы A и B протекают на данном электроде обратимо, то при установившемся равновесии потенциал этого электрода для процессов A и B можно выразить как:
|
|
|
0.059 |
|
|
Ox |
|
a |
|
|
|
|
||||
E |
E0 |
|
|
|
|
lg |
|
|
1 |
|
|
|
, |
(1.8) |
||
|
|
|
|
Red |
|
|
||||||||||
A |
A |
|
|
z |
|
|
|
c |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
0.059 |
|
|
|
Ox |
2 |
d |
|
|
|
|
|||
E |
E0 |
|
|
|
|
lg |
|
|
|
|
|
. |
(1.9) |
|||
|
|
|
Red |
|
|
|
|
|||||||||
B |
B |
|
|
z |
|
2 |
b |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Зная соответствующие стандартные RedOx потенциалы E 0 |
и |
|
A |
|
E0 |
можно рассчитать константу равновесия RedOx процесса, |
|
B |
|
|
учесть полноту его протекания, а так же определить значение потенциала в точке эквивалентности.
Рассмотрим эти расчеты в общем виде. Из равенства (1.7) и
уравнений (1.8, 1.9) можно записать: |
|
|
|
|
|
|
|
|
||||||
|
|
0.059 |
|
Ox a |
|
|
|
0.059 |
|
Ox |
2 |
d |
|
|
E0 |
|
|
lg |
1 |
|
E0 |
|
|
lg |
|
|
, |
||
|
|
|
|
|
|
|
||||||||
A |
|
z |
|
c |
B |
|
z |
|
Red |
|
b |
|||
|
|
|
Red1 |
|
|
|
|
2 |
|
|||||
или |
|
|
|
|
|
|
|
|
|
|
|
E0 |
E |
0 |
|
|
Ox |
d Red |
c |
||
|
A |
|
B |
z lg |
|
2 |
|
1 |
. |
|
|
|
|
|
|
Red |
|
b Ox |
|||
0.059 |
|
|
|
2 |
a |
|||||
|
|
|
|
|
|
|
|
1 |
|
|
Величина |
|
|
|
|
|
|
|
|
|
|
lg K |
|
EA0 EB0 |
z . |
|
(1.10) |
|||||
|
0.059 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
является константой равновесия окислительно-восстановительного процесса.
Из уравнения (2.8) следует, что чем больше разность EA0 EB0 ,
тем больше при прочих равных условиях будет величина K, то есть тем более полно будет смещено равновесие в системе, и тем точнее будет результат титрования.
Пусть в ходе протекания RedOx реакции a=c и b=d, тогда значение потенциала в точке эквивалентности Eэ можно получить
путем сложения уравнений (1.8) и (1.9), умножая их на соответствующие коэффициенты (1.8) на b, (1.9) на a
19

|
|
a b E |
bE0 |
aE0 , (1.11) |
|
||||||||||||||
|
|
|
|
|
|
|
|
э |
|
|
|
A |
|
|
|
B |
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
bE0 |
aE0 |
|
|
|||||||
|
|
|
|
|
|
E |
|
|
|
A |
|
|
|
B |
. (1.12) |
|
|
|
|
|
|
|
|
|
|
э |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
a b |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Например, рассчитаем K и ЕЭ для случая титрования сульфита |
|||||||||||||||||||
раствором бромата в кислой среде. |
|
|
|
|
|
|
|
||||||||||||
BrO |
3SO2 Br 3SO2 |
|
|
|
|
|
|||||||||||||
3 |
3 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
BrO |
6e 6H Br |
3H |
2 |
O |
E0 |
1.42В |
|||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
3SO2 6e 3H |
2 |
O 3SO2 |
|
6H |
E0 |
0.22В |
|||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
B |
|
|
|
lg K |
EA0 |
EB0 |
z |
1.42 0.22 |
6 122 . |
|||||||||||||
|
|
0.059 |
|
|
|
0.059 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Откуда K 10122 , а из уравнения (1.12): |
|
|
|||||||||||||||||
|
E |
bE0 |
|
aE0 |
|
3 1.42 0.22 |
1.12В . |
||||||||||||
|
|
A |
|
|
|
|
B |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
э |
|
a |
b |
|
|
|
|
|
|
3 1 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Графически ход потенциометрического титрования представляют в виде кривой в координатах объем добавленного титранта – потенциал. Вблизи точки эквивалентности потенциал резко изменяется. В зависимости от определяемого вещества и титранта кривые окислительно-восстановительного титрования могут быть восходящего и нисходящего типа (рис. 1.5).
Е |
Е |
Vк.т.т. |
V |
Vк.т.т. |
V |
Рис. 1.5. Кривая потенциометрического титрования а) восстановитель титруется окислителем, б) окислитель титруется восстановителем ( вставить а и б в сам рисунок
20
