
- •Неорганическая химия
- •Часть I. Классификация и номенклатура неорганических соединений
- •Тема 1. Номенклатура неорганических соединений
- •1.2. Семинар 1. Классы и номенклатура неорганических соединений
- •Часть II. Химия неметаллов
- •Тема 3. Водород
- •3.1. Теоретическая часть
- •3.2. Семинар 3. Соединения водорода. Получение и применение водорода
- •3.3. Подготовка к лабораторной работе
- •3.6. Синтез гидрида кальция
- •Тема 4. Галогены
- •2. Окислительные свойства свободных галогенов
- •XCa(oci)2 · yCaCl2 · zCa(oh)2 · nН2o.
- •Тема 5 элементы главной подгруппы шестой группы
- •5.3. Сера и элементы подгруппы селена
- •5.3.1. Теоретическая часть
- •Тема 6. Элементы главной подгруппы пятой группы
- •Тема 7. Углерод. Кремний. Бор
- •7.2. Семинар 9. Углерод. Соединения кремния и бора
- •7.3. Углерод
- •Дициан цианистый цианамид циановый роданистый
- •7.4.3. Лабораторная работа. Кремний и его соединения
- •7.6. Синтезы соединений бора
- •7.7. Задания для самостоятельной работы
- •Приложение 4. Атомные радиусы:
- •Часть II
- •Часть III
Приложение 4. Атомные радиусы:
металлические (rмет) для металлических структур с к.ч. = 12;
ковалентные (rков) – радиусы атомов в ковалентных молекулах
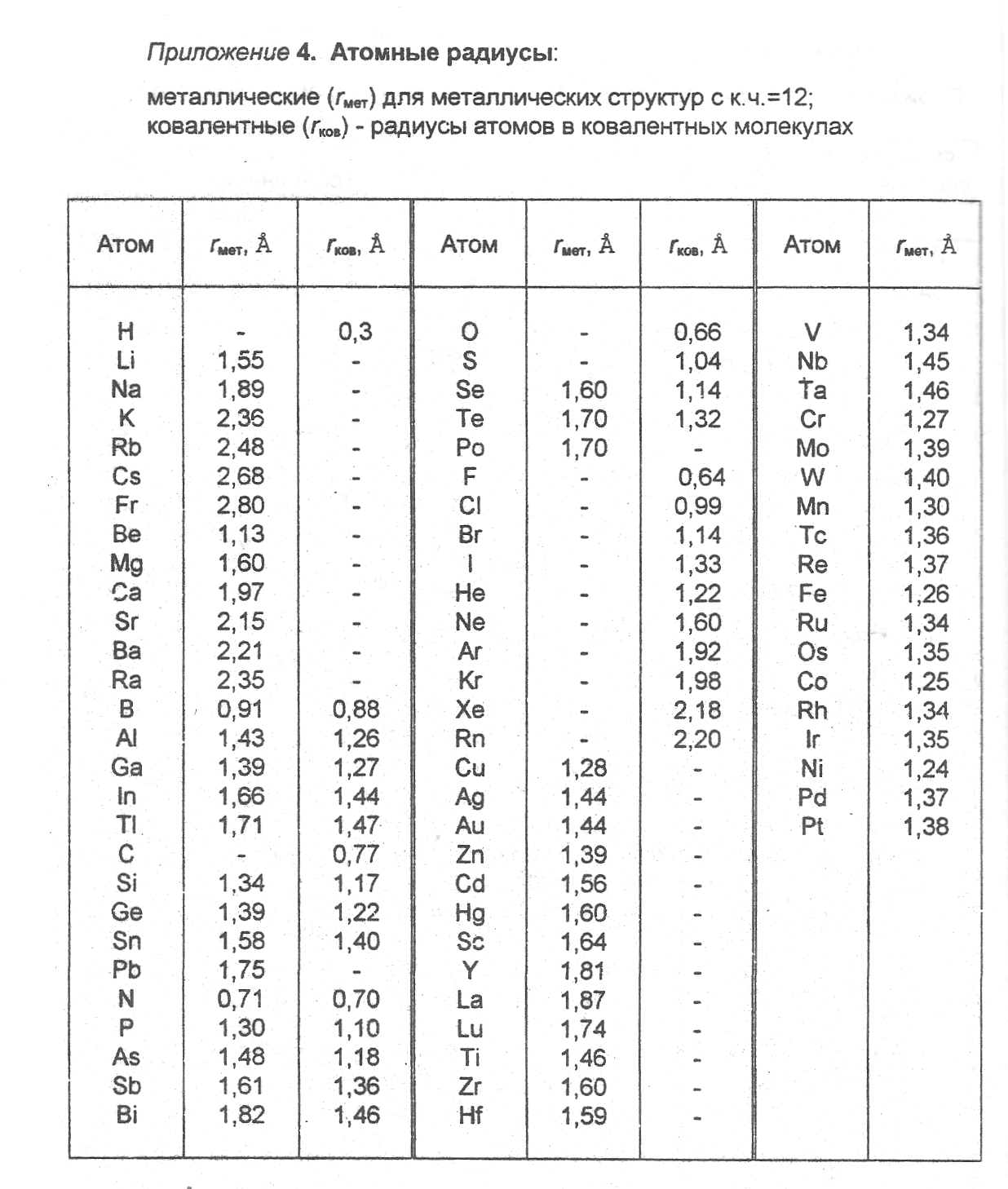
Приложение 5. Ионные радиусы по Белову и Бокию
(радиус иона О2- принят равным 1,36 Å
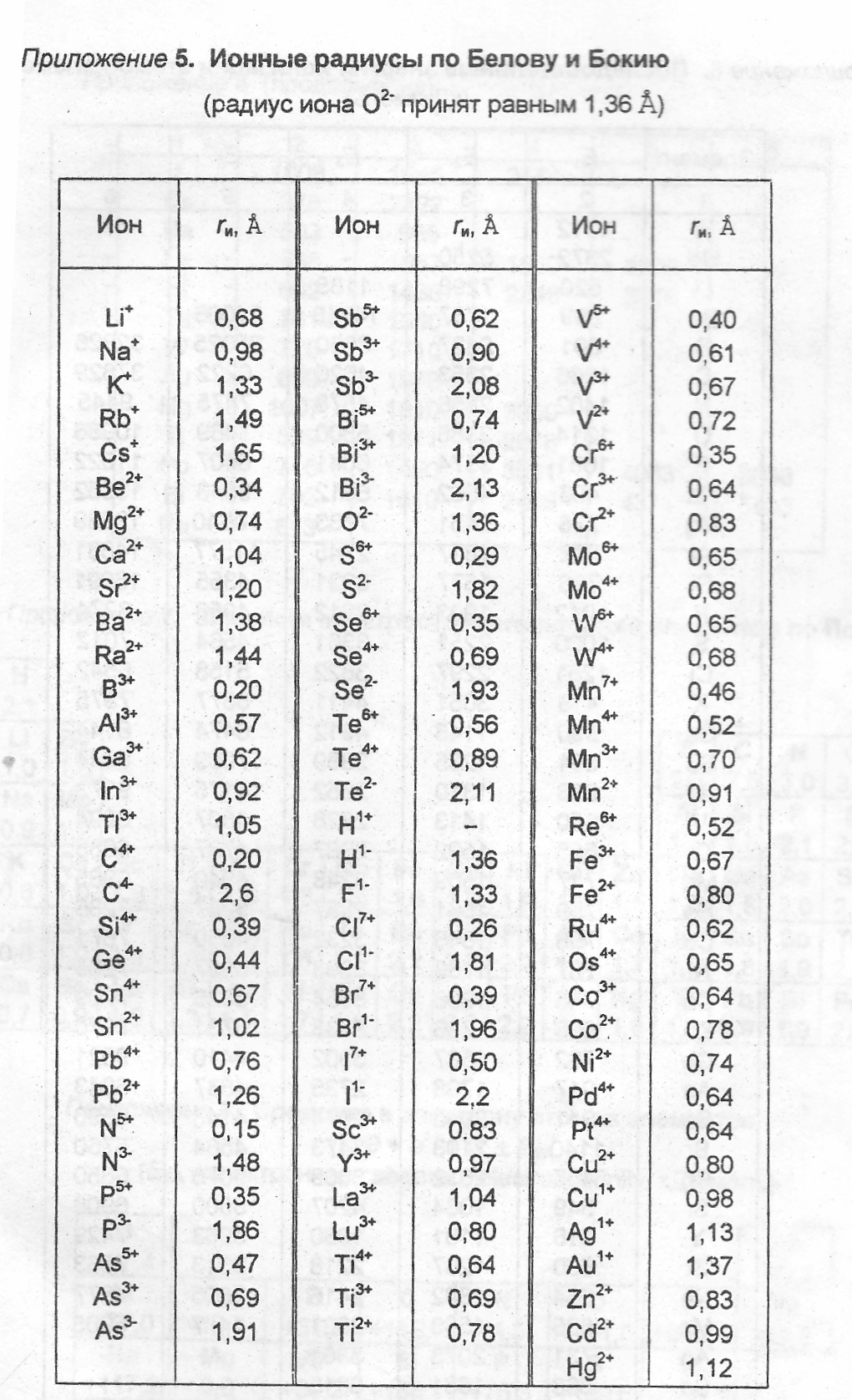
Приложение 6. Последовательные энергии ионизации атомов элементов
(кДж/моль)
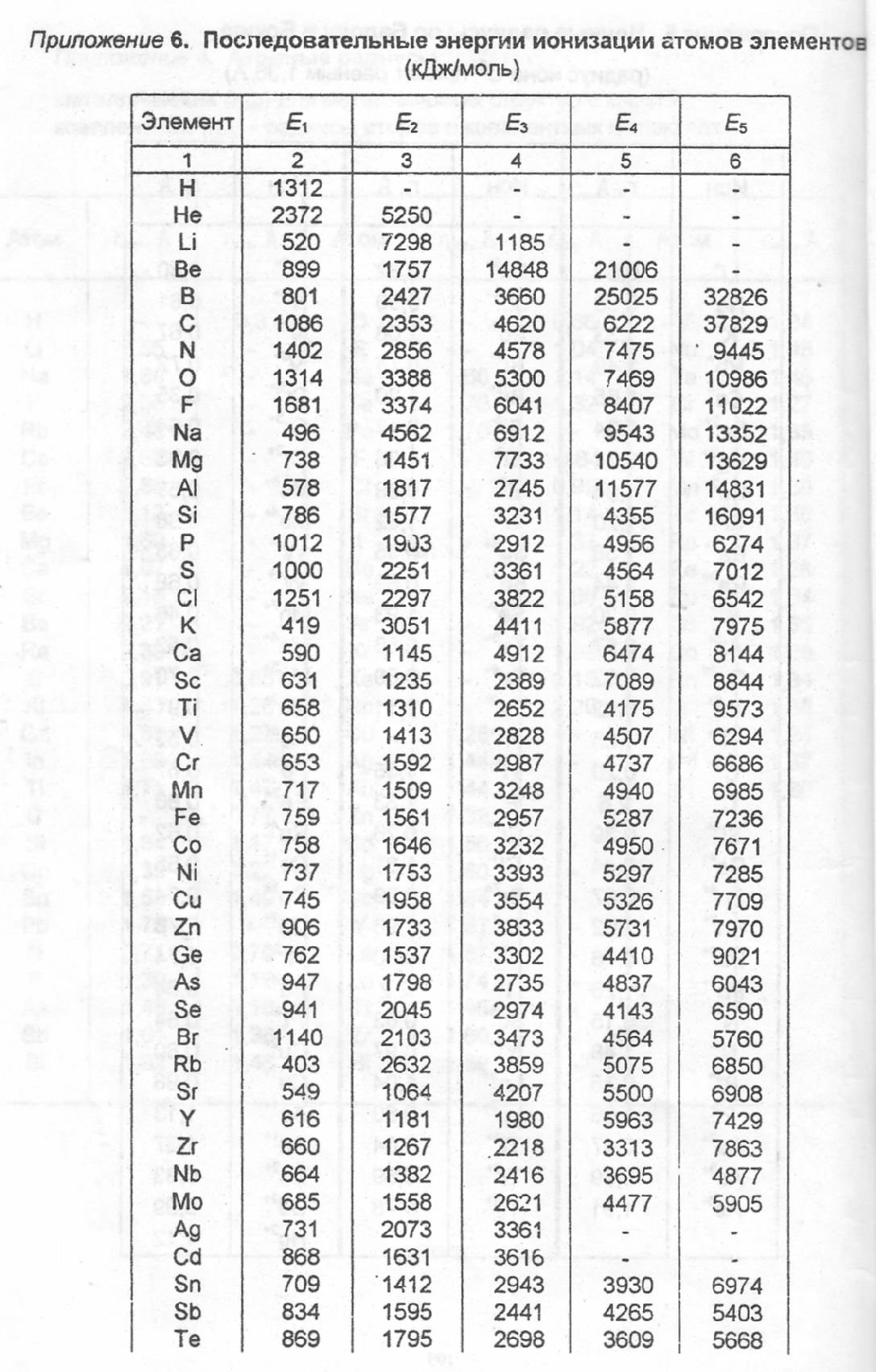
Приложение 6 (продолжение)
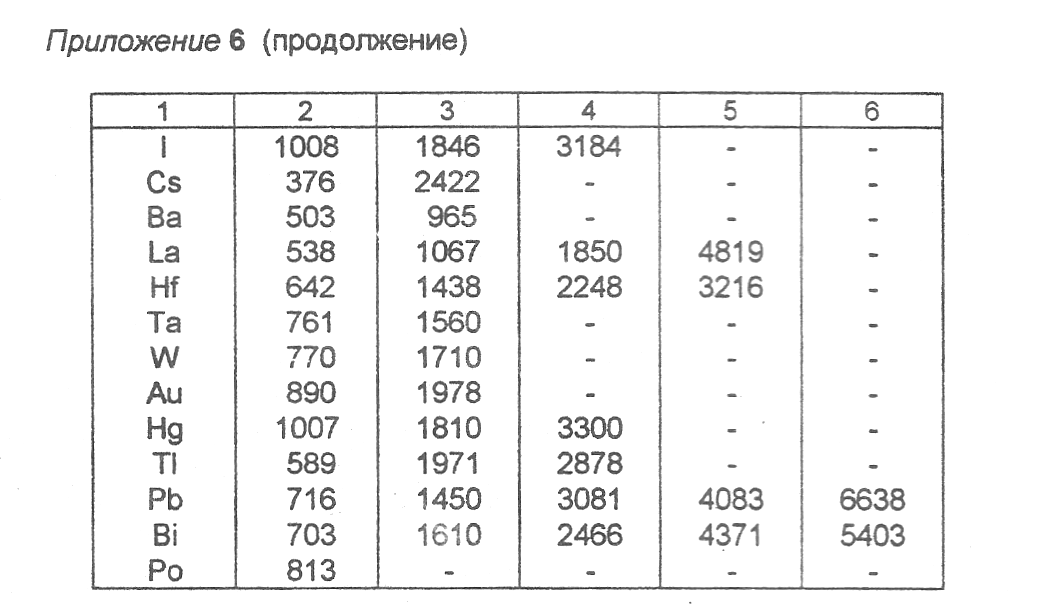
Приложение 7. Значения электроотрицательностей элементов по Полингу

Приложение 8. Сродство к электрону атомов элементов
Э + е- → Э- ± ЕЕА
(ЕЕА – электронное сродство, electron affinity, кДж/моль)

Приложение 9. Параметры (длина, энтальпия) некоторых связей

Приложение 10. Константы диссоциации кислот и оснований
(Для кислот и оснований приводятся ступенчатые константы диссоциации К:, константы кислотности обозначаются Ка, а основности - К.; рК, = -lg К.;
|
Название кислоты |
Формула |
К. |
рК,= -\дКа | |
|
Азотистая |
HN02 |
(К1) |
5,1·10-4 |
3,29 |
|
Азотистоводородная |
HN3 |
(К1) |
1,9· 10-5 |
4,72 |
|
Борная |
H3BO |
(K1) |
5.8·10-10 |
9,23 |
|
|
|
(K1) |
1,8·1013 |
12,74 |
|
|
|
(K3) |
1,6·10'14 |
13,80 |
|
Кремневая(мета) |
H2Si03 |
(К1) |
2,2·10 -10 |
9,66 |
|
|
|
(К2) |
1,6·1012 |
11,80 |
|
Марганцовая |
HMn04 |
(К1) |
2·102 |
-2,3 |
|
Мышьяковая (орто) |
H3ASO4 |
(К1) |
5,98·10-3 |
2,22 |
|
|
|
(Кг) |
1,05-10"7 |
6,98 |
|
|
|
(К3) |
3,89-1 О*12 |
11,41 |
|
Муравьиная |
HCOOH |
(К) |
1,8-10"4 |
3,75 |
|
Пероксид водорода |
H202 |
(КО |
2,0-1012 |
11,7 |
|
Сернистая |
H2S03 |
(К\) |
1,7-10'2 |
1,77 |
|
|
|
(К2) |
6,2-10"® |
7,21 |
|
Сероводородная |
H2S |
(Kl) |
1,0-107 |
7,00 |
|
|
|
(К2) |
1,3-10'13 |
12,89 |
|
Тиосерная |
H2S203 |
(Kl) |
2,5-1 О*1 |
0,60 |
|
|
|
(Кг) |
1,9-102 |
1,72 |
|
Угольная |
Н2СОз |
СК,) |
4,5-1 о7: |
6,35 |
|
|
|
(Кг) |
4,8-Ю'11 |
10,32 |
|
Уксусная |
СНзСООН |
(*) |
1,7-10'5 |
4,77 |
|
Фосфористая |
НзРОз |
(*i) |
1,6-10'2 |
1,8 |
|
|
|
(Кг) |
2,0-10"7 |
6,7 |
|
Фосфорная (орто) |
н3ро4 |
(К) |
7,52-10-3 |
2,12 |
|
|
|
(Кг) |
6,31-10"® |
7,20 |
|
|
|
(Кг) |
1,26-10"12 |
11,9 |
|
Фосфорноватистая |
нзр02 |
(К) |
8,0-Ю'2 |
1,1 |
|
Фтороводородная |
HF |
(К) |
6,8- Ю-4 |
3,17 |
|
Хлорноватистая |
НСЮ |
(К) |
5,0-10"8 |
7,30 |
|
Хромовая |
Н2СЮ4 |
(К) |
10,0 |
-1 |
|
|
|
(Кг) |
3,16-10'7 |
6,5 |
|
Цианистоводородная |
HCN |
(К) |
6,2-1010 |
9,21 |
|
Щавелевая |
Н2С204 |
(К) |
5,6-102 |
1,25 |
|
|
|
(Кг) |
5,4-Ю-5 |
4,27 |
|
Вода |
Н20 |
(*i) |
1,8-10"1в |
15,74 |
Приложение 10 (продолжение)
|
Название основания |
Формула |
Kа |
рКа.= -lgКs | |
|
Алюминия гидроксид |
А1(ОН)3 |
(К3) |
1,0·10-9 |
9,00 |
|
Амк.ония гидроксид |
NН4ОН |
(K1) |
1,8·10-5 |
4,74 |
|
Бария гидроксид |
Ва(ОН)2 |
(K1) |
2,3-10-1 |
0,64 |
|
Бериллия гидроксид |
Ве(ОН)2 |
(К2) |
5,0·10-11 |
10,30 |
|
Гидразин |
N2H4·H2O |
(K1) |
9,8·10 -7 |
6,01 |
|
Гидроксиламин |
NH2OH |
(К1) |
9,6·10 -9 |
8,02 |
|
Железа(II) гидроксид |
Fe(OH)2 |
(К2) |
1,3·10 -4 |
3,89 |
|
Железа(Ш) гидроксид |
Fe(OH)3 |
(К2) (К3) |
1,82·10 -11 1,35·10 -12 |
10,74 11,87 |
|
Кальция гидроксид |
Ca(OH)2 |
(К2) |
4,3·10 -2 |
1,37 |
|
Магния гидроксид |
Mg(OH)2 |
(К2) |
2,5·10 -3 |
2,60 |
|
Меди(II) гидроксид |
Cu(OH)2 |
(К2) |
3,4·10 -7 |
6,47 |
|
Ртути(II) гидроксид |
Hg(OH)2 |
(К1) (К2) |
4,0·10 -12 5,0·10 -11 |
11,40 10,30 |
|
Серебра гидроксид |
AgOH |
(К1) |
1,1·10 -4 |
3,96 |
|
Стронция гидроксид |
Sr(OH)2 |
(К2) |
1,5·10 -1 |
0,82 |
|
Хрома(Ш) гидроксид |
Cr(OH)3 |
(Кг) |
1,02-10 -10 |
9,99 |
|
Цинка гидроксид |
Zn(OH)2 |
(К2) |
4·10 -5 |
4,4 |
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Некрасов Б. В. Основы общей химии. Т.1,2. - М.: Химия, 1973,- 656; 688 с.
Р е м и Г. Курс неорганической химии. Т.1,2. - М.: ИЛ, 1963, 1966. - 920; 836 с.
П о л и н г Л. Общая химия. - М : Мир, 1974,- 846 с.
Дэй К., Селбин Д. Теоретическая неорганическая химия. - М.: Мир, 1976. -567 с.
Спицын В. И., Мартыненко Л. И. Неорганическая химия. Ч.1.2.-М.: МГУ, 1991, 1994.-476; 623 с.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. 4.1,2,3.-М.: Мир, 1969.-223; 494; 591 с .
Кемпбел Дж. Современная общая химия. Т. 1,2,3. - М.: Мир, 1975.- 548; 478; 446 с.
А х м е т о в Н. С. Общая и неорганическая химия. - М.: Высшая школа, 1988.-640 с.
У г а й Я. А. Неорганическая химия. - М.: Высшая школа, 1989.- 463 с.
Карапетьянц М.Х. Введение в теорию химических процессов. - М.: Высшая школа, 1975,- 320 с.
Карапетьянц М. X., Дракин СИ. Строение вещества. - М.: Высшая школа, 1978,- 304 с.
Мартыненко Л. И, Спицын В. И. Избранные главы неорганической химии. Вып.1. - М.: МГУ, 1986,- 287 с.
Браун Т., Л е м е й Г. Ю. Химия - в центре наук. 4.1,2. - М.: Мир, 1983.-447; 520 с.
Барнард А. Теоретические основы неорганической химии. - М.: Мир, 1968.-361 с.
Анорганикум. Т.1,2 / Под ред. Л. К о л ь д и ц а. - М.: Мир, 1984 - 668;
632 с.
X ь ю и Дж. Неорганическая химия. Строение вещества и реакционная способность. - М.: Химия, 1987.- 695 с.
Коттон Ф., Уилкинсон Дж. Основы неорганической химии.- М : Мир, 1979.-677 с.
Дикерсон Р., Г рей Г., Хейт Дж. Основные законы химии. Т.1,2. -М.: Мир, 1982.-652; 620 с.
Зайцев О. С. Химическая термодинамика к курсу общей химии. - М.: МГУ, 1973.-295 с.
Б а со л о Ф., Джонсон Р. Химия координационных соединений. -М.: Мир, 1966 - 196 с.
С к о р и к Н. А., К у м о к В Н. Химия координационных соединений. - Высшая школа, 1975,- 207 с.
Костром и на НА, Кумок ВН., С кори к Н. А. Химия координационных соединений. - М.: Высшая школа, 1990.-432 с.
Зайцев О. С. Общая химия. Состояние веществ и химические реакции. - М.: Химия, 1990 - 352 с.
Общая химия / Под ред. Е. М. Соколовской, Л. С. Г у з е я . - М.. МГУ, 1989 - 640 с.
Джонсон Д. Термодинамические аспекты неорганической химии. -М.: Мир, 1985.-326 с.
П о л т о р а к О. М., К о в б а Л. М. Физико-химические основы неорганической химии. - М.: МГУ, 1984,- 288 с.
Химия и периодическая таблица / Под ред. К. С а й т о . - М.: Мир, 1982 -319 с.
Кукушкин В. Ю., Кукушкин Ю. Н. Теория и практика синтеза координационных соединений -Л.: Наука, 1990,-260 с.
П о л т о р а к О. М., Основы химической термодинамики и кинетики в курсе неорганической химии. - М.: МГУ, 1972.-165 с.
К р е б с Г. Основы кристаллохимии неорганических соединений. - М.: Мир, 1971 -304 с.
31С и е н к о М., Плейн Р., Хестер Р. Структурная неорганическая химия. - М. Мир, 1968 - 344 с.
Петров М. М., М и х и л е в Л. А., К у к у ш к и н Ю. Н. Неорганическая химия. - J1.: Химия, 1974,- 422 с.
Кудрявцев А. А. Окислительно-восстановительные реакции.- М.: Знание, 1971.-44 с.
Зайцев О. С. Исследовательский практикум по общей химии. - М.: МГУ, 1994.-480 с.
Толмачева Т. А, Иванова М. А., Дурдин Я. В., Вдове н к о В. М. Руководство к лабораторным работам по неорганической химии. -Л.: ЛГУ, 1953,- 171 с.
Руководство к лабораторным работам по общей и неорганической химии / Под ред. Ф. Я. К у л ь б а. - Л.: Химия, 1976,- 279 с.
Краузер Б., Фримантл М. Химия: Лабораторный практикум. - М.: Химия, 1995 - 315 с.
Руководство к лабораторным работам по общей химии / Под ред. А. Ф. Богоявленского. -М.: Высшая школа, 1972,-190 с.
Практикум по неорганической химии / Под ред. В. П. 3 а л м а н о в а. -М.: МГУ, 1994.-320 с.
Ивановский В. М., Ш е р г и н Н. П. Практикум по общей и неорганической химии. - М.: Росвузиздат, 1963,-175 с.
Л е с н о в а Е. В. Практикум по неорганическому синтезу. - М.: Высшая школа, 1977,-168 с.
Левант Г. Е., Р а й ц ы н Г. А. Практикум по общей химии - М.: Высшая школа, 1961 - 278 с.
С е м и ш и н В. И. Практикум по общей химии. - М ; Л.: ГНТИ, 1948 -
313 с.
Лебедева М. И., Исаева Б. И., Ан кудимова И. А., Володи н а Н А. Практикум по химии. - Воронеж: ВГУ, 1990,-150 с.
В а с и л ь е в а З.Г., Грановская А.А., Макар ычева Е.П. и др. Лабораторный практикум по общей химии. Полумикрометод. - М.: Химия, 1971.-308 с.
X о м ч е н к о Г. П. Практические работы по неорганической химии и качественному анализу. - М.: Высшая школа, 1972,- 351 с.
Практикум по неорганической химии / Под ред. В. И. С п и щи н а. - М.: МГУ, 1984 -296 с.
Ахметов Н. С., А з и з о в а М. К., Б а д ы г и н а Л. И. Лабораторные и семинарские занятия по неорганической химии. - М.: Высшая школа, 1979.-255 с.
X о м ч е н к о Г. П. Практикум по общей и неорганической химии с применением полумикрометода. - М.: Высшая школа, 1980.- 335 с.
А б к и н Г. Л. Задачи и упражнения по общей химии,- М.: Высшая школа, 1971,- 264 с.
Гольбрайх З.Е. Сборник задач и упражнений по химии,- М.: Высшая школа, 1976,- 280 с.
Свиридов ВВ., Попкович Г. А, Васильева Г. И. Задачи, вопросы и упражнения по общей и неорганической химии. - Минск: БГУ, 1978 -352 с.
А й л е т т Б., Смит Б. Задачи и упражнения по неорганической химии. - М.: МГУ, 1967 - 223 с.
Зайцев О. С. Познавательные задачи по общей химии. - М.: МГУ, 1982.-182 с.
Воробьева О. И., Н е м к о в а О. Г., Т а м м И. С. Методические разработки по неорганической химии для студентов I курса,- М.: МГУ, 1971,-139 с.
Глинка Н. Л. Задачи и упражнения по общей химии. - Л.: Химия, 1988 - 274 с.
Воробьева О. И., Л а в у т Е. А., Т а м м И. С. Вопросы, упражнения и задачи по неорганической химии. - М.: МГУ, 1985,-175 с.
Л и д и н Р. А., А л и к б е р о в а Л. Ю., Логинова Г. П. Неорганическая химия в вопросах. - М.: Химия, 1991.- 252 с.
В и т и н г Л. М., Р е з н и ц к и й Л. А. Задачи и упражнения по общей химии. - М.: МГУ, 1995,- 218 с.
Же л и го в ска я Н. Н., Коренев Ю. М. Неорганическая химия в задачах и вопросах: Учебное пособие. - М.: МГУ, 1994,-137 с.
Будруджак П. Задачи по химии - М.: Мир, 1989,- 341 с.
Термические константы веществ / Под ред. В. П. Г л у ш к о . Вып. I- IV. - М.: Изд-во АН СССР, 1965-1972.
Гольбрайх 3. Е., М а с л о в Е. И. Сборник задач и упражнений по химии,- М.: Высшая школа, 1997,- 384 с.
ОТВЕТЫ НА ЗАДАЧИ
В нумерации ответов первая цифра указывает номер темы, вторая - номер задачи из подготовки к лабораторной работе или заданий для самостоятельной работы (для этих двух разделов в каждой теме введена сплошная нумерация).
