
- •Неорганическая химия
- •Часть I. Классификация и номенклатура неорганических соединений
- •Тема 1. Номенклатура неорганических соединений
- •1.2. Семинар 1. Классы и номенклатура неорганических соединений
- •Часть II. Химия неметаллов
- •Тема 3. Водород
- •3.1. Теоретическая часть
- •3.2. Семинар 3. Соединения водорода. Получение и применение водорода
- •3.3. Подготовка к лабораторной работе
- •3.6. Синтез гидрида кальция
- •Тема 4. Галогены
- •2. Окислительные свойства свободных галогенов
- •XCa(oci)2 · yCaCl2 · zCa(oh)2 · nН2o.
- •Тема 5 элементы главной подгруппы шестой группы
- •5.3. Сера и элементы подгруппы селена
- •5.3.1. Теоретическая часть
- •Тема 6. Элементы главной подгруппы пятой группы
- •Тема 7. Углерод. Кремний. Бор
- •7.2. Семинар 9. Углерод. Соединения кремния и бора
- •7.3. Углерод
- •Дициан цианистый цианамид циановый роданистый
- •7.4.3. Лабораторная работа. Кремний и его соединения
- •7.6. Синтезы соединений бора
- •7.7. Задания для самостоятельной работы
- •Приложение 4. Атомные радиусы:
- •Часть II
- •Часть III
Тема 6. Элементы главной подгруппы пятой группы
6.1. Общая характеристика главной подгруппы
У элементов главной подгруппы пятой группы (N, Р, As, Sb, Bi) пять валентных электронов находятся в состоянии ns2np3, где п принимает значения от 2 до 6. В подгруппе при переходе сверху вниз увеличивается радиус атома, ковалентность, координационное число, например по кислороду (NО− , РO43− , AsO43−, Sb(OH)6−); уменьшается энергия ионизации, электроотрицательность, способность атомов к образованию π-связей и к проявлению высшей степени окисления: фосфор чаще всего имеет степень окисления +5, мышьяк +5 или +3, для сурьмы характерна степень окисления +3 (редко +4) и для висмута чаще всего +3. Соединения пятивалентного висмута являются сильными окислителями.
В силу выше указанного изменения свойств атомов элементов в главной подгруппе пятой группы при переходе сверху вниз ослабевают неметаллические свойства элементов:
азот, фосфор типичные неметаллы, с островными молекулами N2, Р4, образующими молекулярную решетку образует почти металлические кристаллы с к.ч.= 6;
уменьшается термодинамическая стабильность соединений сводородом ЭН3, а соединений Э2O3, ЭС13 увеличивается;
равновесие
Э3+ + ЗН2O ⇆ ЭО33− + 6Н+
в кислой среде сдвинуто влево для висмута и сурьмы (в BiF3, Bi(NО3)3·5H2О, Sb2(SО4)3 эти элементы образуют катионы; в слабокислых растворах SbCl3 и ВiC13 гидролизуются с образованием ЭОС1); для азота(III) и фосфора(Ш) указанное равновесие сдвинуто вправо в силу их неметаллического характе-ра;
оксиды и гидроксиды трехвалентных элементов изменяют свой характер от кислотного (N2О3, HNО2) до основного (Bi2О3, Bi(OH)3).
6.2. Азот
6.2.1. Теоретическая часть
Структура внешнего электронного слоя атома азота имеет вид


 ↑
↑
↑
2p
↑
↑
↑
2p
 ⇅
2s
⇅
2s
Четыре валентные орбитали атома азота могут находиться в состоянии sp-, sp2-, 5р3-гибридизации; координационное число азота может принимать значения 2, 3, 4. Не исключается, что у атома азота за счет промотирования 2s-электрона в третий слой (n = 3) может образоваться пять неспаренных электронов и, соответственно, пять ковалентных связей (осуществлен синтез NOF3). Этот процесс промотирования требует меньшей затраты энергии (1570 кДж/моль), чем образование иона азота(IV) ( ̴ 1970 кДж/моль).
В отличие от других элементов (Р, As, Sb, Bi) азот легко образует кратные связи. Если другие элементы главной подгруппы пятой группы образуют молекулы Р4, As4, Sb4 с σ-связями, то для азота характерна двухатомная молекула :N≡N: с σ- и π-связями, с малым межъядерным расстоянием (1,094 А) и высокой прочностью связи (946 кДж/моль). Кратные связи образует азот с углеродом (C≡N), кислородом :N = O: (неспаренный электрон расположен на разрыхляющей орбитали).
Молекула азота N2 может выступать в качестве π-донорного лиганда, образуя при нормальных условиях комплексы, например состава [Ru(NH3)5N2]X2.
Для азота (в отличие от углерода) не характерно образование гомоцепей, так как связь N-N является слабой.
Основным водородным соединением азота является аммиак, водный раствор которого может быть описан формулой NH3· aq и равновесием
NH3 + Н2О ⇆ NH4+ + ОН+, К = [NH4+] [OH-] / [NH3] = 1,8·10−5.
Соли иона аммония и сильных кислот в водном растворе имеют слабо-кислую реакцию
NH4+ + H2О ⇆ NH3 + H3О+.
Так, в 1 моль/л растворе NH4Cl pH ̴ 4,7.
Кроме основных, восстановительных свойств аммиак за счет неподеленной пары азота проявляет донорные свойства к таким акцепторам, как протон, катионы d-металлов:
:NH3 + H+ ⇆ [NH4]+
4:NH3 + Cu2+ ⇆ [Cu(NH3)4]2+.
Известно большое количество соединений, которые можно рассматривать как производные аммиака, получающиеся замещением атомов водорода органическими или неорганическими радикалами. Так, гидразин
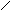
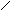
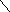 H
H
H
H


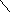
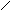

 N–N
N–N
H H
и гидроксиламин
гидроксиламин
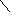 H
H


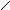 N–O–H
N–O–H
H
можно рассматривать как продукты замещения атомов водорода в NH3 на изоэлектронные группы -NH2 и -ОН соответственно. Основные свойства у этих соединений выражены слабее, чем у аммиака:
N2H4 + Н2О ⇆ N2H5+ + ОН−, К1= 8,5-10 −7;
N2H5+ + Н2О ⇆ N2H62+ + ОН−, К2 = 8,9-10 −15;
NH2OH + Н2О ⇆ NH3OH+ + ОН+, К1 = 6,6-10–9.
Гидразину, гидроксиламину, как и аммиаку, присущи восстановительные свойства.
Во многих отношениях схожи между собой жидкие аммиак и вода, например, схожи их реакции самоионизации:
2NH3 ⇆ NH4+ + NH2-, К = [NH4+][NH2-] ≈ 10−30 (–50оС);
2H2O ⇆ H3O + OH-, K = [H3O+][OH-] = 10−14 (25оC);
реакции взаимодействия с электроположительными металлами; схожи также производные аммиака и воды: NH4+Cl и Н3O+Сl− имеют кислотный характер; Na+OH-, Na+NH2-, Mg2+O2−, Mg32+ N3−2, Li+2NH2−, Li+2O2− – основной. Амид-, имид- и нитрид-ионы существуют в виде свободных ионов только в солях наиболее электроположительных металлов.
Хотя азотистоводородная кислота HN3 формально и является водородным соединением азота, но связь ее с NH3, N2H4 отсутствует, она проявляет свойства слабой кислоты (Кд = 1,8·10-5).
Азот, образуя соединения с ковалентным типом связи, проявляет при этом все возможные формальные степени окисления от –3 до +5 NH3(–3), N2H4(–2), NH2OH(–1), N2(O), N20(+1), NO(+2), HNO2(+3), NO2(+4), N2Os(+5). Положительные степени окисления азот проявляет в соединениях с фтором и кислородом.
Кислородные соединения азота представлены оксидами, кислородосодержащими кислотами и их солями.
Газообразная закись азота
+ _
:О = N = N:
¨ ¨
при комнатной температуре сравнительно нереакционноспособна. Молекулы NО и МО2 содержат по неспаренному электрону, но моноокись не ассоции-рована и бесцветна, a NO2 обнаруживает характерную для парамагнитных молекул ассоциацию, зависящую от температуры:
![]()
![]() N2O4
+ 61,5 кДж
N2O4
+ 61,5 кДж
бурый, бесцветный,
парамагнитный диамагнитный
В твердом состоянии существуют только молекулы N2О4, имеющие плоское строение


 О О
О О



![]()
Ö Ö
Окись азота NО мгновенно окисляется кислородом до NО2, с F2, Cl2, Вг2 образует нитрозилгалогениды NOГ.
Молекулы NO и NO2 довольно легко теряют неспаренный электрон (потенциал ионизации 9,5 и 9,91 эВ соответственно), образуя ионы нитрозония NO+ и нитрония NO2+.
Оксид азота(III) N2O3 при комнатной температуре малоустойчивое вещество, уже при 100 C образует NO и NO+2:
N2O3 ⇆ NO + NO2,
при 30°C представляет собой синюю жидкость, при 100°С – синие кристаллы, имеющие строение . .
O




 :Ö
= N -N
:Ö
= N -N
O
При пониженных температурах N2O3 в воде образует азотистую кислоту HNО2, которая в свободном состоянии не получена, водные растворы ее неустойчивы и при нагревании разлагаются :
3HNО2 = HNО3 + 2NО + Н2О .
Растворы азотистой кислоты готовят подкислением холодных растворов нитритов:
Ba(NО2)2 + H2SО4 = 2HNО2 + BaSО4.
В газовой фазе, где имеет место равновесие
NО + NО2 + H2О ⇆ 2HNО2,
азотистая кислота присутствует в двух формах
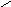
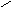
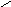
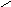 ..
O:
+
O
..
O:
+
O
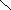 Н-О-N
⇆
H-N
_
Н-О-N
⇆
H-N
_
·· ·· O
Ион NO2− в методе валентных связей (ВС) можно рассматривать как резонансные гибриды:
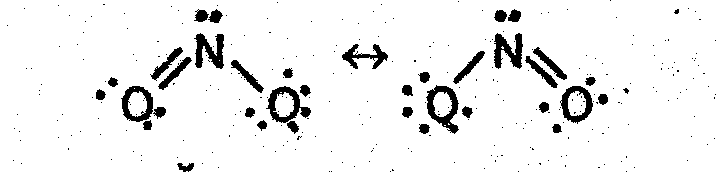
Поскольку в азотистой кислоте азот имеет промежуточную степень окисления (+3), то и кислота, и ее соли нитриты могут быть и восстановите-лями, и окислителями.
Оксиду азота(V) в газовой фазе можно приписать строение
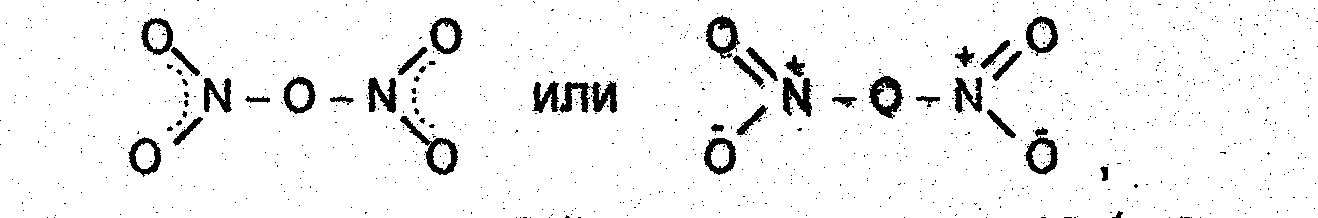
твердый N2O5 представляет собой нитрат нитрония NО2+NО3−.
Оксид N2О5 является ангидридом азотной кислоты
N2О5 + Н2О = 2HNO3.
Безводная HN03 подвергается самоионизации с образованием иона нитрония:
2HNО3 = NО2+ + NО3− + Н2О .
Концентрированная азотная кислота окисляет металлы (за исключением Pt, Rh, Ir и Аu) и неметаллы, пассивирует Fe, Сг, Al. В комплексных соединени-ях нитрат-ион может выступать в качестве моно- или бидентатного лиганда:
[Co(NH3)5NO3]2+, [Ce(NO3)6]2−.
6.2.2. Семинар 7. Азот, соединения азота
1. Получение и свойства молекулярного азота. Проблема связанного азота, круговорот его в природе.
Аммиак и его производные гидразин, гидроксиламин, их соли; получение, сравнение свойств; применение.
Азотная кислота, ее соли, получение и свойства. Азотные удобрения.
Упражнения
Постройте энергетические диаграммы МО, запишите электронные конфигурации основного состояния молекулы N2, ионов N2+ и N2−. Опреде-лите кратность связи в указанных частицах и сравните их стабильность.
Почему для азота в отличие от фосфора, мышьяка и сурьмы не характерна аллотропия?
В каком случае можно получить водород при взаимодействии метал-ла с азотной кислотой? Приведите примеры, дайте объяснения.
Объясните падение термической устойчивости в ряду безводных нитратов: нитраты щелочных металлов (575675°С); нитраты щелочно-земельных металлов (560575°С); нитраты двухвалентных кобальта, никеля, меди, цинка (2703500С) и бериллия (125°С); нитрат водорода HNО3 разлагается при обычных условиях на свету.
Какие свойства гидразина обуславливают возможность применения его в качестве ракетного топлива?
Как получается нитроний-ион и какова его роль в реакциях нитрова-ния ароматических углеводородов?
7. Расположите соединения N2H4, NH3, NH2OH, HN3 в ряд по ослаблению основных свойств в водном растворе. Дайте объяснения. Какой из разбавленных растворов одинаковой молярной концентрации указанных веществ имеет наименьшее значение рН?
Опишите в рамках модели локализованных атомных орбиталей строе-ние амидного иона NH2. Линейную или изогнутую структуру имеет этот ион?
Литература к семинару
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. 4.2. М.: Мир, 1969. С. 155193.
Спицын В. И., Мартыненко Л. И. Неорганическая химия. 4.1. М.: МГУ. 1991. С. 101131.
Некрасов Б. В. Основы общей химии. T.1. М.: Химия, 1973. С. 38206; 413437.
Р е м и Г. Курс неорганической химии. Т.1. М.: ИЛ, 1963. С. 633672.
А х м е т о в Н. С. Общая и неорганическая химия. М.: Высшая школа, 1988. С. 328347.
У г а й Я. А. Неорганическая химия. М.: Высшая школа, 1989. С. 246268.
Анорганикум. Т.1/Под ред. Л. Ко л ьд и ц а, М.: Мир,1984. С.529539.
X ь ю и Дж. Неорганическая химия. М.: Химия, 1987. С. 590592.
X а р д и Р., Б о т т о м л и Ф., Берне Р. Проблемы фиксации азота. М.: Мир, 1982. 734 с.
Коттон Ф., Уилкинсон Дж. Основы неорганической химии. М.: Мир, 1979. С. 327339.
Кемпбел Дж. Современная общая химии. Ч.1. – М.: Мир, 1975. С. 432473.
6.2.3. Подготовка к лабораторной работе
Написать уравнения реакций термического разложения солей аммо-ния: NH4NO3, NH4NO2, NH4CI, (NH4)2CO3, NH4H2PO4l (NH4)2Cr2O7. Указать, какие реакции разложения протекают обратимо, а какие практически необ-ратимы.
Как отличить оксид диазота от кислорода?
Что называется "царской водкой", каково ее действие на золото, платину? Привести уравнения реакций.
4. В каких случаях водный раствор аммиака нельзя использовать для осаждения труднорастворимых гидроксидов металлов? Привести примеры.
5. Написать уравнения реакций для трех различных методов получения NO, подобрать коэффициенты.
6. Почему нельзя путем упаривания увеличить концентрацию 70%-ного раствора азотной кислоты? Как это можно сделать?
7. Вычислить рН 0,2 моль/л раствора аммиака (Кд = 1,85∙10-5).
8. Какие вещества следует использовать в качестве осушителей газооб-образного аммиака? Какие меры безопасности следует соблюдать при работе с аммиаком?
9. Какую среду имеют водные растворы солей NH4NО3; (NH4)2SО4; NH4CH3COO; (NH4)2CО3?
10. Написать продукты реакций, подобрать коэффициенты:
NH3(г) + СаС12(т) →
NH3(ж) + Na →
Р + НNО3(конц.) →
NH2OH + KMnО4 + H2SО4 →
Zn + НNО3(очень разб.) →
HN3 + KMnО4 + H2SО4 →
N2О4(ж) + N2Н4(ж)
11. Используя закон эквивалентов, определить число граммов HNО3, необходимое для нейтрализации 50,0 г Ва(ОН)2.
12. Все оксиды азота реагируют с раскаленной медью, образуя оксид меди(Н) и свободный азот. Какова формула взятого оксида азота, если масса полученного СuО составляет 0,7105 г и объем азота равен 200 мл (н.у.)?
13. Составить краткий план выполнения лабораторной работы.
6.2.4. Лабораторная работа
Азот, водородные и кислородные соединения азота
Получение и свойства азота
Свободный азот одно из самых устойчивых химических веществ; его можно получить окислением соединений, где атом азота поляризован отрица-
-з
тельно (NH3); восстановлением соединений, где азот поляризован положитель-
+5
но (NaNО3); за счет внутримолекулярного окислительно-восстановительного процесса (NH4NО2); термическим разложением азида натрия NaN3 или азида бария Ba(N3)2 получают спектроскопически чистый азот.
П
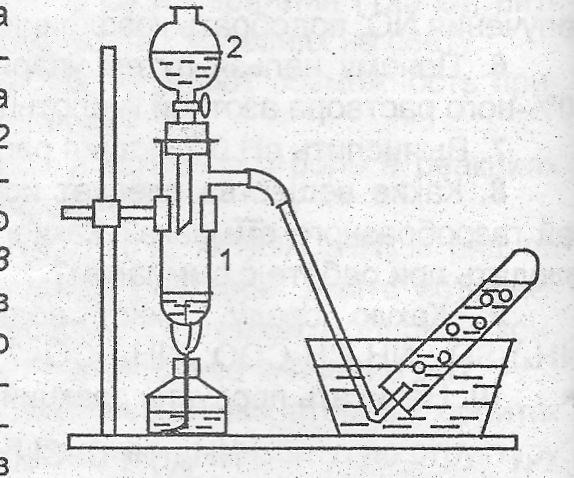 олучение
азота разложением нит-рита
аммония. Собрать
прибор
(рис.18), проверить его на
гермитичность. В пробирку 1 внести 3 мл
насыщенного раствора NaNO2,
из капельной воронки 2 влить 23
мл насыщенного раствора NH4Cl.
Нагреть смесь до 70800С,
собрать газ в пробирку 3 вытеснением
воды, опустить в пробирку горящую
лучинку. Что наблюдается? Составить
уравнение протекающих реакций. Показать
перемещение электронов в NH4NO2
при нагревании.
олучение
азота разложением нит-рита
аммония. Собрать
прибор
(рис.18), проверить его на
гермитичность. В пробирку 1 внести 3 мл
насыщенного раствора NaNO2,
из капельной воронки 2 влить 23
мл насыщенного раствора NH4Cl.
Нагреть смесь до 70800С,
собрать газ в пробирку 3 вытеснением
воды, опустить в пробирку горящую
лучинку. Что наблюдается? Составить
уравнение протекающих реакций. Показать
перемещение электронов в NH4NO2
при нагревании.
Рис. 18. Прибор для получения азота
2. Получение азота окислением аммиака. В пробирку 1 (рис.18) внести 1,52 г хлорной извести, из капельной воронки 2 по каплям прилить 45 мл концентрированного раствора аммиака. Выделяющийся газ собрать в пробир-ку над водой, проверить, поддерживает ли он горение.Записать свои наблюдения. Уравнение реакции уравнять методом полуреакций, указать окислитель и восстановитель.
3. Получение азота восстановлением нитрата. Поместить в сухую про-бирку 12 микрошпателя порошкообразного железа и 23 микрошпателя KNO3, смесь перемешать.
Рис. 19. Прибор для получения азота восстановлением нитрата
П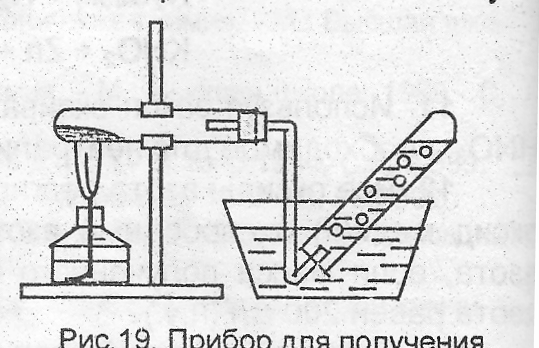 робирку
закрыть пробкой с загнутой кверху
отводной трубкой, укрепить в штативе
(рис. 19) и слегка нагреть. В собранный
над водой газ внести зажженную лучинку,
записать наблюдения и уравнение реакции.
робирку
закрыть пробкой с загнутой кверху
отводной трубкой, укрепить в штативе
(рис. 19) и слегка нагреть. В собранный
над водой газ внести зажженную лучинку,
записать наблюдения и уравнение реакции.
4. Окислительные свойства азота. Получение нитрида магния (опыт выполняется двумя студентами). Собрать прибор (рис. 20). В цилиндричес-ческую пробирку 1 насыпать смесь измельченных кристаллов бихромата калия (~ 4 г) и сульфата аммония (~ 2 г). Трубку 2 наполнить безводным просушенным CaCl2, в тугоплавкую трубку 3 поместить порошок магния (~ 0,5 г). Пробирку 1 осторожно нагреть на маленьком пламени горелки. Одновременно другой горелкой сначала осторожно, а затем сильнее в тече-ние 57 мин нагревать в токе азота порошок магния в трубке 3. После этого трубку охладить, отсоединить ее от прибора и извлечь полученный нитрид магния в пробирку, в которую внести затем несколько капель воды. Определить по запаху выделение аммиака, подержать над пробиркой влажную лакмусовую бумажку. Записать наблюдаемое и уравнения реакций. Какие свойства проявляет азот в реакции с магнием? Какую степень окисления имеет атом азота в нитриде магния Mg2N3? Какой реакцией подтверждается это?
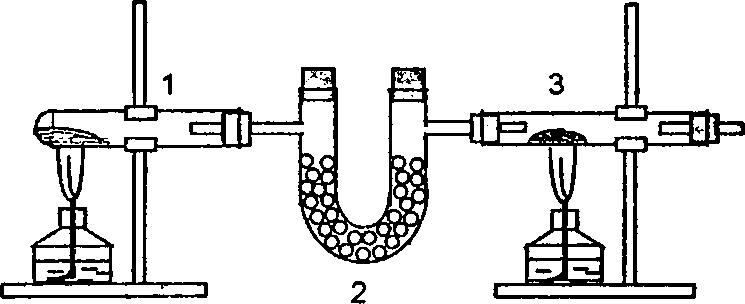
Рис.20. Прибор для получения нитрида магния
Получение аммиака, его свойства. Соли аммония
Получение аммиака вытеснением его из раствора соли аммония силь-ным основанием. В пробирку внести 2–3 капли раствора соли аммония, доба-вить столько же 1 моль/л раствора едкого натра(или калия). Слегка нагреть пробирку и над ее отверстием подержать влажную красную лакмусовую бу-мажку. По запаху и по изменению цвета лакмусовой бумажки убедиться в выделении аммиака и образовании ОН− -иона при его взаимодействии с водой.
6. Получение аммиака вытеснением из солей аммония сильным основанием при нагревании. В сухую пробирку 1 (рис.21) всыпать тщательно перемешанную смесь из 1–2 г хлорида аммония и 1–1,5 г гидроксида кальция, закрыть смесь тампоном из стекловаты, часть пространства пробирки заполнить небольшими кусочками оксида кальция (для чего?), закрыть пробирку пробкой с загнутой кверху газоотводной трубкой и укрепить в штативе.
На газоотводную трубку надеть сухую пробирку 2 для сбора аммиака, смесь осто-рожно нагреть. После наполнения пробир-ки аммиаком, не поварачивая, снять ее с трубку и закрыть пробкой, сохранить со-держимое пробирки для последующих опытов. Поднести к концу отводной труб-ки лакмусовую бумажку, смоченную во-дой, затем стеклянную палочку, смоченyю
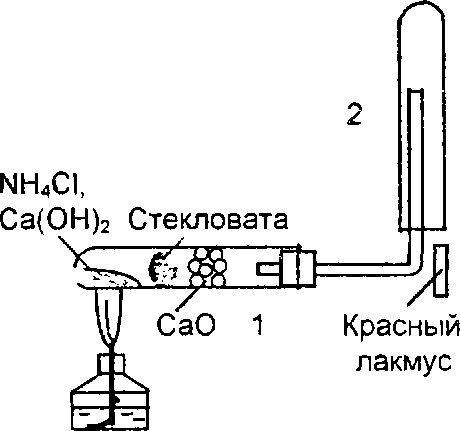
Рис.21. Прибор для получения аммиака
концентрированной соляной кислотой. Записать наблюдаемые явления и объяснить их.
7. Смещение равновесия в системе аммиак – вода. Полученный в преды- дущем опыте аммиак растворить в воде, раствор разлить в три пробирки. В две из них добавить по одной капле фенолфталеина; отметить окраску растворов и указать характер среды. Первую пробирку нагреть, а во вторую – внести 3–4 микрошпателя NH4CI, перемешать раствор, отметить изменение интенсивности окраски индикатора в обеих пробирках. К раствору аммиака в третьей пробирке по каплям прибавлять раствор Al2(SО4)3 до исчезновения запаха аммиака. Что наблюдается в третьей пробирке? Указать, в каком направлении и почему сдвигается равновесие в водном растворе аммиака
NH3 + H2O ⇆ NH4OH ⇆ NH4+ + OH−
при нагревании, при добавлении хлорида аммония или сульфата алюминия. В каком направлении и почему сместится равновесие в данной системе при добавлении раствора HCI?
8. Восстановительные свойства аммиака. В три пробирки внести раз-дельно по 3–4 капли растворов: а) бромной воды; б) перманганата калия; в) бихромата калия. В каждую из пробирок добавить по 3–5 капель 25%-ного раствора аммиака, растворы слегка подогреть до изменения их окраски. Написать уравнения соответствующих реакций, уравнять их методом полуреакций. Учесть, что аммиак в каждом случае окисляется до свободного азота, КМnО4 – восстанавливается до МnО2, а К2Сг2О7 – до Сг(ОН)3.
9. Донорные свойства аммиака, получение аммиаката никеля (II). К 1–2 мл раствора NiSО4 по каплям приливать разбавленный раствор аммиака до изменения окраски раствора. Каковы состав, окраска аммиакатного комплекса никеля в растворе? Записать выражение общей константы устойчивости комплексного катиона.
Получение солей аммония. Смочить дно и стенки стакана несколькими каплями концентрированной соляной кислоты. Стаканом накрыть тигель, содержащий 5–6 капель концентрированного раствора аммиака. Что наблюдается?
Гидролиз солей аммония. В три пробирки налить по 5–6 капель нейтрального раствора лакмуса, добавить в них по 2–3 микрошпателя кристаллов хлорида, нитрата и ацетата аммония растворы Перемешать. Отметить изменение окраски лакмуса в каждом случае. Написать в молекулярном и ионном виде соответствующие уравнения реакций гидролиза солей, указать среду раствора.
12. Отношение к нагреванию солей аммония. В четыре сухие пробирки поместить соответственно по 3–4 микрошпателя NН4CI, NH4H2PO4, (NH4)2CО3, (NH4)2Cr2О7. Закрепить поочередно пробирки в штативе и нагреть. Обратить внимание на образование белого налета на холодных стенках верхней части первой пробирки. Установить, какой газ выделяется при нагревании солей во второй и третьей пробирках. Объяснить бурное протекание реакции в четвертой пробирке. Как влияет природа аниона на характер термического разложения солей аммония? Какие соли аммония
возгоняются?
Свойства гидразина и гидроксиламина
Гидразин и гидроксиламин являются более слабыми основаниями, чем аммиак. Объясните этот факт.
13. Кислотно-основные свойства гидразина. С помощью универсального индикатора определить рН разбавленного раствора гидразингидрата. Сравнить среду растворов N2H4 и Н2О2 и способы образования их солей.
14. Восстановительные свойства гидразина. В пробирку внести несколь-ко капель подкисленного 1 моль/л раствором серной кислоты раствор КМnО4 и по каплям приливать раствор сульфата гидразония. Что наблюдается? Проверить, поддерживает ли выделяющийся газ горение. В другую пробир-ку внести несколько капель растворов соли меди(И), NaOH и сульфата гидра-зония, осторожно нагреть смесь. Записать наблюдения и уравнения реакций.
15. Окислительно-восстановительные свойства гидроксиламина. К подкисленным растворам KMnО4, FeSО4 и к водному раствору иода приба-вить по каплям раствор солянокислого или сернокислого гидроксиламина. Объяснить изменение окраски растворов, написать уравнения реакций, урав-нять их методом полуреакций. Какие свойства проявляет гидроксиламин в указанных реакциях?
Оксиды азота и их свойства
В оксидах азот проявляет положительные степени окисления: +1, +2, +3, +4, +5.
16. Получение и свойства оксида азота(I). Собрать прибор (см. рис. 19). Поместить в тугоплавкую пробирку 1-2 г нитрата аммония и осторожно наг-реть. Собрать над водой выделяющийся газ в три пробирки. Убедиться, что полученный газ не окрашивается в бурый цвет на воздухе в отличие от NО. В одну из пробирок внести разбавленный раствор КМnО4, подкисленный 1 моль/л раствором H2SO4, встряхнуть раствор с газом, если не произошло обес-цвечивание смеси, пропустить в нее еще N2O. В другую пробирку ввести тлеющую лучинку, убедиться, что закись азота при нагревании теряет кисло-род. В третью пробирку внести ложечку с горящим фосфором. Что наблюда-дается? Какие свойства проявляет закись азота в проделанных реакциях?
17. Получение и свойства оксида азота(II). Собрать прибор (рис.22). В колбу Вюрца 1 поместить 2-3 г медных стружеки прилить из капельной воронки 2-3г медных стружек и прилить из капельной воронки2 15 мл 33%-ного раствора НNO3. Если реакция будет идти слабо, следует немного подогреть колбу. Чем объяснить появление окраски в колбе? В две пробирки собрать оксид азота (II) методом вытеснения воды. Испытать, горят ли тлеющая лучинка и зажженная сера или уголь в нем.
Пропустить ток оксида азота(II) в
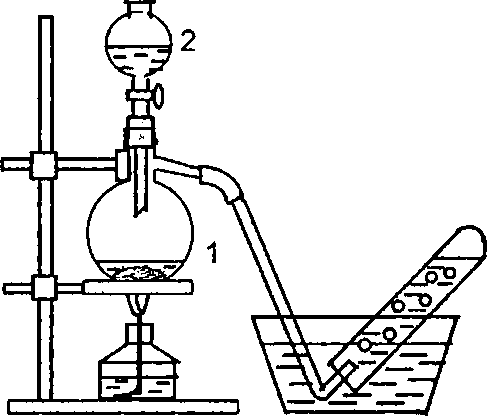 пробирку
с раствором NaOH, проверить
пробирку
с раствором NaOH, проверить
среду среду раствора. Растворяется ли
NO в проведенных реакциях?
18. Получение и свойства оксида
(IV). В колбу Вюрца положить 2–3 г
медных стружек, из капельной воронки
влить концентрированную HNO3, покрыв
стружки кислотой.
Рис.22. Прибор для получения
оксида азота (II)
Выделяющийся газ пропустить в пробирку с водой, определить с помощью индикатора характер среды. С помощью очень разбав-ленного раствора КМnO4 или KI определить присутствие иона NO2−, полученного за счет реакции диспропорционирования NO2 в воде. Пропустить NO2 в разбавленный раствор H2SO4 до кислой реакции по индикатору и определить наличие иона NO2−, как указано выше.
Набрав газообразный NO2 в две пробирки (как это сделать?), определить, горят ли в газе тлеющая лучина и зажженный красный фосфор. Написать уравнения проделанных реакций.
Получение и свойства азотистой кислоты
19. Получение азотистой кислоты в растворе. Растворить 2–3 микрошпа-теля нитрита калия в 2–3 мл воды, охладить раствор снегом и прибавить к нему 2–3 капли концентрированной серной кислоты. Что наблюдается? Объяснить большую термическую стабильность азотной кислоты по сравнению с азотистой при 0 ÷ +5 °С.
20. Окислительно-восстановительные свойства нитрит-иона. К 2–3 мл растворов КМnO4, К2Сг2O7 и KI (с 1–2 каплями раствора крахмала) прибавить по 2–3 капли 1 моль/л раствора H2SO4 и приливать по каплям раствор нитрита калия до изменения окраски растворов. Уравнять реакции методом полуреакций, указать роль азотистой кислоты
Свойства азотной кислоты и ее солей
Опыты с концентрированной азотной кислотой необходимо проводить в вытяжном шкафу, створки которого должны быть приспущены. При необходимости одеть очки и перчатки.
21. Фотохимическое и термическое разложение азотной кислоты. Объяснить окраску концентрированной азотной кислоты, стоящей на свету под тягой. Отметить усиление окраски конц.НNОз при слабом нагревании 2–3 мл ее в пробирке, укрепленной в лапке штатива. Опустить тлеющую лучинку в эту пробирку. Что наблюдается? Какие продукты получаются при разложении HNО3?
22. Окислительные свойства азотной кислоты. В четыре пробирки на-лить приблизительно по 1–1,5 мл концентрированной азотной кислоты, в две пробирки – разбавленной (2 моль/л HN03). Поочередно закрепляя пробирки вертикально в лапке штатива, выполнить следующие операции: в первую пробирку внести кусочек серы, пробирку осторожно нагреть, после оконча-ния реакции охладить и вылить в воду содержимое пробирки, обнаружить ион SО42−. Во вторую пробирку внести микрошпатель сульфида меди, по догреть пробирку, наблюдать растворение сульфида, проверить раствор на присутствие иона SО42−. В третью и четвертую пробирки внести по маленькому кусочку медной стружки и магниевой ленты соответственно. Что наблюдается? Эти же металлы внести в пробирки с разбавленным раствором HNО3, пробирку с медной стружкой слегка подогреть. В пробирке с магнием в 2 моль/л растворе HNО3 докажите образование ионов аммония. Как это сделать? Написать уравнения реакций, указать, как влияет активность металла и концентрация азотной кислоты на характер восстановления последней.
23. Получение "царской водки". В пробирку внести 3 капли концентри-рованной HNО3 и 9 капель концентрированной HCl (объемное соотношение HNО3 : HCI = 1 : 3). Смесь слегка нагреть, к отверстию пробирки поднести фильтровальную бумагу, смоченную KI. Что наблюдается? С каким продук-том "царской водки" взаимодействует KI?
24. Окислительное и комплексообразующее действие "царской водки". В фарфоровой чашечке приготовить 4 мл "царской водки" (HNO3 : HCl = 1 : 3). В другую фарфоровую чашечку влить 4 мл концентрированной HNО3. В обе ча-шечки осторожно внести по одному микрошпателю киновари (сульфида рту-ти), поставить их на песчаную баню и нагреть. Что наблюдается? Пользуясь величинами произведения растворимости сульфида ртути, общих констант устойчивости хлоридных комплексов ртути(II), объяснить лучшую раствори-мость сульфида в "царской водке".
25. Окислительные свойства нитрат-иона в щелочной среде. В тигель поместить по 510 капель 0,5 моль/л раствора KNO3 и концентрированного раствора щелочи. К смеси добавить 12 микрошпателя порошка апюминия ипи магния, тигель осторожно нагреть на асбестовой сетке, не доводя смесь до кипения. С помощью влажной лакмусовой бумажки убедиться в выделе-нии аммиака из реакционной смеси. При написании уравнений реакций учесть, что алюминий окисляется с образованием иона [AI(OH)4]−. В виде какого соединения в данном случае будет находиться магний? Дать объяс-нения
26. Термическое разложение нитратов. Поместить в три сухие тугоп-лавкие пробирки соответственно несколько кристалликов нитрата калия, нитрата свинца, нитрата серебра. Пробирки поочередно укрепить вертикально в штативе над чашкой с песком и нагреть. В первую пробирку с расплавленной натриевой селитрой осторожно внести кусочек раскаленного угля. Что наблюдается? Какой газ выделяется? Отметить окраску газообразных продуктов и твердых остатков при разложении нитратов свинца и серебра. Объяснить, почему разложение взятых солей проходит до разных продуктов: нитрита натрия, оксида свинца и метаплического серебра соответственно.
6.2.5. Дополнительные опыты
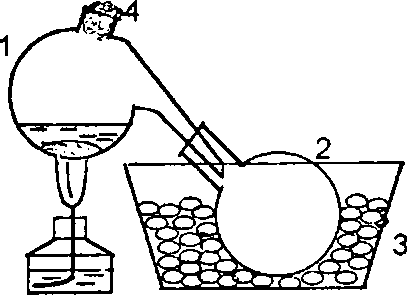
1. Взаимодействие оксида азота(II) с сульфатом железа(П). Этой реак-цией пользуются для собирания и очистки оксида азота(II). Опыт следует проводить под тягой! Подействовать разбавленной азотной кислотой (р = 1,2 г/см3) на медные стружки, помещенные в микроколбочку с газоотводной трубкой. Содержимое микроколбочки слегка нагреть. Выходящий оксид азота(II) пропускать до насыщения в свежеприготовленный раствор FeSО4. Наблюдать сильное изменение окраски раствора за счет образования нитрозоcер-нокислой соли железа(П) FeSО4·NО. Полученным раствором наполнить пробирку доверху и закрыть ее пробкой с газоотводной трубкой, предварительно заполненной водой (трубка должна оканчиваться у нижней поверхности проб-ки). Нагреть пробирку и выделяющийся бесцветный газ собрать над водой в приготовленную пробирку. Закрыв отверстие пробирки с газом пальцем, вынуть ее из ванны, поместить на фоне белой бумаги, перевернуть и отнять палец. Объяснить наблюдаемое. Дайте название соединению FeSО4· NО.
2. Получение азота из воздуха. Собрать прибор, изображенныйна рис. 23. Цилиндр 1 заполнить водой и, накрыв его стеклянной пластинкой, опрокинутьв ванну 2 с водой, так чтобы в него не попал воздух. Цилиндр закрепить в лапке штатива. В капельную воронку 3 укрепленную в пробке
заполненного воздухом цилиндра 4, налить воду.
Отводную трубку 5 соединить со стеклянной трубкой 6, в которой происходит реакция. Другой конец трубки 6 закрыть пробкой с газоотводной трубкой 7, ко-нец которой опустить в ванну с водой.
Все резиновые пробки должны быть хорошо притерты. Перед проведением опыта среднюю часть трубки 6 запол-нить медными стружками. Рядом с прибором поставить стакан с водой.
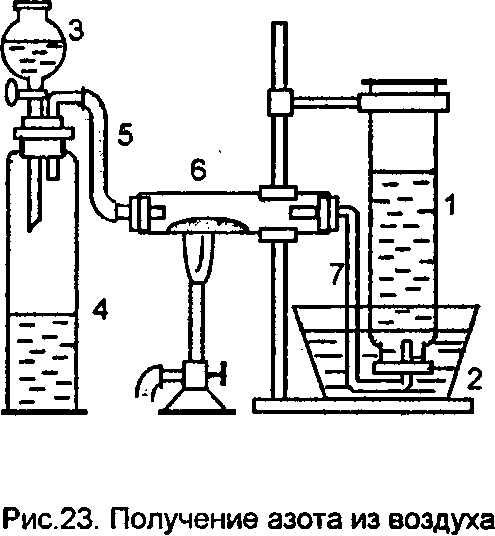
Рис. 23 Получение азота из воздуха
Выполнение опыта. Нагреть медные стружки сначала осторожно, затем сильнее, до красного каления, начиная нагревание с левого конца. Выделяю-щиеся пузырьки газа еще не следует собирать в цилиндр 1. Почему? Цилиндр 1 поместить над концом газоотводной трубки 7 только тогда, когда пузырьки газа перестанут выделяться. После этого, продолжая нагревание трубки 6, приступить к приливанию воды в цилиндр 4 сначала медленно, затем несколь-ко быстрее, так, чтобы в течение 20–25 мин прилить 250 мл воды (приблизи- тельно 1 капля в секунду). Следить за тем, чтобы в воронке 3 постоянно была вода, и приливать ее из стоящего около прибора стакана. В цилиндре 1 начина-ет собираться газ. Какой? После приливания 250 мл воды закрыть кран ворон-ки, не отнимая горелки от трубки 6, приподнять, не вытаскивая из воды, цилиндр 1, быстро вынуть газоотводную трубку 7 из ванны и только тогда отставить горелку. Обратить внимание на цвет продукта в трубке 6. Сравнить объемы прилитой воды и собранного в цилиндре газа. Объяснить, почему эти объемы не одинаковы. Какая реакция протекала в реакционной трубке 6? Исследовать полученный газ при помощи горящей лучинки.
Как получают азот из воздуха в промышленности? На производство каких химических продуктов он идет?
3. Термическое разложение нитратов. Опыт следует проводить под тягой! В пробирку 1 положить несколько микрошпателей кристаллов нитра-та меди(II) или нитрата свинца, растертого в ступке с равным объемом сухого песка, и подсоединить пробирку к прибору, изображенному на рис.24. Осторожно нагревать нитрат меди(II), а если отсутствуют признаки разложения вещества (изменение цвета, выделение газа), – нагреть сильнее. По окончании разложения вынуть газоотводную трубку из воды, сделать пробу газа, собранного в пробирке 2, с помощью тлеющей лучинки. Отметить цвет остатка в пробирке 1. Какое вещество собрано в U-образной трубке 3? Для чего U-об-разная трубка помещается в смесь льда с солью?
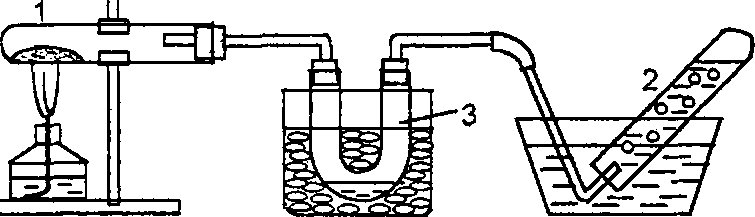
Рис.24. Прибор для термического разложения нитратов
6.2.6. Синтезы соединений азота
1. Получение оксида азота(Ш). Собрать прибор (рис.25). В маленькую колбу Вюрца 1 поместить 1–2 г крахмала, в капельную воронку налить 5 мл 50%-ного раствора HNО3. В U-образную трубку 2 поместить Р2О5, нанесенный на стеклянную вату, а U-образную трубку 3 поместить в охладительную смесь со льдом и солью. По каплям приливать азотную кислоту к крахмалу в колбе Вюрца, наблюдать сжижение N2О3 в охлажденной трубке, отметить его цвет. Если реакция протекает слабо, осторожно подогреть копбу Вюрца. Отсоединить приемник 3, вылить жидкость в стакан с охлажденной водой (0°С), отметить выделение газа, получающегося за счет реакции диспропорциониро-вания N2О3. С помощью растворов крахмала и KI доказать присутствие в растворе иона NО2-. Вместо приемника 3 присоединить U-образную трубку с раствором щелочи, пропустить через нее ток N2О3, доказать присутствие иона NО2- в растворе. Написать уравнения реакций.
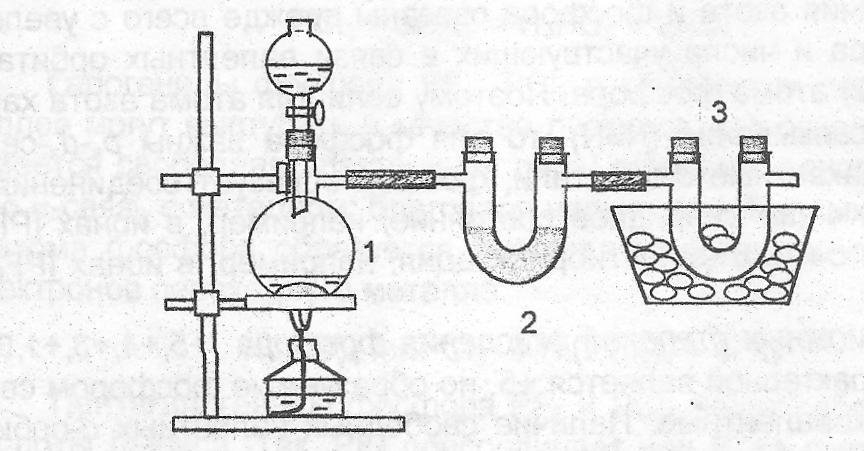
Рис.25. Прибор для получения оксида азота
2. Получение "дымящей" азотной кислоты. Собрать прибор (рис.26). В реторту 1 поместить 5 г нитрата натрия, соединить реторту с приемником 2, который опустить в ванну 3, где приемник может охлаждаться проточной водой или снегом. Через тубус 4 прилить 5мл 96%-ного раствора H2SО4, затем закрыть тубус асбестовой пробкой. Необходимо очень осторожно нагревать реторту, так как при нагревании наблюдается вспенивание реакционной массы. Азотная кислота отгоняется при нагревании смеси до 110–1200С. Когда в приемнике 2 соберется несколько миллилитров азотной кислоты, прекратить нагревание реторты, отсоединить приемник, закрыть его пробкой.
 Полученная
”дымящая” азотная кислота
Полученная
”дымящая” азотная кислота
представляет собой красно-бурую проз-рачную жидкость (плотность 1,56 г/см3), сильно дымящую на воздухе и притягива-ющую влагу; при –400С застывает в красную массу. При продолжительном про-пускании воздуха или СО2 через ”дымящую” азотную кислоту оксиды азота улетучиваются и остается обычная HNO3.
Рис.26. Прибор для получения
“дымящей” азотной кислоты
Приведите значения плотности, температуры кипения и плавления чистой HNO3, состав и температуру кипения азеотропной смеси азотной кислоты и воды.
6.3. Фосфор
6.3.1. Теоретическая часть
Конфигурация валентного электронного уровня атома фосфора 3s23p3. Отличия азота и фосфора связаны прежде всего с увеличением размера и чис
ла участвующих в связи валентных орбиталей (d-орбиталей) атома фосфора. Поэтому если для атома азота характерно pπpπ -связывание (N=N), то для фосфора важны pπ-dπ -связи. Используя вакантные d-орбитали, фосфор образует соединения не только с к.ч. 4 (sр3–гибридное состояние, например, в ионах [РН4]+, [РСl4]+, но и с к.ч. 6 (sp3d2 гибридизация, например, в ионах [PF6]−и [РСl6]−.
Из возможных степеней окисления фосфора (+5, +4, +3, +1, 0, –3) наиболее характерной является +5, но образуемые фосфором связи в основном ковалентные. Наличие свободных валентных d-орбиталей и неподеленных электронных пар у фосфора создает возможность возникновения между атомами фосфора не только σ-связи, но и дативной связи, что повышает прочность связи Р–Р по сравнению со связью N–N. Это находит отражение, в частности, в образовании различных аллотропических модификаций фосфора Р4, высокомолекулярных модификаций красного и черного фосфора.
С водородом фосфор образует фосфин РН3, который незначительно растворяется в воде, не проявляя при этом ни кислотных, ни основных свойств (константы диссоциации по кислотному и основному типам равны ~ 10−29 и 10−26 соответственно). При растворении в воде иодида фосфония РН4I наблюдается выделение РН3, так как амфолит вода как более сильное основание, чем фосфин, вытесняет это более слабое основание из его соли.
Второе водородное соединение фосфора Р2Н4

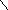 H
H
H
H

 P−P
P−P
H H
по стехиометрии напоминает гидразин N2H4 – производное аммиака.
Фосфиды – соединения фосфора с металлами и неметаллами(Na, Са, Fe, В, Si, As, S, Se). Фосфиды электроположительных металов (Mg3P2, Са3Р2, Na3P) легко гидролизуются водой
Мg3Р2 + 6Н2О = 3Мg(ОН)2 + 2РН3.
Фосфиды переходных металлов часто имеют нестехиометрический состав, тверды, электропроводны, термически устойчивы, химически инертны.
Галогениды фосфора(Ш) в отличие от взрывоопасных, эндотермичных галогенидов азота (за исключением NF3) экзотермичны, термодинамически стабильны; при действии воды сильно гидролизуются
РС13 + ЗН2О = Н3РО3 + 3HCl
Галогениды фосфора PF3, РС13 в комплексах переходных металлов могут выступать в качестве лигандов: как основания Льюиса (имеется свободная электронная пара) образуют донорно-акцепторную σ-связь с металлом; благодаря наличию свободных d-орбиталей у атома фосфора образуется также дативная связь с участием d-электронов переходного металла:
Ni(CO)4 + 4РС13 → Ni(PCI3)4 + 4СО
Пентагалогениды фосфора PF5 и РС15 ведут себя как сильные кислоты Льюиса. Так, PF5 присоединяет ион F− за счет использования одной незанятой гибридной d2 sp3-орбитали центрального атома и образует устойчивый комплексный ион PF6-
У пентахлорида отмечается "связевая" изомерия:
![]()
Твердый PBr5 состоит из ионов [PBr4]+Brˉ
Во всех оксокислотах фосфора атом водорода связей РОН способен к диссоциации, а атомы водорода связей Р−Н не диссоциируют:


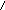
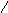
 H
OH HO OH HO OH
HO OH
H
OH HO OH HO OH
HO OH
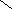

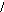 +1
+4 +4
+3
+5
+1
+4 +4
+3
+5









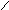 P
P -
P P P
P
P -
P P P
 H
O HO ∥
∥ OH
H O HO O
H
O HO ∥
∥ OH
H O HO O
O O
фосфорноватистая гипофосфорная фосфористая фосфорная
кислота кислота кислота кислота
рК1= 1,2 рК1= 1,8 рК1= 2,0
рК2= 6,2 рК1= 7,1
рК1= 12,3
Фосфорноватистая, фосфористая кислоты и их соли (гипофосфиты и фосфиты соответственно) обладают восстановительными свойствами
NiCI2 + NaH2PO2 + Н2O = Ni + NaH2PO3 + 2HCI,
HgCI2 + H3PO3 + H2O = Н3РO4 + Hg + 2HCI.
Оксид фосфора(III) Р4O6 медленно взаимодействует с водой, образуя фосфористую кислоту. При растворении в воде Р4O10, кроме ортофосфорной кислоты образуется смесь различных конденсированных фосфорных кислот (полифосфорных кислот).
Способность вступать в реакции конденсации является одним из харак-терных свойств фосфорной кислоты. При реакции конденсации происходит связывание двух нескольких молекул с образованием более крупных моле-кул, а небольшие молекулы, например Н2О, отщепляются.
К первому классу полифосфорных кислот (соли – полифосфаты) относят кислоты с открытыми цепочечными анионами из 2−10 атомов фосфора (Н4Р2О7, Н5Р3О10, H6 P4О13). Пирофосфорная (ди‑фосфорная) кислота

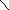 НО
ОН
НО
ОН

 Р
–
О –
Р
Р
–
О –
Р
НО ∥ ∥ ОН
О О
является представителем этого ряда. Эта сильная по двум ступеням диссоциации четырехосновная кислота (pK1 = 1,0; рК2 = 1,9; рК3 = 6,6; рК4 = 9,6) может быть получена в качестве одного из продуктов растворения Р4О10 в воде или конденсацией молекул ортофосфорной кислоты:
![]()
Пирофосфаты можно получить нагреванием гидрофосфатов
![]()
Раствор пирофосфата не коагулирует свежеприготовленный раствор яичного белка (свертывание белка идет лишь в присутствии полифосфатов с большим размером цепи); образует белый осадок Ва2Р2О7, нерастворимый в уксусной кислоте; образует белый Аg4Р2О7 растворимый в HNO3 и NH3.
Ко второму классу полифосфорных кислот относятся мета-фосфорные кислоты (НРO3)n, где n = 3, 4, 6; их анионы Р3О93−, P4O124−, P6O186− имеют циклическое строение, например:
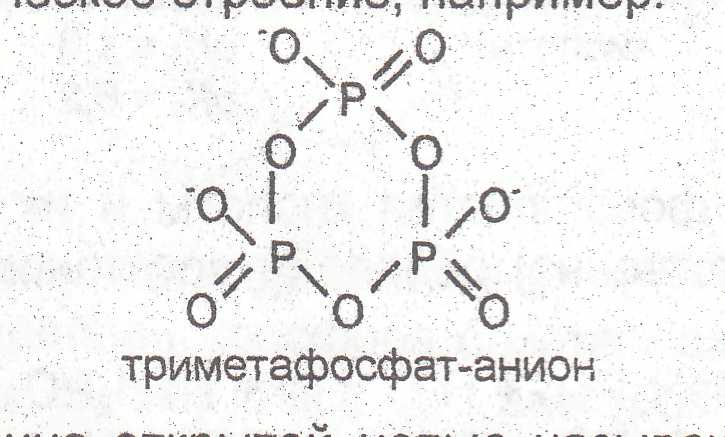
Триметафосфат-анион
Фосфаты с бесконечно открытой цепью называются полиметафосфатами
O- O- O-










 P
P P
P
P P
O ‖ O ‖ O ‖ O (PO-3 )∞
O O O
Полиметафосфорные кислоты образуются в водных растворах Р4О10 или по реакции конденсации при постепенном нагревании фосфорной кислоты
Н3Р04
![]() Н4Р2О7
Н4Р2О7
![]() (HPO3)x
(HPO3)x
Три-, гексаметафосфаты можно получить нагреванием дигидрофосфа- фатов:
NaH2PO4
![]() (NaPО3)3
(NaPО3)3
![]() (NaPО3)6
(NaPО3)6
Метафосфаты хорошо растворимы в воде; с ионами серебра дают белый осадок AgPO3. Циклические метафосфаты гидролизуются с образованием полифосфатов, конечным продуктом гидролиза является монофосфат-ион РO43− :
Na3P3О9 + Н2О = Na3H2P3O10,
Na3H2P3O10 + Н2О = Na3PО4 + Н4Р2О7,
Н4Р2О7 + Н2О = 2Н3РО4.
Подобно протекает гидратация летучей модификации Р4О10:

Переход полифссфорных кислот в ортофосфорную ускоряется кипячением раствора, а также в присутствии сильных кислот. Анионы РО43− можно обнаружить по образованию желтого осадка Ag3PО4 в нейтральном растворе, бледно-желтого осадка FePО4 который образуется в присутствии ацетатного буфера. "Молибденовая жидкость" образует с фосфатами желтый кристалли-ческий осадок фосфоромолибдата аммония и водорода:
РО43− + 3NН4+ + 12МоО42- + 24Н+ = (NH4)3H4[P(Mo2О7)6]↓ + 10Н2О.
Количественное определение фосфатов и магния можно осуществить осаждением MgNH4PО4∙ 6H2О.
Фосфаты и гидрофосфаты подвергаются гидролизу. Растворы средних фосфатов щелочных металлов имеют щелочную среду
РО43− + Н2О ⇆ НРО42− + ОН−.
Гидрофосфаты щелочных металлов также легко подвергаются гидролизу
НРО42− + Н2О ⇆ Н2РОˉ4 + ОНˉ,
рН их растворов приблизительно равен 10, так как указанный процесс гидро-лиза иона НРО42− преобладает над процессом его диссоциации
НРО42− ⇆ Н+ + РО43−.
Водные же растворы дигидрофосфатов щелочных металлов имеют слабокислую реакцию (рН = 4–5), так как процесс диссоциации
НРО42− ⇆ Н+ + НРО42−
проявляется сильнее процесса гидролиза
Н2РО4 + Н2О ⇆ Н3РО4 + ОНˉ.
В воде раствoримы все фосфаты щелочных металлов и дигидрофосфаты щелочноземельных металлов. Нерастворимые в воде среднее и кислые фосфаты металлов хорошо растворяются в минеральных кислотах, большинс-тво из них растворяется и в уксусной кислоте (за исключением FePО4 BiPО4, Pb3(PО4)2).
В водном растворе гидрофосфата (Na2HPo4) присутствуют в равновесии ионы НРО42−, Н2РО4−, РО43− с преобладающей концентрацией гидрофосфат-иона НРО4ˉ. Катионы некоторых d-элементов (Ag+, Fe3+), р-элементов (Bi3+, Pb2+), дающие прочные фосфатные комплексы и плохорастворимые фосфаты, вытесняют протон из иона НРО4ˉ и образуют средние фосфаты:
3Аg+ + 2НРО42− = Аg3РO4↓ + Н2РO4ˉ.
В случае катионов щелочноземельных металлов, образующих менее прочные комплексы с фосфат-ионом, протон из иона НРO42− не вытесняется и образуется осадок гидрофосфата:
Na2HPО4 + ВаС12 = ВаНРО4 + 2NaCl.
6.3.2. Семинар 8. Фосфор, элементы подгруппы мышьяка
Сравнительная характеристика элементов главной подгруппы пятой группы, закономерности в изменении кислотно-основных, окислительно-восстановительных свойств в рядах однотипных соединений трех- и пятива-лентных р-элементов пятой группы, в гидролизе соединений ЭГ3, NaЭО2, ЭГ5, Na3ЭО4 (Э–N, Р, As, Sb, Bi).
Фосфорная кислота, свойства, получение в промышленности. Поли-фосфорные кислоты, полифосфаты, получение, свойства.
Сульфиды трех- и пятивалентных элементов подгруппы мышьяка. Получение, свойства, применение в аналитической химии.
Упражнения
Проанализируйте изменение величины атомного радиуса, энергий ионизации Е1, Е2, Е3, электроотрицательности в ряду элементов N–Р–As–Sb–Bi (приложения 4, 6, 7).
На примере реакций взаимодействия простых веществ с концентрированной и разбавленной HNО3 проиллюстрируйте нарастание металлических свойств в ряду фосфор – висмут.
Чем объяснить, что получены соединения PCl5, SbCl5, а не получены NCl5, AsCl5 (синтез AsCl5 осуществлен лишь в матрице)?
Укажите на сходства и отличия в химии фосфора и мышьяка. Приведите примеры изоморфизма между соединениями указанных элементов.
Как изменяется термодинамическая стабильность в ряду NH3−РН3− AsH3−SbH3−BiH3 ? Укажите также, как изменяется в указанном ряду сродство к протону в водном растворе.
Укажите, как изменяется степень гидролиза в ряду РС13−AsCl3 −SbCl3 −BiCl3 и сделайте вывод о характере изменения кислотно-основных свойств соединений указанных р-элементов. Как изменяется восстановительтельная способность в указанном ряду?
Сравните температуры правления и кипения, термодинамическую устойчивость, восстановительные и электронодонорные свойства аммиака и фосфина. Дайте объяснения.
Почему NCl3 является неустойчивым взрывчатым веществом (взрыва-ется при температуре ~ 90 °С), а РС13 устойчиво? Дайте объяснения. Напиши-те уравнения гидролиза указанных соединений.
Каково значение эфиров фосфорной кислоты в биологических системах? Как протекает их гидролиз?
Объясните, почему азотная кислота является сильной кислотой, а фосфорная – кислотой средней силы.
Литература к семинару
1. Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. 4.1. – М.: Мир, 1969. – С. 339–374.
2. С п и ц ы н В. И., М а р т ы н е н к о Л. И. Неорганическая химия. 4.1. – М.: МГУ, 1991. – С. 131–147.
3.Некрасов Б. В. Основы общей химии. Т.1. – М.: Химия, 1973. – С. 437–478.
4. А. Р е м и Г. Курс неорганической химии. T.1. – М.: ИЛ, 1963. – С. 625–633; 672–735.
А х м е т о в Н. С. Общая и неорганическая химия. – М.: Высшая школа, 1988. – С. 347–371.
У г а й Я. А. Неорганическая химия. – М.: Высшая школа, 1989. – С. 268–299.
7.Коттон Ф., Уилкинсон Дж. Основы неорганической химии. – М.: Мир, 1979. – С. 340–355.
6.3.3. Подготовка к лабораторной работе
14. Какие меры предосторожности необходимо соблюдать при работе с белым и красным фосфором? Как обезвредить посуду после работы с фосфором? Потому нельзя смешивать (особенно растирать) красный фосфор с КСl3, KMnO4, Na2O2? Написать соответствующие уравнения реакций
15. Сколько моль эквивалентов содержится в моле Н3РO4:
а) когда кислота реагирует с NaOH с образованием NaH2PO;
б) когда Н3РO4 танавливается до Н3РO ?
16. При температуре 800 oС плотность паров фосфора по отношению к воздуху составляет 4,27, а при 1500 oС она уменьшается вдвое. Из какого числа атомов состоит молекула фосфора в обоих случаях? Какой процесс происходит в интервале указанных температур.
17. Как определить, фосфорная или фосфористая кислота находится в растворе?
18. Привести примеры реакций окисления, восстановления и диспропорционирования фосфора. Объяснить, почему галогены, сера и фосфор диспропорционируют при взаимодействии со щелочами
19. Как можно объяснить свечение белого фосфора?
20. Сколько килограммов 70%-ной H2SO4 нужно взять для получения фосфорной кислоты из 200 кг фосфорита, содержащего 70% трехзамещенного фосфата кальция?
21.Охарактеризовать термическую устойчивость, летучесть, окислитель-ную способность и силу H3PO4.
22. Какими качественными реакциями можно различить мета-, орто-, пи-рофосфорную кислоты и их соли? Написать уравнения реакций.
23. Пользуясь табличными данными и соотношениями
∆Go = – RTlnKp,
Kc = Kp(RT) ∆n
(∆n – изменение числа молей в результате реакции), вычислить значения Кр и Кс при стандартных условиях в системе
РС15(г) ⇆ РС13(г) + С12(г)
и сделать вывод об устойчивости в таких условиях пентахлорида фосфора.
24. Написать уравнения реакций, подобрать коэффициенты:
Р + NaOH →
РН3 + КМnO4 + H2SO4 →
Р + NH4ClO4 → N2 +Cl2 + ...
NH4H2ClO4
(т)
![]()
AgNО3 + РН3 + Н2O →
NaNH4HPO4
![]()
25. Составить план выполнения лабораторной работы.
6.3.4. Лабораторная работа. Фосфор и его соединения
Получение, свойства белого и красного фосфора
Поскольку белый фосфор состоит из островных молекул Р4, а красный фосфор построен из молекул Р4, соединенных в бесконечные цепи, то белый фосфор устойчив при повышенной температуре, когда затруднена полимеризация, а красный фосфор устойчив при более низких температурах.
Все опыты с фосфором выполнять под тягой, посуду после работы обезвредить.
1. Получение белого фосфора. Небольшое количество (менее микрошпателя) сухого красного фосфора поместить в сухую пробирку, закрыть ее ватным тампоном, укрепить в штативе, медленно нагревать снизу пробирку слабым пламенем горелки так, чтобы красный фосфор превращался в пар. Обратить внимание на образование капель белого фосфора на стенках пробирки. Охладивпробирку, проверить свечение в темноте белого фосфора. Записать термохимическое уравнение перехода Рбел → Ркр. Какая из указанных модификаций является термодинамически более стабильной? Указать условия перехода (температура, действие света катализаторы) белого фосфора в красный и обратно.
2. Сравнение температур плавления и реакционной способности белого и красного фосфора. Удерживая пинцетом белый фосфор под водой, отрезать кусочек величиной с малую горошину, быстро осушить фосфор фильтровальной бумагой, лежащей на стекле, и поместить его на край железной или медной пластинки, находящейся на кольце штатива. На второй край пластинки поместить приблизительно такое же количество красного фосфора, пластинку затем нагреть посередине пламенем горелки. Что наблюдается? Указать температуры плавления и воспламенения белого и красного фосфора. Чем объясняется различная активность белого и красного фосфора по отношению к кислороду воздуха?
3. Растворимость фосфора в сероуглероде. Опыт готовится одним сту-дентом и демонстрируется в группе. Необходимо помнить о том, что серо-углерод CS2 ядовит, легко воспламеняется, дает взрывчатые смеси с воз-духом, при работе с ним под тягой горелки должны быть погашены. В две сухие фарфоровые чашечки внести по 2–3 мл сероуглерода, поместить в одну из них маленький кусочек белого фосфора, во вторую – немного красного фосфора. Что наблюдается? Держа щипцами небольшой кусочек фильтровальной бумаги, смочить ее раствором белого белого фосфора в сероуглероде; что происходит с бумагой на воздухе? Запишите свои наблюдения.
Соединения фосфора с водородом
Основным водородным соединением фосфора является фосфин РН3. Ра-боты с ним необходимо проводить под тягой, так как он очень ядовит и самопроизвольно воспламеняется на воздухе.
Получение и свойства фосфина (опыт выполняется двумя студентами для всей группы). В круглодонную колбу емкостью 100 мл внести 40 мл 30%-ного раствора КОН, в раствор опустить кусочек величиной (~ 1г) белого фосфора, добавить 3–4 мл этилового эфира (объяснить для чего). Закрыть колбу резиновой пробкой с газоотводной трубкой, конец которой опустить в крис-таллизатор с водой. Слабым пламенем горелки осторожно нагревать колбу, доведя постепенно ее содержимое до кипения. Отметить самопроизвольное воспламенение над водой выделяющегося фосфина. Пропустить фосфин в две пробирки, содержащие воду и раствор NiSО4. В первой пробирке с помощью индикатора установить среду раствора. Что наблюдается в пробирке с NiSO4? Сравните поведение фосфина с поведением аммиака в ре акциях с водой и сульфатом никеля (II).
Соединения фосфора с галогенами
Учитывая различия в свойствах хлоридов фосфора (РСl3 – бесцветная дымящая жидкость с температурой кипения 76 оС, PCl5 – желтовато-белое вещество с температурой возгонки 159 оС), при хлорировании красного фосфо-фора можно создать условия преимущественного выхода РС13 или PCI5.
Получение трихлорида и пента-
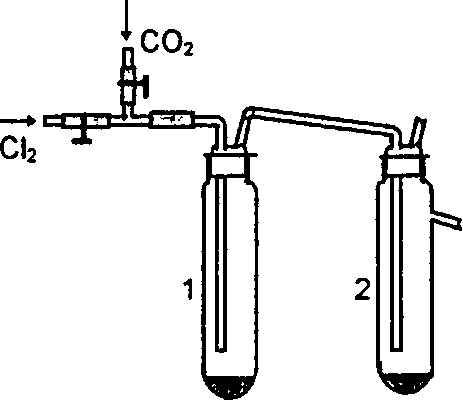 хлорида
фосфора.
хлорида
фосфора.
Собрать прибор (рис. 27.). В пробирки
1 и 2 поместить по 0,2 г сухого красного
фосфора. Из прибора сначала необходимо
вытеснить воздух сухим углекислым газом, а затем заполнить его сухим хлором. Регу-лируя пламенем горелки нагревание фосфо-ра в обеих пробирках и скорость поступле- ния хлора с помощью зажима, получить в одном приемнике РС13, в другом – PCI5.
Рис. 27. Прибор для получения
РС13иPCI5
После окончания реакции хлор из прибора вытеснить углекислым газом, отсоединить пробирки с продуктами и плотно закрыть их пробками, сохранить для последующих опытов.
6. Гидролиз трихлорида фосфора, восстановительные свойства фосфористой кислоты. По каплям внести небольшое количество полученного РС13 в дистиллированную воду, отметить выделение газа (какого?). Полученный раствор разделить на три части. В одной пробирке с помощью индикатора установить характер среды. Во второй пробирке нейтралйзовать раствор до слабокислой реакции и прилить несколько капель раствора AgNO3, отметить появление черного осадка серебра. В третью пробирку прибавить несколько капель разбавленного раствора КМnО4, отметить, что при этом происходит. Написать уравнения реакций.
7. Гидролиз пентахлорида фосфора. Внести небольшое количество полулученного РС15 в дистиллированную воду. Отметить выделение газа. Поднести к отверстию пробирки синюю лакмусовую бумажку, смоченную водой. Что наблюдается? С помощью качественных реакций (каких?) определить присутствие в растворе ионов РО43− и Сl−. Что получается при гидролизе РС15?
Получение и свойства оксокислот фосфора(V), их соли
Различные оксоанионы фосфора(V) обнаруживают по образованию в нейтральных растворах белых осадков AgPO3 и Аg4Р2O7, а также желтого осадка Ag3PO4. Белок коагулирует в присутствии полиметафосфатов с открытой цепью.
8. Получение метафосфорной кислоты. Растворить в воде ~ 0,1 г Р2О5, испытать действие полученного раствора на водный раствор белка. Что наблюдается? Дать объяснения, указав, какие формы фосфорных кислот находятся в водном растворе Р2О5.
9. Получение пирофосфорной кислоты. Поместить в фарфоровую чашеч-ку 2–3 мл концентрированной фосфорной кислоты, на песчаной бане довести ее до сиропообразного состояния, затем нагреть до 240 оС. К одной части водного раствора полученного продукта, аккуратно нейтрализованной раствором NaOH, прибавить раствор AgNО3, ко второй части – раствор яичного белка. Записать наблюдения и уравнения всех реакций.
10. Получение ортофосфорной кислоты из фосфорного ангидрида. В 3–4 мл дистиллированной воды внести микрошпатель Р2О5, добавить несколько капель разбавленной H2SO4 и раствор прокипятить. В горячий раствор вносить по каплям "молибденовую жидкость" до появления желтого осадка. Какие формы фосфорных кислот имеются в водном растворе P2O5 и как влияет нагревание и увеличение концентрации протонов на состав раствора? Написать уравнения реакций получения ортофосфорной кислоты гидролизом других оксокислот фосфора(V).
11. Получение ортофосфорной кислоты из фосфора. В маленькую фар-форовую чашечку внести 0,1 г красного фосфора, малыми порциями прилить под тягой 10 мл концентрированной азотной кислоты. Чашечку поставить на кипящую водяную баню, после окончания реакции и удаления избытка HNO3 упариванием доказать качественными реакциями с AgNO3, "молибденовой жидкостью" присутствие иона РО3−4.
При проведении качественной реакции с AgNO3 полученный раствор необходимо нейтрализовать гидроксидом натрия до нейтральной реакции. Полулученный осадок Ag3PO4 разделить на две части и испытать его на растворимость в 1 моль/л растворе HNO3 и растворе аммиака. Написать уравнения проделанных реакций.
12. Гидролиз растворимых солей ортофосфорной кислоты. С помощью универсального индикатора определить рН растворов одно-, двух- и трехза-мещенных ортофосфатов натрия. Объяснить характер среды их растворов.
13. Получение, растворимость солей кальция и ортофосфорной кислоты. В три пробирки внести по 3–4 капли раствора хлорида кальция, прибавив в первую пробирку три капли раствора аммиака. Затем в две первые пробирки прилить по три капли раствора Na2HPО4, а в третью – 3 капли раствора NaH2PО4. Что наблюдается в каждой пробирке? Испытать растворимость осадков (после их отделения от маточника центрифугированием) в 2 моль/л растворах соляной и уксусной кислот.
14. Получение фосфатов железа(Ш) и алюминия. В две пробирки внести по 3–4 капли растворов солей FeCl3 и AlCl3 и добавить в каждую из пробирок по 2–3 капли растворов ацетата натрия и Na2HPO4. Отметить цвета выпавших средних фосфатов металлов, испытать их отношение к 1 моль/л растворам соляной и уксусной кислот. Указать роль ацетата натрия в реакции получения фосфатов железа и алюминия.
15. Отношение ортофосфатов к нагреванию. Прокалить в фарфоровой чашечке микрошпатель NaH2PО4 до полного разложения соли (проба водного раствора части продукта разложения на отсутствие желтого осадка Ag3PО4). Продукт разложения охладить, растворить в воде, по качественным реакциям определить, соль какой фосфорной кислоты (мета-, пиро- или ортокислоты) образовалась в результате нагревания NaH2PО4. То же самое проделать с двухзамещенным фосфатом Na2HPО4, и определить продукт его термическогоразложения.
16. Получение "фосфатных перлов". На три предметных стекла положить кристаллы NaNH4HPО4∙4H2O, растертый в порошок Co(NO3)2∙ 6H2O и порошок СuО. Пламенем горелки нагреть платиновую проволочку с петлей на конце, коснуться ею кристаллов двойного гидрофосфата, приставшие кристаллы нагревать в пламени до их разложения и образования перла метафосфата нат-рия. Горячим перлом коснуться соли кобальта, смесь нагреть в окислительном пламени горелки. Отметить цвет горячего и охлажденного перла. Очистив платиновую проволочку, повторить опыт, взяв вместо соли кобальта оксид меди. Написать уравнения реакций разложения двойного гидрофосфата натрия у аммония, взаимодействия полученного метафосфата натрия с нитратом кобальта и оксидом меди с образованием двойных солей орто-фосфорной кислоты.
6.3.5. Дополнительный опыт
Свойства фосфорной кислоты как электролита средней силы. Фосфорная кислота в водном растворе диссоциирует в три ступени:
H3PO4
⇆
H+
+ H2PO![]()
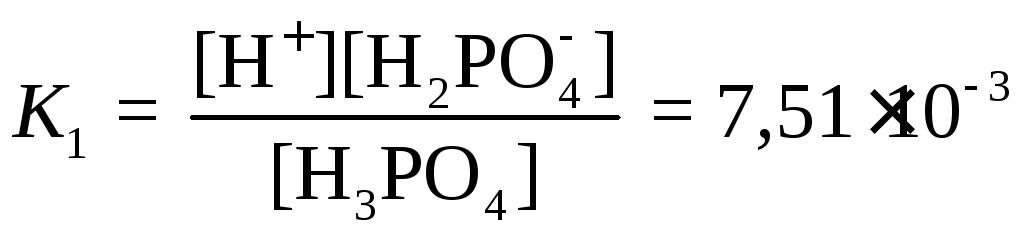 ,
,
H2PO4−
⇆
H+
+ HPO![]()
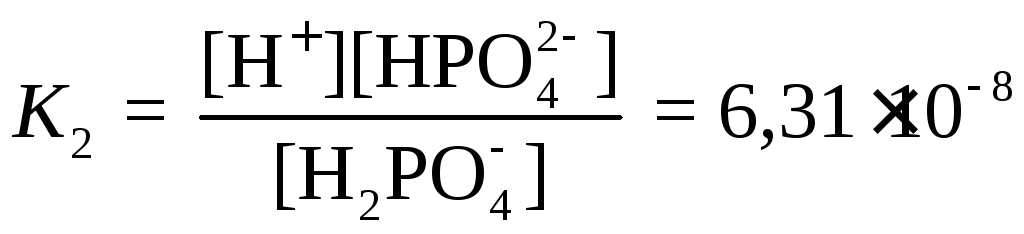 ,
,
HPO![]() ⇆
H+
+ PO
⇆
H+
+ PO![]()
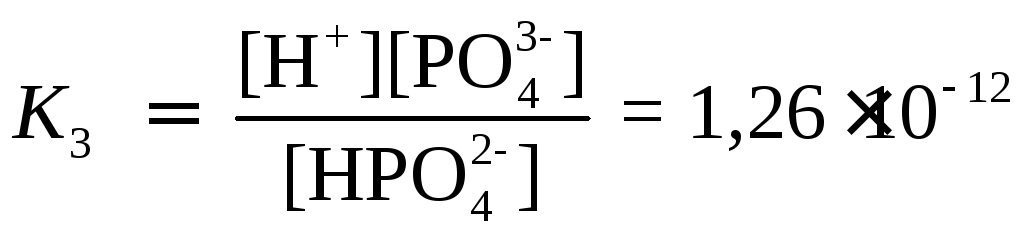 ,
,
т.е. рК1 = 2,12; рК2 = 7,20; рК3 = 11,90 (рКi = – lg Кi).
Из величин констант диссоциации видно, что диссоциация Н3РO4 по первой ступени является главным источником протонов в растворе кислоты. Вторая и третья ступени диссоциации идут в меньшей степени, так как ионы Н+ образующиеся в результате первой реакции, сдвигают равновесие второй и третьей реакций влево.
При
титровании Н3РО4
раствором КОН сначала нейтрализуются
ионы Н+,
образующиеся по первому уравнению, и в
точке эквивалентности этой реакции
происходит скачок. При дальнейшем
титровании нейтрализуются ионы Н+,
образующиеся при
диссоциации
иона Н2РO![]() ,
и в точке эквивалентности
этой реакции наступает второй скачок.
Третьего перегиба кривой титрования
Н3РO4
практически нет,
так
как щелочности (рН) растворов КОН и
Na3PO4
близки.
,
и в точке эквивалентности
этой реакции наступает второй скачок.
Третьего перегиба кривой титрования
Н3РO4
практически нет,
так
как щелочности (рН) растворов КОН и
Na3PO4
близки.
Ортофосфорную кислоту Н3РО4 можно титровать как одноосновную кислоту до рН ~ 4,6, поскольку
![]()
Или как двухосновную кислоту – до рН 9,6, так как
![]()
При титровании многоосновных кислот необходимо использовать те индикаторы, которые соответствуют каждой константе ступенчатой диссоциа-ции. Поскольку на рН перехода оказывают влияние солевые эффекты, то при титровании кислоты с индикатором раствор сравнения должен содержать одно- или двузамещенный фосфат натрия соответственно и индикатор.
Конечная точка титрования Н3РО4 как одноосновной кислоты (рН 4,6) соответствует переходу окраски бромкрезолового зеленого или метилового оранжевого. Конечная точка титрования фосфорной кислоты как двухосновной (рН 9,9) соответствует окраске фенолфталеина, почти полностью находящегося в красной форме.
Свойства фосфорной кислоты как электролита средней силы хорошо видны из кривой рН-потенциометрического титрования ее раствора раствором щелочи.
Приготовить
~ 0,1 моль/л раствор Н3РО4
из концентрированной фосфорной кислоты,
предварительно измерив ареометром
плотность последней и по таблицам
установив массовое содержание Н3РО4.
Приблизительно 0,1 моль/л раствор NaOH
приготовить
из его насыщенного раствора (~ 20 моль/л),
хранящегося в парафинированной
склянке. Такой раствор гидроксида натрия
не содержит иона СО![]() .
Точную концентрацию раствора гидроксида
натрия установить, титруя им
рН-потенциометрически (до рН–9)
определенный объем 0,1 моль/л раствораHCI,
приготовленного
из фиксанала. Перемешивание титруемого
раствора вести током азота, не содержащим
СО2.
.
Точную концентрацию раствора гидроксида
натрия установить, титруя им
рН-потенциометрически (до рН–9)
определенный объем 0,1 моль/л раствораHCI,
приготовленного
из фиксанала. Перемешивание титруемого
раствора вести током азота, не содержащим
СО2.
Отмерить пипеткой 10 мл ~ 0,1 моль/л раствора Н3РО4 и так же, как и раствор HCl, титровать раствором NaOH известной концентрации, записывая показания рН–метрапосле каждого прибавления определенного объема раствора NaOH (0,2 мл) и тщательного перемешивания смеси азотом, очи-щенным от СО2. Титрование вести до рН ~ 12.
По результатам титрования построить кривую зависимости рН – Vщел, дать объяснение хода кривой титрования, вычислить по ней молярную концентрацию фосфорной кислоты.
6.3.6. Синтезы соединений фосфора
1. Получение фосфорного ангидрида. Собрать прибор (рис.28).
Все части прибора должны быть сухими. К трехгорлой склянке 1 подсоединить хлоркальциевую трубку 2, заполненную безводным CaCl2, и промывную склянку 3, со-единенную с водоструйным насо-сом 4. В ложечку для сжигания положить красный фосфор, под-жечь его пламенем горелки и внес-ти в трехгорлую склянку. Вклю-чить водоструйный насос.
Рис.28. Прибор для получения
фосфорного ангидрида
Осевшее в склянке вещество быстро собрать в сухой бюкс, закрыть его крыш-кой и поместить в кристаллизатор. Часть полученного Р4О10 растворить в воде и качественными реакциями (какими?) доказать присутствие фосфорной кислоты
Фосфорный ангидрид – белая рыхлая масса, tnn = 563 оС (под давлением); под атмосферным давлением возгоняется при 347 °С. Фосфорный ангидрид является сильно полимеризованным веществом, в интервале температур 670–1100 оС его молекулярная масса отвечает формуле Р4О10. Ангидрид жадно поглощает воду, так как давление водяного пара над ним очень низко (1∙10−5 мм рт.ст.).
2. Получение фосфористого ангидрида. Собрать прибор (рис.29). В про-мывную склянку 1 налить вазелинового масла, в U- образную трубку 2 поместить кусочки высушенного хлорида кальция.
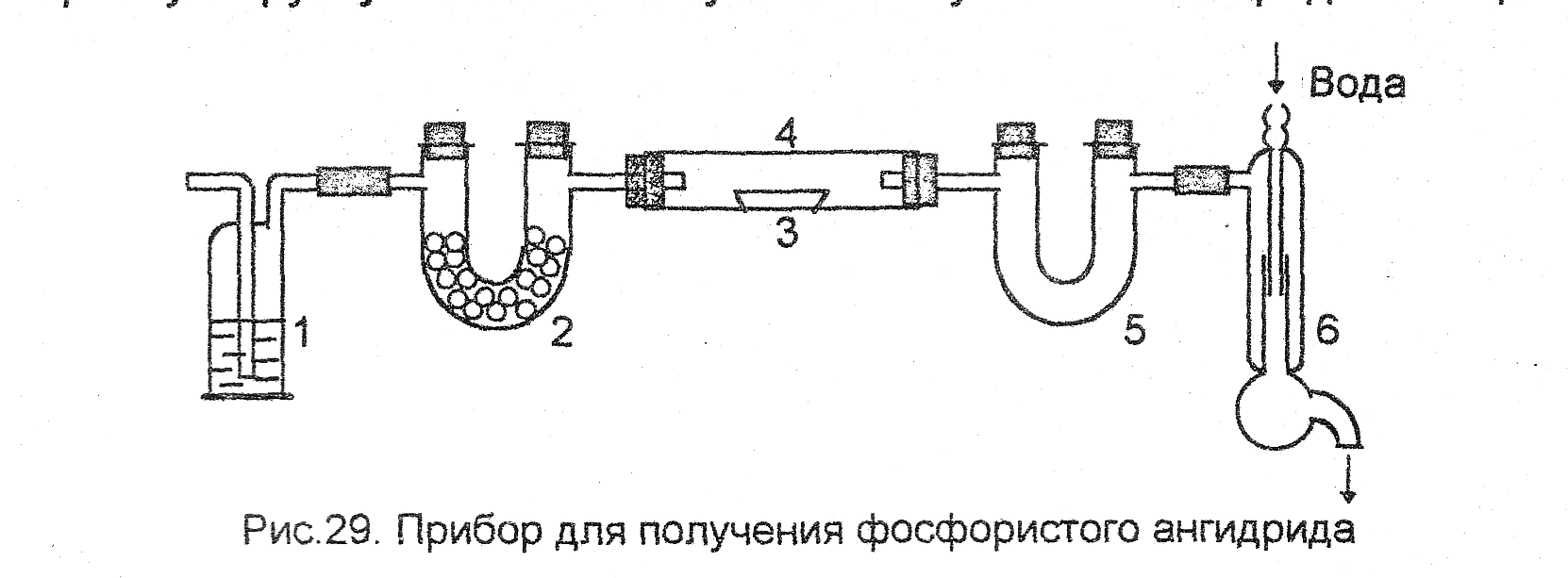
Рис. 29. Прибор для получения фосфористого ангидрида
В фарфоровую лодочку 3 положить кусочек белого фосфора величиной с маленькую горошину. Поместить лодочку в трубку 4 (из тугоплавкого стекла). Подсоединить приемник 5 к водоструйному насосу 6. Поджечь фосфор в лодочке прикосновением горячей стеклянной палочки, соединить трубку 4 с приемником 5 и включить водостройный насос (очень слабо). Когда прореагирует 4/5 взятого фосфора (остаток фосфора необходим во избежание окисления продукта до Р2О5), отсоединить насос и растворить полученный фосфористый ангидрид, собравшийся в U-образной трубке, в небольшом количестве дистиллированной воды (10–20 мл). Качественными реакциями (какими?) доказать присутствие в растворе фосфористой кислоты.
Фосфористый ангидрид Р4О6 представляет собой белые кристаллы, которые при 23,8 оС переходят в подвижную жидкость. На воздухе оксид фосфора(Ш) быстро окисляется, растворим в диэтиловом эфире, бензоле, сероуглероде; ядовит, как и белый фосфор.
6.4. Элементы подгруппы мышьяка
6.4.1. Теоретическая часть
Из элементов подгруппы мышьяка два элемента – мышьяк и сурьма – по свойствам напоминают фосфор. Подобно фосфору, эти элементы проявляют аллотропию: образуют мягкие, желтые вещества с неметаллическим блеском, состоящие из тетраэдрических молекул As4, Sb4; серые формы мышьяка и сурьмы состоят не из молекул, а из атомных слоев и в большей мере проявляют металлические свойства. Висмут необходимо считать скорее металлом, чем неметаллом.
Мышьяк и сурьма образуют галогениды, которые по строению и хими-ческим свойствам близки к соответствующим галогенидам фосфора. Соединения этих элементов с кислородом также очень сходны с соединениями фосфора, но если оксид фосфора получается прямым взаимодействием фосфора с избытком кислорода, то As2О5 и Sb2О5 получаются косвенным путем по схеме:
Э
+ HNO3(конц.)
→
H3AsO4,
H3SbO4![]() As2O5,
Sb2O5.
As2O5,
Sb2O5.
При нагревании мышьяка, сурьмы и висмута в атмосфере кислорода получаются оксиды трехвалентных элементов (As4O6, Sb4O6, Bi2O3). Оксид мышьяка(Ш), как и оксид фосфора(Ш), обладает кислотными свойствами, оксид сурьмы(Ш) амфотерен, а оксид висмута(Ш) является основным оксидом. Таков же характер изменения кислотно-основных свойств и у гидроксидов трехвалентных элементов. У оксидов пятивалентных мышьяка и сурьмы, как и у их гидроксидов, преобладает кислотный характер. Висмут мало склонен проявлять высшую степень окисления +5, которая характерна для фосфора.
Сульфиды мышьяка, сурьмы и висмута окрашены, их часто используют в качественном анализе указанных элементов. При взаимодействии мышьяка с серой образуются сульфиды состава As4S3, As4S4, As2S3 и As2S5. Из солянокислых растворов мышьяка(Ш) и мышьяка(\/) действием H2S осаждаются сульфиды As2S3 и As2Ss соответственно.
Сульфид сурьмы(Ш) Sb2S3 можно получить непосредственным взаимо-действием сурьмы с серой. Из растворов соединений трехвалентной сурьмы (SbCI3, Sb2(SO4)3), пятивалентной сурьмы (H[SbCl6]) сероводород осаждает сульфиды Sb2S3 и Sb2S5. Сульфиды мышьяка и сурьмы проявляют кислотный характер, подобно их оксидам, и растворяются в растворах сульфидов щелоч-ных металлов и аммония, образуя тиосоли:
As2S5 + 3Na2S = 2NasAsS4,
Sb2S3 + 3Na2S = 2Na3SbS3.
Тиосоли в свободном состоянии не выделены и как соли слабых кислот разрушаются сильными кислотами:
2Na3SbS3 + 6HCl → Sb2S3↓ + 3H2S + 6NaCl
Сульфид Bi2S3 обладает основным характером, как и Bi2О3.
6.4.2. Подготовка к лабораторной работе
В чем причина того, что химические свойства фосфора во многом близки к свойствам мышьяка и резко отличаются от химических свойств азота?
Какие последовательные реакции нужно провести для получения As2S5 из NaAsО2? Написать уравнения реакций.
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Bi → Bi(NO3)3 → NaBiО3 → BiOCl → Bi2S3 → Bi(OH)3.
Какими реакциями можно отделить Bi2S3 от As2S3 и Sb2S3? Как можно разделить все три сульфида?
Углы между связями у гидридов элементов V группы изменяются в следующей последовательности: NH3 – 107,3о; РН3 – 93,3о; AsH3 – 91,8о; SbH3 – 91,3о. Как объяснить резкое отличие в углах у молекул NH3 и РН3? Чем объясняется уменьшение углов при переходе вниз по подгруппе?
Почему при хранении арсената натрия NaHAsО4∙7H2О, применяемого в качестве фармакопейного препарата, важно помнить, что препарат является кристаллогидратом?
Каков состав "рвотного камня"?
Записать уравнение реакции Марша.
Как необходимо готовить водные растворы хлоридов и нитратов сурьмы(III) и висмута(III)? Дать пояснения.
Сравнить гидролизуемость SbCl3 и SbCl5, записать уравнения реакций гидролиза.
Как и сколько граммов сульфида мышьяка(Ш) можно получить из 100 мл раствора, содержащего 10% (мас.) тиоарсенита натрия (плотность раствора 1,12 г/см3)?
37. Написать уравнения химических реакций, подобрать коэффициенты:
Zn + NaAsO2 + HCl →
AsCl3 + (NH4)2S2 →
Sb + Br + KOH →
Bi(OH) + K2S2O8 + KOH →
NaAsO2 + I2 + Na2CO3 →
6.4.3. Лабораторная работа. Сурьма и висмут, их соединения
Сурьма
Свойства металлической сурьмы
Стабильная форма сурьмы имеет металлический блеск и обладает кристаллической структурой, подобно черному фосфору. Металл горит на воздухе при нагревании, образуя оксид сурьмы(Ш), реагирует с галогенами и другими неметаллами; с разбавленными растворами кислот-неокислителей не взаимодействует. Сурьма образует большое количество сплавов с другими металлами.
Взаимодействие сурьмы с хлором. В пробирке, закрытой резиновой пробкой с газоотводной трубкой, получить хлор по реакции взаимодействия МnO2 с концентрированной соляной кислотой. Наполнить хлором сухую пробирку и с кончика шпателя стряхнуть в нее небольшое количество порошкообразной сурьмы. Наблюдать вспышку при протекании реакции сурьмы с хлором. Написать уравнения реакций, учитывая, что при хлорировании сурьмы (как и фосфора) в зависимости от температуры и скорости хлорировании сурьмы (как и фосфора) в зависимости от температуры и скорости пропускания хлора получается та или иная смесь SbCl5 и SbCl3.
2. Взаимодействие металлической сурьмы с азотной кислотой. В про-бирку внести 1–2 крупинки металлической сурьмы и 5–6 капель HNО3 (плотность 1,4 г/см3). Закрепить пробирку в штативе и нагревать слабым пламе-нем горелки до начала выделения газа. Нагревание прекратить, отметить окраску полученного вещества. При написании уравнения реакции считать условно, что сурьма окисляется до ортосурьмяной кислоты H3SbО4. Содержимое пробирки оставить для следующего опыта.
Свойства гидроксида сурьмы(V)
3. Отношение гидроксида сурьмы(V) к кислотам и щелочам. Полученный в предыдущем опыте белый осадок xSb2О5∙yH2О промыть водой 2–3 раза, отцентрифугировать, пипеткой убрать маточник. К промытому осадку прибавить 3–:5 капель дистиллированной воды, размешать стеклянной палочкой и разделить суспензию пополам в две пробирки. В одну пробирку прибавить концентрированной HCl, в другую – 2 моль/л раствора щелочи до растворения осадков с образованием H[SbCl6] и Na[Sb(OH)6] соответственно. Сделать вывод химическом характере гидроксида сурьмы(V).
Получение и свойства соединений сурьмы(Ш)
4. Получение гидроксида сурьмы(III), отношение его к кислотам и щелочам. В пробирку внести 5–6 капель раствора SbCl3, по каплям прибавлять 2 моль/л раствор NaOH до выделения обильного осадка. Отметить цвет осадка, разделить его на две части. К одной части осадка прибавить несколько капель 2 моль/л раствора HCl, к другой – 2 моль/л раствора NaOH до растворения осадков. Сохранить щелочной раствор тетрагидроксоантимонита натрия Na[Sb(OH)4] для последующего опыта. Привести схему равновесия диссоциа-ции гидроксида сурьмы(III). Объяснить, как повлияет на это равновесие до-бавление избытка кислоты и щелочи. Сделать вывод о химическом характере гидроксида сурьмы(III).
5. Восстановительные свойства гидроксоантимонита натрия. К полученному в предыдущем опыте щелочному раствору гидроксоантимонита прибавить несколько капель аммиачного раствора нитрата серебра, и раствор слегка подогреть. Наблюдать выделение металлического серебра.
6. Гидролиз соли трехвалентной сурьмы. В пробирку внести 3–4 капли насыщенного прозрачного раствора хлорида сурьмы(Ш) и, перемешивая стеклянной палочкой, прибавлять по каплям дистиллированную воду до выпадения осадка хлороксида сурьмы SbOCl. К осадку по каплям добавить раствор HCl, наблюдать растворение осадка. Написать в молекулярной и ионной формах уравнение реакции гидролиза хлорида сурьмы(III), протекающего с образованием основного хлорида сурьмы Sb(OH)2Cl, затем образованием основного хлорида сурьмы Sb(OH)2Cl, затем превращающегося в хлороксид сурьмы SbOCl. Объяснить, почему SbOCl растворяется в растворе HCl.
Сульфиды и тиосоли сурьмы
Сульфиды сурьмы Sb2S3 и Sb2S5 – плохорастворимые оранжево-красные вещества. Так, произведение растворимости Sb2S3 приблизительно равно 10−93.
7. Получение и свойства сульфида и тиосоли трехвалентной сурьмы. В пробирку внести 1–2 капли насыщенного раствора хлорида сурьмы(III) и добавить 5–8 капель сероводородной воды или по каплям прибавлять разбавленный раствор Na2S до образования осадка. Отметить цвет образовавшегося осадка Sb2S3. Промыть осадок дистиллированной водой, разделить его на две части. К части осадка добавить оо каплям раствор сульфида аммония (или натрия) до растворения осадка. На какие свойства указывает способность Sb2S3 растворяться в избытке Na2S? К полученному раствору прибавить 5–6 капель 2 моль/л раствора HCl, слегка нагреть смесь, отметить выпадение осадка сульфида сурьмы(III). Устойчива ли тиосурьмянистая кислота?
8.
Получение и свойства сульфида и тиосоли
пятивалентной сурьмы. В пробирку с
оставшейся частью осадка Sb2S3
(полученного
в предыдущем опыте) прибавить 5–6 капель
раствора полисульфида аммония (NH4)2Sn,
пробирку
осторожно нагреть. Отметить растворение
осадка и помутнение раствора (выпадает
сера). К полученному раствору тиосоли
сурьмы(\/) добавить 3–5 капель 2 моль/л
раствора HCl
и слегка нагреть
его. Что наблюдается? При написании
реакции полисульфид условно считать
дисульфидом(NH4)2S2.
Какие свойства
проявляет ион S![]() в реакции с
Sb2S3?
в реакции с
Sb2S3?
Висмут
Получение металлического висмута и его свойства
Получение висмута восстановлением из его солей. В пробирку внести одну каплю раствора хлорида двухвалентного олова SnCl2 и 5–6 капель 2 моль/л раствора NaOH до полного растворения выпавшего вначале осадка гид-роксида олова. К полученному раствору тетрагидроксостаннита натрия Na2[Sn(OH)4] добавить 1–2 капли раствора соли трехвалентного висмута, раст-вор слегка подогреть. Отметить выпадение черного осадка металлического висмута, который необходимо сохранить для последующего опыта.
2. Взаимодействие металлического висмута с азотной кислотой. Про-мыть водой полученный в предыдущем опыте висмут, к осадку прибавить 2–3 капли концентрированной азотной кислоты. Пробирку слегка нагреть и наблюдать реакцию растворения висмута. Какой газ при этом выделяется?
Получение и свойства соединений висмута(III)
3. Получение гидроксида висмута(1Н), отношение его к кислотам и ще-лочам. В пробирку внести 4–6 капель раствора соли висмута и прибавить 4–6 капель 2 моль/л раствора NaOH до выпадения осадка. Осадок разделить на две части. К одной части прибавить 2–4 капли 2 моль/л раствора HNO3 до полного растворения осадка, к другой – 2–4 капли 2 моль/л раствора NaOH. Отметить наблюдаемое, сделать вывод о свойствах гидроксида висмута(III), сравнить его свойства со свойствами гидроксида сурьмы(III).
4. Гидролиз соли висмута. В пробирку внести 4–5 капель насыщенного прозрачного раствора клорида висмута и добавить 10 капель дистиллирован-ной воды. Стеклянной палочкой потереть о стенку пробирки. Наблюдается помутнение раствора. Написать в ионном и молекулярном виде уравнение реакции гидролиза BiCl3, протекающего с образованием основной соли Bi(OH)2Cl и дальнейшим разложением ее на BiOCl и Н2O.
5. Получение иодида висмута(III) и его комплексного соединения. В про-бирку внести одну каплю раствора соли висмута и одну каплю раствора ио-дида калия. Отметить выпадение черного осадка. К полученному осадку при-бавить избыток KI (3–4 капли) до полного растворения BiI3 с образованием комплексного соединения K[BiI4]. К полученному раствору K[BiI4] добавить 5‒10 капель воды и наблюдать вторичное выпадение BiI3 из-за разрушения комплексного соединения. Добавить еще несколько капель воды и нагреть содержимое пробирки. Отметить образование оранжевого осадка BiOI, являющегося продуктом гидролиза BiI3. Написать уравнения всех проделанных реакций и выражение константы нестойкости комплексного иона [BiI4]-. Объяснить, почему добавление воды способствует разрушению комплекса. Какие факторы повлияли на усиление процесса гидролиза иодида висмута?
6. Получение и свойства сульфида висмута(Ш). К 3–4 каплям раствора соли висмута(Ш) добавить 6–7 капель сероводородной воды или 3–4 капли раствора сульфида аммония или натрия. Отметить выделение темно-корич-невого осадка Bi2S3. Осадок сульфида висмута промыть водой, разделить на две части. К одной части прибавить 3–4 капли сернистого аммония. Что наб-людается? Объяснить различное отношение Sb2S3 и Bi2S3 к избытку (NH4)2S. К другой части сульфида висмута добавить 2–3 капли конц. HNO3. Наблю-дать растворение осадка. Если осадок растворяется плохо, пробирку слегка подогреть. Написать уравнения реакций. Учесть, что при окислении Bi2S3 сульфид-ион окисляется до сульфат-иона, а азотная кислота восстанавли-вается до NO.
Соединения пятивалентного висмута
7. Окисление соединений трехвалентного висмута до пятивалентного состояния. В маленький тигель внести 1–2 капли раствора соли трехвалентно-го висмута, добавить 3–5 капель 2 моль/л раствора щелочи и 4–6 капель бром-ной воды. Тигель поставить на сетку и нагревать на небольшом пламени го-релки до образования светло- коричневого осадка, в основном состоящего из метависмутата натрия NаВiO3. Написать уравнение реакции, изобразить структурную формулу NaBiO3.
8. Окислительные свойства пятивалентного висмута. В конической про-бирке к 3−4 каплям раствора сульфата марганца(II) добавить 2–3 капли кон-центрированной азотной кислоты и на кончике шпателя – порошок висмутата натрия. В случае необходимости добавить немного воды и раствор отцентри-фугировать. Отметить появление фиолетовой окраски марганцовой кислоты НМnО4. Составить уравнение реакции, используя метод полуреакций, указать окислитель и восстановитель.
6.4.4. Синтезы соединений сурьмы и висмута
1. Получение треххлористой сурьмы. При хлорировании металлической сурьмы получается смесь три- и пентахлорида сурьмы, которую и используют для получения как трихлорида(восстанавливая SbCl5 металлической сурьмой), так и пентахлорида сурьмы (окисляя примесь SbCl3 хлором).
Под тягой собрать прибор (рис.30).
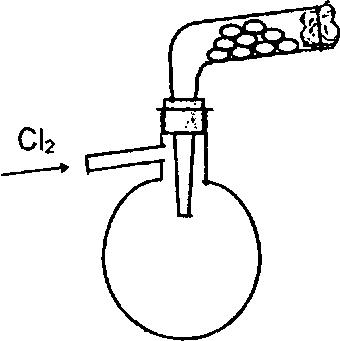 К
колбе Вюрца присоединить изогнутую
К
колбе Вюрца присоединить изогнутую
Трубку типа аллонжа так, чтобы горизонтальная часть трубки была нес-колько наклонена к колбе. В трубку по-местить кусочки сурьмы и закрыть неплотно пробкой. Собрать прибор для получения хлора и через отводную присоединить его к колбе Вюрца. Сухой хлор небольшими порциями пропускать через собранный прибор.
Рис. 30. Прибор для синтеза
треххлористой сурьмы
Хлор взаимодействует с сурьмой и образуется жидкая смесь SbCl3 и SbCl5, которая стекает в колбу Вюрца. По окончании реакции вынуть аллонж, отсоединить прибор для получения хлора, в колбу Вюрца со смесью хлоридов внести несколько кусочков металлической сурьмы. Закрыть колбу Вюрца пробкой и нагревать 20–30 мин на водяной бане, затем насыпать в колбу еще немного порошка сурьмы и нагревать 10 мин до полного восстановления примеси SbCl5 в SbCl3. Содержимое колбы перегнать, собирая фракцию с tкип= 218–220 ºС; приемник должен быть защищен от влаги воздуха хлоркальциевой трубкой.
Получение азотнокислого висмута. Нитрат висмута можно получить растворением металлического висмута в азотной кислоте:
Bi + 6HNО3 = Bi(NО3)3 + 3NО2↑ + 3H2O .
В фарфоровую чашку (под тягой) внести 6 мл воды, 6 мл HNО3 (плот-ность 1,40 г/см3) и нагреть раствор до 60–70 ºС. Затем постепенно прибавлять 5 г гранулированного висмута. Чашку закрыть часовым стеклом. По окончании реакции смесь отфильтровать, собирая фильтрат в колбу, которую предвари-тельно сполоснуть HNО3 (для предотвращения процесса гидролиза). К остав-шемуся в чашке нерастворенному металлу добавить еще 2 мл HNО3 и 2 мл Н2О и нагреть до 60–70 ºС. Затем смесь отфильтровать в колбу с ранее полученным раствором. Раствор упарить при температуре 65–70 ºС до плотности, равной 1,9 г/см3, и охлаждать льдом при перемешивании. Выпавшие кристалл-лы Bi(NО3)3∙5H2О отсосать на воронке Бюхнера и высушить при 40–45 ºС.
Нитрат висмута Bi(NО3)3∙5H2О представляет собой бесцветные кристаллы триклинной структуры в форме призм с плотностью 2,83 г/см3. При 75,5 ºС соль плавится в кристаллизационной воде с образованием основной соли, при 200 ºС – разлагается с выделением NО2.
Получение дивисмуттетраоксида Bi2O4 Четырехоксид висмута получа-ют по реакции
4КВiO3 + 4НСl4 = 4КСlO4 + 2Bi2O4 + 2Н2O + O2 .
Для получения оксида 5 г КВiO3 кипятить с 10%-ным раствором хлорной кислоты, взятым в большом избытке, до тех пор (~ 10 ч), пока не останется не-большое количество оранжево-красного вещества. Остаток Bi2O4∙xH2O от-фильтровать, промыть и высушить. Исследовать отношение оксида к кисло-там, щелочам, окислителям и восстановителям.
6.5. Задания для самостоятельной работы
Установлено, что реакция
2NO(г) + О(г) = 2NО2(г)
является реакцией третьего порядка. Написать уравнение скорости реакции и рассчитать, как изменится скорость реакции при увеличении общего давления смеси в два раза.
Какие продукты получаются, когда в жидкий аммиак вносят указан-ные вещества и затем испаряют растворитель: калий, кальций, сера, безводный NiI2?
40. При сжигании в калориметрической бомбе 1 г гидразина N2H4 темпе-ратура калориметра повысилась на 1,17 оС. Рассчитать количество выделивше-гося тепла, если теплоемкость калориметра 16,53 кДж/оС. Сколько выделится тепла при сгорании одного моля N2H4?
41. Растворы аммиака разной концентрации имеют следующие значения рН:
С, моль/л 1 0,1 0,001
рН 11,6 11,1 10,6
Какой это электролит – слабый или сильный? Докажите расчетами.
42. Фторид аммония является одним из немногих веществ, обладающих значительной растворимостью во льду, образуя с последним твердые раство-ры. Чем объясняется это явление?
43. Какое количество энергии освободится при взрыве HN3 (∆Нfº = 294 кДж/моль), если при этом образуются молекулярный водород и азот?
Разложение нитрата аммония возможно по двум схемам нитрата ам-мония возможно по двум схемам:
а) NH4NO3(t) = N2O(r) + 2Н2O(г);
б) NH4NO3(T) = N2(r) + 1/2O2(г) + 2Н2O(Г) .
Какая схема более вероятна? Покажите это расчетами. Как реакция зависит от условий?
В 0,1 моль/л растворе азотистой кислоты рН = 2,167. Вычислить константу диссоциации кислоты.
Привести примеры основных, амфотерных и кислотных нитридов, указать их отношение к воде.
Сернистые соединения азота при гидролизе выделяют аммиак и образуют кислородные кислоты серы. Напротив, при гидролизе сульфидов фосфора наряду с кислородными кислотами фосфора образуется сероводо-род. Какие можно сделать выводы о распределении заряда на атомах азота и фосфора?
Написать уравнение самоионизации жидкого аммиака и указать ве-щества,которые в жидком аммиаке играют роль кислот и оснований со-ответственно.
49. Указать тип гибридизации орбиталей атома азота в нитриде хлора Cl3N, фториде азота NF3 и форму их газообразных молекул. Как поляризован атом азота в указанных соединениях? Подтвердить это уравнениями гидролиза CI3N и NF3.
50. Написать уравнения реакций горения меди, серы в атмосфере NО2, а также растворения NО2 в растворе NaOH.
51. Объяснить различия в свойствах NH4F и PH4F: фторид аммония является устойчивым кристаллическим веществом, а фторид фосфония полностью диссоциирует на фосфин и фтороводород при температуре ниже 00С.
Изобразить энтальпийную диаграмму для вычисления ∆Нo298 реакции окисления красного фосфора хлором до трихлорида фосфора, если известны: энергия связи P–Cl ЕP-Cl = 306 кДж/моль, энергия атомизации красного фосфо-ра ∆Нвозг(Р) = 315 кДж/моль, энергия диссоциации хлора ∆Ндис.= 249 кДж/ /моль. Рассчитанную величину ∆Нo298 по термохимическому циклу сравнить с табличной величиной ∆Нºf (РСl3) для реакции
Р(т) + 1,5Cl2(г) = РСl3
53. Объяснить образование химической связи в молекуле PCl3· BCl3.
54. В системе
PCl5 ⇆ PCl3 + Cl2
равновесие при 500 К установилось, когда исходная концентрация PCl5, равная 1 моль/л, уменьшилась до 0,46 моль/л. Найти значение Кс этой реакции при указанной температуре.
Какой будет формула оксида азота, в котором массовая доля кислоро-да составляет 36,36%?
56. Растворы фосфатов Na3PO4, Na2HPO4 и NaH2PO4, содержащие 1% (мас.) соли, имеют следующие значения рН: 12,1; 8,9; 4,6. Дать объяснения.
Пользуясь уравнениями реакций:
2Р(т) + ЗС12(г) = 2РС13(ж), ∆H° = -635/1 кДж ,
РС13(ж) + С12(г) = РС15(т), ∆Н° = -137,3 кДж ,
вычислить теплоту образования твердого PCl5 при 25 °С и теплоту испарения РС13(ж) при этой температуре.
58. Можно ли предсказать, используя значения электроотрицательности элементов, с каким тепловым эффектом образуются из простых веществ соединения Pl3 и PF3?
59. У какой из молекул, NH3 или AsH3, дипольный момент больше? Дать объяснения, найти в справочной литературе величины дипольных моментов соответствующих молекул.
