
- •Неорганическая химия
- •Часть I. Классификация и номенклатура неорганических соединений
- •Тема 1. Номенклатура неорганических соединений
- •1.2. Семинар 1. Классы и номенклатура неорганических соединений
- •Часть II. Химия неметаллов
- •Тема 3. Водород
- •3.1. Теоретическая часть
- •3.2. Семинар 3. Соединения водорода. Получение и применение водорода
- •3.3. Подготовка к лабораторной работе
- •3.6. Синтез гидрида кальция
- •Тема 4. Галогены
- •2. Окислительные свойства свободных галогенов
- •XCa(oci)2 · yCaCl2 · zCa(oh)2 · nН2o.
- •Тема 5 элементы главной подгруппы шестой группы
- •5.3. Сера и элементы подгруппы селена
- •5.3.1. Теоретическая часть
- •Тема 6. Элементы главной подгруппы пятой группы
- •Тема 7. Углерод. Кремний. Бор
- •7.2. Семинар 9. Углерод. Соединения кремния и бора
- •7.3. Углерод
- •Дициан цианистый цианамид циановый роданистый
- •7.4.3. Лабораторная работа. Кремний и его соединения
- •7.6. Синтезы соединений бора
- •7.7. Задания для самостоятельной работы
- •Приложение 4. Атомные радиусы:
- •Часть II
- •Часть III
Тема 7. Углерод. Кремний. Бор
7.1. Сравнительная характеристика элементов
Сравнительное рассмотрение химии углерода, кремния и бора дает возможность продемонстрировать закономерности периодической системы химических элементов.
Чтобы это сделать, приведем некоторые характеристики для атомов 6, С и Si.
|
Элемент |
B |
C |
Si | |
|
Ковалентный атомный радиус |
0,80 |
0,77 |
1,17 | |
|
Электроотрицатель ность по Полингу |
2,04 |
2,55 |
1,90 | |
|
Число валентных электронов |
3 |
4 |
4 | |
|
Число валентных атомных орбиталей |
4 |
4 |
9 | |
|
Возможный тип гибридизации атома |
sp2 |
sp sp2 sp3 |
sp2, sp3 d2 | |
|
Соотношение числа электронов и числа орбиталей, тип образуемых связей |
Дефицит электро-нов, трехцентровые связи в соединениях с несколькими атомами |
Совпадение, образо-вание двухцентро-вых связей |
Совпадение, образо-вание двухцентро-вых связей, есть Вакантные орбитали | |
|
Образование кратных связей, π-Связывание
|
π-Связывание невоз-можно из-за образо-вания трехцентро-вых свзяей
|
Осуществляется π –перекрывание в двойных и тройных связях. Образуются каркасы связей С-С, С-О |
π-Связывание за- труднено. Образуются каркасы более устойчивых связей Si-O, а не Si-Si
| |
|
Энергия связей кДж/моль
|
Э-Э Э-О Э-Н |
- - - |
348 351 413 |
177 369 295 |
Все отличия между химическими свойствами В, С и Si связаны, во-первых, с различным числом валентных электронов и, во-вторых, с числом электронов, заполняющих внутренние орбитали: бор и углерод имеют под валентной оболочкой два электрона, а кремний − 8. Большой размер атома кремния, отталкивание внутренних электронов не позволяют атомам кремния сблизиться настолько, чтобы образовалась π-связь между ними, тогда как атомы углерода могут быть связаны друг с другом и с другими атомами кратными связями.
Итак, возможности кремния в отличие от углерода ограничены невысокой прочностью связи Si-Si по сравнению со связью Si−О и его неспособностью образовывать двойные связи.
Более высокая прочность связи Si–О по сравнению со связью С–О объяс-няется тем, что между атомами кремния и кислорода образуется не только до-норно-акцепторная σ-связь, но осуществляется еще и дативное взаимодейст-вие: перекрываются р-орбитали атома кислорода, занятые неподеленными па-рами, с вакантными d- орбиталями кремния.
Из атомов В, С и Si атом углерода обладает самым удачным сочетанием свойств: его небольшой атом имеет такое же число валентных электронов, как и число валентных атомных орбиталей; связи атомов углерода друг с другом настолько же прочны, как и связи с кислородом.
Атомы бора, хотя и обладают малыми размерами, не способны к π-свя-зыванию в силу того, что электронодефицитность бора приводит к образо-ванию трехцентровых связей и возникающее геометрическое расположение атомов не позволяет р-орбиталям соседних атомов ориентироваться парал-лельно для образования π-связи. Трехцентровыесвязывающие молекуляр-ныеорбитали в соединениях бора имеют следующий вид:
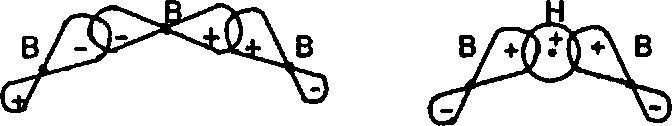
Бор и углерод, атомы которых отличаются на один валентный электрон (стоят рядом в периоде), имеют близкие и малые размеры. Это приводит к тому, что они не дают положительно и отрицательно заряженных ионов (такие гипотетические ионы обладали бы высокой поляризующей способностью) и в своих соединениях образуют ковалентные связи.
Углерод и кремний стоят рядом в главной подгруппе. Малые по разме-ру атомы углерода полимеризуются в цепи, давая так называемые органи-ческие соединения. Гомоцепи Si−Si имеются в водородных соединениях кремния − силанах с общей формулой SinH2n+2. Эти соединения по составу аналогичны алканам, но цепи ограничены предельным значением n = 6. Простые соеднения кремния обладают большей реакционной способностью по сравнению с аналогичными по составу соединениями углерода. Так, в отличие от соединений СН4, ССl4, подобные соединения кремния взаимо-действуют с водой (положительно поляризованный атом кремния атакуется группами ОН − молекул воды):
SiH4 + 3H2O = H2SiO3 +4H2,
SiCl4 + 3H2O = H2SiO3 +4HCl.
Кремний образует еще один класс полимерных соединений – силокса-нов, в которых атомы кремния связаны через мостиковые атомы кислорода:
CH3 CH3 CH3



- Si – O – Si – O – Si -



CH3 CH3 CH3
Поскольку связи Si-О очень прочны, силоксаны являются химически инертными веществами.
В общем, в химии углерода и кремния больше различий, чем сходства. Многие соединения кремния, аналогичные по составу соединениям углерода, имеют совсем другое строение. Так, диоксид углерода – газообразный моно-мер с двойными связями между атомами С и О:
O = C = O
а диоксид кремния – кристаллический полимер со связями Si–O. Мономер-ность СO2 связана со способностью малого по размерам атома углерода на-сыщать свою валентность образованием σ- и π- связей.
Таким образом, различный тип ковалентных связей в указанных соеди-нениях (кратные связи в СО2, ординарные – в SiО2) обуславливает переход от неполярного молекулярного вещества СО2 к полимерному соединению SiО2.
Для сложных органических веществ неизвестны кремневые аналоги.
Поскольку бор и кремний расположены близко друг от друга по диаго-нали, то они должны проявлять близкие химические свойства (диагональное сходство обусловлено близостью радиусов атомов). Действительно, эти два элемента в природе встречаются в виде оксосоединений (бораты, силикаты); простые вещества имеют каркасную структуру; оксиды (В2О3, SiО2), гидро-ксиды (H3BО3, H2SiО3) имеют кислотный характер; элементы образуют неус-тойчивые, реакционноспособные гидриды (В2Н6, SiH4), летучие и гидроли-зующиеся галогениды (за исключением BF3), которые являются кислотами Льюиса. Из этих примеров видно, что бор больше похож на кремний и отли-чается от более металлического алюминия, находящегося в одной группе с бором (алюминий абразует амфотерный с преобладающими основными свойствами гидроксид Al(OH3). Но тем не менее различия между бором и кремнием часто достаточно велики.
