
arkhiv patologii_3_2005
.pdfВпомощь практическому врачу
©КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 616.36-006.04-091.8-078.33
Ключевые слова: гепатобластома, взрослые, иммуноморфология.
А. И. Щеголев, Н. Д. Скуба, О. В. Паклина, И. О. Тинькова, В. А. Вишневский
ГЕПАТОБЛАСТОМА У ВЗРОСЛЫХ
Отделение патологической анатомии (зав. — проф. А. И. Щеголев) с лабораторией ультраструктурных морфологических исследований и отделение абдоминальной хирургии (зав. — член-корр. РАМН, проф. В. А. Кубышкин) Института хирургии им. А. В. Вишневского РАМН, 113093, Москва
Почти 1/4 всех первичных опухолей печени у детей составляют гепатобластомы. У взрослых ге патобластома встречается крайне редко, как прави ло в молодом возрасте — до 35 лет [3, 8, 9, 12, 15, 19], хотя в литературе описаны единичные случаи, когда опухоль возникала в среднем и пожилом воз расте [2]. В детском возрасте мальчики поражаются в 2 раза чаще, чем девочки [13]. Во взрослом воз расте поражаются преимущественно женщины [3, 8, 9, 12, 19].
Клинически гепатобластома у взрослых прояв ляет себя в виде быстро растущего одиночного узла размерами от 6 до 25 см. Возникновение опухоли не связано с фоновыми заболеваниями печени, та кими, как гепатит или цирроз. Макроскопически опухолевый узел часто имеет тонкую капсулу и чет ко отграничен от неизмененной паренхимы пече ни. Цвет опухоли на разрезе может колебаться от коричневого до зеленого, с наличием фокусов фиб роза и кальцинатов, полей некроза, кистозной де генерации и кровоизлияний.
По своему микроскопическому строению опу холь напоминает печень в различные сроки внут риутробного развития: от периода закладки органа (3,5—4 нед) до фетального периода. Гистологиче ски выделяют эпителиальный и эпителиально-ме- зенхимальный (смешанный) варианты гепатобла стомы и очень редко встречаются анапластический мелкоклеточный [13], макротрабекулярный [6], тератоидный [14] и миксоидный [11] варианты. В об щепринятых классификациях эпителиальный ва риант подразделяют на фетальный, эмбриональ ный, макротрабекулярный и мелкоклеточный ти пы, а смешанный — с тератоидным компонентом или без него [18]. В первом случае паренхима опу холи представлена полигональными клетками раз мером с нормальный гепатоцит и больше, с круг лыми и овальными ядрами, зернистой, светлой или оптически пустой цитоплазмой в зависимости от количества содержащихся в ней гликогена или жи ров — фетальный тип клеток. Клетки формируют пласты вокруг желчных протоков. Эмбриональный тип — это мелкие, вытянутые темные клетки с гиперхромными ядрами и скудной цитоплазмой. Клетки группируются в розетки, шнуры или ленты. Среди двух этих типов клеток часто можно наблю дать экстрамедуллярный гемопоэз. Основными морфологическими критериями, позволяющими дифференцировать эмбриональные и фетальные опухолевые клетки, являются высокая митотическая активность [17] и отсутствие гликогена, липидов и желчных пигментов в цитоплазме эмбрио
нальных клеток [10]. Характерным признаком яв ляется также высокое ядерно-цитоплазматическое отношение (1:1 — 1:2) в эмбриональных клетках по сравнению с фетальными (1:2—1:4) и нормальны ми гепатоцитами (1:4—1:6) [6]. Макротрабекуляр ный тип по своему строению напоминает гепатоцеллюлярный рак. Мелкоклеточный, или анапла стический, тип гистологически представлен мел кими темными клетками, растущими сплошными полями и не формирующими каких-либо структур, часто с миксоматозом стромы опухоли [11].
Всмешанном варианте гепатобластомы наряду
сэпителиальным компонентом большую часть опухоли составляют мезенхима и ее производные различной степени зрелости: чаще всего костная и хрящевая ткани, редко мышечные и нервная. Мо гут встречаться фокусы плоскоклеточной метапла зии опухолевых клеток [20].
При ультраструктурном исследовании эмбрио нальных опухолевых клеток гепатобластомы на блюдаются рыхлое расположение клеточных эле ментов, широкие межклеточные промежутки в примитивных трабекулах и розетках, большое ко личество филоподий, наличие примитивных желч ных канальцев, электронно-плотный цитоплазматический матрикс и развитая гранулярная цитоплазматическая сеть. Для фетальных опухолевых клеток характерны формирование трабекулярных структур, тесное контактирование клеток между собой, наличие сформированных сосудистых и билиарных полюсов, светлый цитоплазматический матрикс, большое число органелл [1].
Различные иммуногистохимические исследова ния выявили экспрессию а-фетопротеина, раковоэмбрионального антигена, нейронспецифической энолазы, протеина S-100, а,-антитрипсина, эпите лиального мембранного антигена и хромогранина А в различных пропорциях в фетальных и эмбрио нальных опухолевых клетках [16, 21]. Анапластические клетки экспрессируют виментин. Синтез ссфетопротеина осуществляется низкодифференцированными клеточными элементами гепатобласто мы, начиная с опухолевых клеток печеночного ди вертикула эндодермы, затем эмбриональными, промежуточными опухолевыми клетками и посте пенно ослабевает по мере дальнейшей дифференцировки опухолевых гепатоцитов, поэтому в осно ве клинической диагностики гепатобластомы ле жит определение содержания а-фетопротеина в сыворотке крови. Существуют характерные хромо сомные нарушения для гепатобластомы, такие, как трисомия 2-й и 20-й хромосом [5, 18]. В 11-й хро-
41
мосоме выделен ген, ассоциированный с гепатобластомами и другими эмбриональными опухолями [5]. Мутации гена опухолевой супрессии р53 для данных опухолей нехарактерны [4].
Приводим редкое наблюдение гепатобластомы у женщины 47 лет, которая была оперирована по по воду опухоли левой доли печени в Институте хи рургии им. А. В. Вишневского РАМН.
Б о л ь н а я К., 47 лет, поступила с жалобами на тупые боли в правом подреберье и эпигастральной области, не связанные с приемом пищи, которые появились с декаб ря 2003 г. При поступлении общее состояние удовлетво рительное. Перкуторно границы печени не изменены. Клинический и биохимические анализы крови в преде лах нормы. При ультразвуковом исследовании органов печень незначительно увеличена в размерах. Паренхима диффузно уплотнена, неоднородна за счет наличия в проекции И—III сегментов печени многоузлового обра зования размером 90,6 х 58,9 мм, с четкими бугристыми контурами, по структуре гиперэхогенного неоднородно го с наличием гипоэхогенных зон. По латеральному кон туру образования определяется несколько мелких допол нительных образований аналогичной структуры, разме ром до 13,2 мм. При компьютерной и магнитно-резо нансной томографии в области левой доли печени (II, III сегменты) определяется патологическое образование ок руглой формы, размером 8,6 х 8,2 см, негомогенное, с наличием мягкотканого и жирового компонентов, более всего соответствует тератоме. Больной выполнена опера ция — левосторонняя гемигепатэктомия, холецистэктомия. Макроскопически опухолевый узел инкапсулиро ван, четко отграничен от паренхимы печени, размером 9 х 6 х 6 см (рис. 1, а, на вклейке). На разрезе опухоле вая ткань желтовато-коричневого цвета, мягкой конси стенции, распадающаяся при разрезе за счет многочис ленных полей некроза и кровоизлияний (рис. 1, б, на вклейке). При микроскопическом исследовании эпите лиальный компонент опухоли представлен двумя типами клеток: мелкими овальными клетками с крупными слег ка вытянутыми гиперхромными ядрами, формирующи ми примитивные трабекулярные структуры (рис. 2, а, на вклейке) и светлыми клетками, имеющими оптически пустую или пенистую цитоплазму за счет содержания большого количества гликогена и липидов (рис. 2, б, на вклейке). Часть светлых клеток настолько переполнена гликогеном, что гистологически напоминала зрелые липоциты. Также отмечена рассеянная лимфоидная ин фильтрация. При иммуногистохимическом исследова нии выявлены положительная реакция с антителами к протеину S-100 (цитоплазматическое окрашивание пре имущественно в светлых крупных гепатобластах), цитокератинам 8 и 18 (также только в фетальном типе кле ток), диффузное окрашивание с Hepatocyte (+ +) (рис. 3, а, на вклейке) и отрицательная реакция с антителами к протеину р53, цитокератинам 7, 19, 20, CD99. Экспрес сия PCNA наблюдалась в 15% ядер (+++) (рис. 3, б, на вклейке), а индекс пролиферации составил 4,5. Все ан титела и система визуализации фирмы "Dako" (Дания).
Заключение: гепатобластома, эпителиальный вари ант, фетальный и эмбриональный типы опухолевых кле ток. Индекс пролиферации по PCNA составлял 21.
Гепатобластома — высокозлокачественная опу холь, но при поражении взрослых отличается более благоприятным прогнозом по сравнению с гепатоцеллюлярным раком [7]. Гепатобластомы с преоб ладанием опухолевых клеток фетального типа ха рактеризуются более высокой степенью дифферен-
цировки, низкой митотической активностью и бо лее благоприятным течением по сравнению с гепатобластомами эмбрионального типа [17, 22]. Са мым неблагоприятным диагностическим маркером является наличие анапластических или макротрабекулярных структур в опухоли.
ЛИ Т Е Р А Т У Р А
1.Шабанов М. А., Любимова О. Е., Райхлин Н. Т. //
Арх. пат. - 1987. - Вып. 12. - С. 9-16.
2.Altmann H. W. // Pathol. Res. Pract. - 1992. - Vol. 188. - P. 16-26.
3.Bortolasi L., Marchioh L., Dal Dosso I. et al. // Hepatogastroenterology. — 1996. - Vol. 43. — P. 1073— 1078.
4.Chen T. C, Hsieh L. L., Kuo T. T. // J. Pathol. - 1995.
-Vol. 176. - P. 243-247.
5.Ding S. R, Michail N. E., Habib N. A. // J. Hepatol. - 1994. - Vol. 20. - P. 672-675.
6.Gonzalez-Crussi F., Upton M. P., Maurer H. S. // Am. J. Surg. Pathol. - 1982. - Vol. 6. - P. 599-612.
7.Green L. K, Silva E. G. // Am. J. Clin. Pathol. - 1989.
-Vol.92. - P. 110-115.
8.Harada Т., Matsuo K, Kodama S. et al. // J. Surg. — 1995. - Vol. 65. - P. 686-688.
9.Inoue S., Nagao Т., Ishida Y. et al. // Surg. Today. — 1995. - Vol. 25. - P. 974-977.
10.Ishak K. G., Goodman Z. D., Stacker J. T. Tumours of the Liver and Intrahepatic Bile Ducts. — Washington, 1994.
11.Joshi V. V., KaurP., Ryan B. et al. // Cancer. - 1984.
-Vol. 54. - P. 2035-2039.
12.Kacker L. K, Khan E. M., Gupta R. et al. // Surg. - 1995. - Vol. 9. - P. 47-49.
13. Kasai M., Watanabe I. // Cancer. - 1970. - Vol. 25.
-P. 551-563.
14.Manivel C., Wick M. R., Abenoza P., Dehner L. P. // Cancer. - 1986. - Vol. 57. - P. 2168-2174.
15.Reddy К S., Karak P. K., Sharma S. et al. // Trop. Gas troenterol. - 1997. - Vol. 18. - P. 163-164.
16.Ruck P., Harms D., Kaiserling E. // Am. J. Surg. Pathol.
-1990. - Vol. 14. - P. 847-855.
17.Schmidt D., Harms D., Lang W. // Virchow Arch. Abt. A. Path. Anat. - 1985. - Bd 407. - S. 387-405.
18.Stacker J. Т., Conran R. M. // Liver Cancer. — Edin burgh, 1997. - P. 263-278.
19.Sugino K, Dohi K, Matsuyama T. et al. // Jpn. J. Surg.
-1989. - Vol. 19. - P. 489-493.
20.Van Eyken P., Sciot R., Callea F. et al. // Hum. Pathol.
-1990. - Vol. 21. - P. 302-308.
21.Watanabe I., Yamaguchi M., Kasai M. // J. Pediatr. Surg.
-1987. - Vol. 22. - P. 406-411.
22.Weinberg A. G, Finegold M. J. // Hum. Pathol. - 1983.
•-Vol. 14. - P. 512-537.
Поступила в редакцию 28.05.04
ADULT HEPATOBLASTOMA
A.I. Schegolev, N.D.Skuba, O.V. Paklina, I.O.Tinkova,
V.A. Vishnevsky
A.V.Vishnevsky Institute of Surgery, 113093, Moscow
Summary — A rare case of hepatoblastoma is reported in a female of 47 years of age with literature review of these tu mors in the adults. Microscopically the tumor was represented by the cells of embryonal and fetal types. Immunohistochemically expression of low-molecular cytokeratins as well as that of S-100 protein and hepatocyte antigen was observed.
Ark. Pathol., 2005, N. 3, P. 41-42.
42
£ КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 618.145-007.415-031:6И.349]-036.1
К л ю ч е в ы е с л о в а : эндометриоз, сигмовидная кишка.
В. С. Бессмертная1, 2, Г. А. Галил-Оглы3, М. В. Самойлов1, 2
Э Н Д О М Е Т Р И ОЗ С И Г М О В И Д Н О Й К И Ш К И
'Центральная клиническая больница РАН, 117593, Москва; Российский государственный медицинский университет, 117997, Москва; 'Российский научный центр рентгенорадиологии МЗ и СР РФ, 117837, Москва
Частота эндометриоза среди женщин репродук тивного возраста, по разным данным, варьирует от 12 до 50% [1, 2, 6, 7]. Наиболее частой локализаци ей экстрагенитального эндометриоза являются ретроцервикальная и ретровагинальная области тол стой кишки, т. е. прямая кишка и нижние отделы сигмовидной кишки. Эндометриоз кишечника все гда вторичен и развивается у 18% женщин, стра дающих генитальным эндометриозом [2].
Дифференциальная клиническая диагностика эндометриоза толстой кишки остается актуальной и в то же время сложной проблемой [3,4]. Клиника обтурационной кишечной непроходимости при эндометриозе часто расценивается как проявление опухоли и влечет соответствующую лечебную так тику и объем оперативного вмешательства. Неред ко даже комплексное обследование, включающее ультразвуковое исследование, компьютерную то мографию, эндоскопическое и биопсийное иссле дование, не позволяет поставить правильный диаг ноз [1, 5].
Приводим собственное наблюдение эндомет риоза сигмовидной кишки.
Б о л ь н а я М., 40 лет, поступила в хирургическое от деление Центральной клинической больницы РАН с клинической картиной острой кишечной непроходимо сти. Была обследована в приемном отделении. При ректороманоскопии: в нижней трети сигмовидной кишки просвет сужен, стенки утолщены, уплотнены, бугристые. Взяты фрагменты слизистой оболочки для биопсийного исследования с целью исключения неспецифического язвенного колита, опухоли сигмовидной кишки. При микроскопическом исследовании биопсии: два фрагмен та слизистой оболочки кишки с лимфоидными фолли кулами. В приемном отделении установлен диагноз: опу холь сигмовидной кишки, острая обтурационная толсто кишечная непроходимость. Больная оперирована в экс тренном порядке, произведена резекция сигмовидной кишки. При макроскопическом исследовании операци онного материала, доставленного в патолого-анатомиче- ское отделение Центральной клинической больницы РАН: участок сигмовидной кишки длиной 25 см с бры жейкой, в 6 см от дистального конца кишки определяет ся уплотнение. В этом месте просвет проходим с трудом (пропускает кончик пальца), стенка утолщена до 0,4 см, плотноэластической консистенции, на разрезе волокни
стая с ослизнением, граница с наружными отделами кишки неровная, но четкая, слизистая оболочка пред ставляется интактной. При микроскопическом исследо вании: картина эндометриоза стенки кишки. Очаги эн дометриоза в толще собственной пластинки слизистой оболочки, в слизистой оболочке и подслизистом слое (рис. 1, на вклейке), в мышечном слое (рис. 2, на вклей ке); гипертрофия мышечного слоя, фиброз стенки кишки.
Данное наблюдение, на наш взгляд, является типичным примером лечебной тактики при экстрагенитальном толстокишечном эндометриозе и подчеркивает сложность клинической диагностики этого заболевания.
ЛИ Т Е Р А Т У Р А
1.Адамян Л. В., Кулаков В. И. Эндометриозы. — М., 1998.
2.Баскаков В. П. Клиника и лечение эндометриоза. — Л., 1990.
3.Петруняев А. И., Давидов М. И. // Урол. и нефрол. - 1998. - № 6. - С. 45-64.
4.Пучков К. В., Карпов О. Э., Родиченко Д. С. и др. // Эндоскоп, хир. - М., 2000. - № 4. - С. 30-32.
5.Радзинский В. Е., Туе А. И., Семятов С. М., БутареваА. Б. Эндометриоз: Учебное пособие. — М., 2002.
6.Стрижаков А. Н., Давыдов А. И. Эндометриоз. Кли нические и теоретические аспекты. — М., 1995.
7.Стрижаков А. И., Давыдов А. И. // Акуш. и гин. — 1996. - № 5. - С. 27-31.
Поступила в редакцию 20.10.04
SYGMOID ENDOMETRIOSIS
V.S.Bessmertnaya1,2, G.A.Galil-Ogly3, M.V.Samoilov1,2
'Central Clinical Hospital, Russian Academy of sciences, 117593, Moscow; 2Russian State Medical University, 117997, Moscow; -"Russian Research Centre of Roentgenoradiology, 117837, Moscow
Summary — A case of sygmoid endometriosis is described in a 40-year-old female. After clinical and endoscopic exam ination, the patient was operated for sigmoid tumor, acute ob turation colon obstruction. Histologically diagnosis of intes tinal wall endometriosis was established. This is an example of therapeutic policy in extragenital intestinal endometriosis with difficulties in the clinical diagnosis.
Ark. Pathol., 2005, N. 3, P. 43.
43

История медицины
© КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 616-091:92ГУСАРЕВ
К л ю ч е в ы е с л о в а : история медицины, А. Ф. Гусарев.
И. С. Дерижанова1, Е. М. Непомнящая2, С. Л. Гусарев1
ПРОФЕССОР АЛЕКСАНДР ФЕДОРОВИЧ ГУСАРЕВ (к 70-летию со дня рождения)
'Ростовский государственный медицинский университет, Ростов-на-Дону;2Ростовский НИИ онкологии, Ростов-на-Дону
Александр Федорович Гусарев родился 9 августа 1935 г. в Ростове-на-Дону в семье служащих. После окончания школы в 1952 г. поступил в Ростовский государственный медицинский институт (РГМИ).
На III курсе его привлекла специальность патолого анатома. Выбор профессии и научный творческий путь тогда еще юного студента определила встреча с заведую щим кафедрой патологической анатомии РГМИ проф. Ш. И. Криницким. За первую студенческую научную ра боту "Первичный рак печени" в 1957 г. он был награжден Почетной грамотой и денежной премией.
По семейным обстоятельствам в 1958 г. Александр Федорович перевелся в Днепропетровский медицинский институт, после окончания которого он год работал па тологоанатомом в Днепродзержинске. В это время Алек сандр Федорович получил письмо от проф. Ш. И. Криницкого с приглашением вернуться в РГМИ на кафедру патологической анатомии с перспективой занятия науч ной работой. В 1959 г. он возвратился в Ростов-на-Дону. С 1959 по 1965 г. он работал врачом патологоанатомом в прозектуре центральной городской больнице (ЦГБ) № 1 Ростова-на-Дону, успешно сочетая практическую работу с научной. В 1965 г. А. Ф. Гусарев прошел по конкурсу на должность ассистента кафедры патологической ана томии РГМИ. В 1966 г. он защитил кандидатскую дис сертацию на тему "Морфологические изменения внутрипеченочных сосудов при постнекротическом и септальном циррозах печени", выполненную под руководством проф. И. И. Дорохова.
В последующие годы А. Ф. Гусарева привлекает ин фекционная патология. В 1975 г. им была успешно за щищена докторская диссертация на тему "Материалы по патологической анатомии крымской геморрагической лихорадки: патолого-анатомическое и эксперименталь но-морфологическое исследование". В ее основу вошли 48 уникальных секционных наблюдений крымской ге моррагической лихорадки и 3 наблюдения геморрагиче ской лихорадки с почечным синдромом. Материал был собран за период с 1963 по 1971 г. в Ростовской области,
эндемичной по данной патологии. Оппонентами — акад. АМН СССР М. П. Чумаковым, проф. А. В. Цинзерлингом и проф. Е. А. Домбровской была дана высокая оцен ка выполненного диссертационного исследования. Та кую же оценку дал акад. АМН СССР А. П. Авцын на пленуме правления Всесоюзного общества патологоана томов, посвященном географической патологии.
Этот научный труд до настоящего времени является единственным фундаментальным морфологическим ис следованием, посвященным крымской геморрагической лихорадке. Спустя 28 лет выявленные в 1999 г. в Ростов ской области случаи конго-крымской геморрагиче ской лихорадки заставили вновь обратиться к работам А. Ф. Гусарева. Они оказались актуальными, востребо ванными и еще раз подтвердили положение о том, что любое добросовестно выполненное исследование не пропадает бесследно.
Круг научных интересов А. Ф. Гусарева был много образен и включил в себя вопросы инфекционной пато логии (врожденный сифилис, сепсис), патологической анатомии болезней детского возраста. Им опубликовано более 150 работ А. Ф. Гусарев занимал на кафедре долж ности доцента, затем профессора.
В 1978 г. под руководством А. Ф. Гусарева было ре конструировано помещение прозектуры ЦГБ, в резуль тате чего появилась возможность проводить практиче ские занятия по патологической анатомии для студентов педиатрического факультета.
Александр Федорович был прирожденным препода вателем. Практические занятия и лекции были прониза ны искрометным юмором, остроумными сравнениями и примерами.
Являясь представителем ростовской школы патолого анатомов, А. Ф. Гусарев считал, что вскрытия нужны и ничто их заменить не может. Ежегодно он проводил до 150 аутопсий и исследовал более 10 000 биопсий. Его ди агнозы отличались высокой степенью ответственности, достоверности, клинико-анатомическими сопоставле ниями. Как-то Александр Федорович сказал: "Я вскрыл такое количество трупов, что они составили бы целое кладбище...".
Из крылатых выражений Александра Федоровича за помнилось: "Надо много знать, читать и иногда проти рать окуляры, чтобы давать верное гистологическое опи сание". Он рассказывал, что в доме одного знакомого хи рурга он не увидел ни одной книги по специальности, и это его очень огорчило. По этому поводу он горько иро низировал: "Хирург может позволить себе не читать со временную литературу, патологоанатом не может себе позволить такой роскоши".
Его меткие выражения надолго запоминались студен там, ординаторам, молодым врачам. Когда студент ниче го вразумительного не мог ответить на экзамене, Алек сандр Федорович говорил: "целина".
А. Ф. Гусарев с большим уважением и почтением от носился к своим учителям — профессорам Ш. И. Криницкому и И. И. Дорохову.
44
Александр Федорович был доброжелательным и за ботливым человеком, пользовался уважением сотрудни ков и студентов.
Несмотря на то что практически все свободное время Александр Федорович посвящал любимому делу — пато логической анатомии, он был прекрасным семьянином. 43 года он прожил со своей женой. Лариса Викторовна Гусарева создавала тепло семейного очага, окружала всех заботой, уютом, предоставляя мужу возможность отда вать все силы работе. Часы досуга Александр Федорович дарил сыновьям. Отдыхом для него служили рыбалка, да ча, занятия техникой.
Любовь к патологической анатомии передалась стар шему сыну, который продолжает дело отца. Младший сын стал хирургом.
Втрудные моменты жизни и дни невзгод Александр Федорович улыбался и говорил: "Ничто нас в жизни не может вышибить из седла", — и продолжал задуманное.
Замечательные человеческие качества — удиви тельная доброжелательность, отзывчивость, трудолю бие снискали А. Ф. Гусареву уважение и память тех, кто имел возможность работать рядом с ним или учиться у него. Вся его жизнь отдана служению люби мому делу.
Взаключение нам хочется привести слова К. Симо
нова:
"...Неправда, друг не умирает, Лишь рядом быть перестает..."
Лекции
© КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 616.37-006.001.3
Кл ю ч е в ы е слова : гистологическая классификация, опухоли поджелудочной железы.
О.В. Паклина1, А. И. Щеголев1, Г. А. Галил-Оглы2, Н. Д. Скуба1
КЛАССИФИКАЦИЯ ОПУХОЛЕЙ ЭКЗОКРИННОЙ ЧАСТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
'Отделение патологической анатомии (зав. — проф. А. И. Щеголев) Института хирургии им. А. В. Вишневского РАМН, 113093, Москва; Российский научный центр рентгенорадиологии МЗ и СР РФ, 117837, Москва
Первое издание международной "Гистологической классификации опухолей поджелудочной железы" в Рос сии было опубликовано издательством "Медицина" в 1983 г. [1].
Гистологическая классификация опухолей поджелудочной железы (ВОЗ, 1983)
I. Эпителиальные опухоли А. Доброкачественные
1.Аденома (папиллярная аденома)
2.Цистаденома
Б. Злокачественные
1.Аденокарцинома
2.Плоскоклеточный рак
3.Цистаденокарцинома
4.Ацинарно-клеточный рак
5.Недифференцированный рак
II. Опухоли островков поджелудочной железы III. Неэпителиальные опухоли
IV. Различные другие типы опухолей V. Неклассифицируемые опухоли
VI. Опухоли кроветворной и лимфоидной тканей VII. Метастатические опухоли
VIII. Аномалии эпителия
IX. Опухолевидные процессы
В 1996 г. под редакцией G. Kloppel и соавт. вышло второе издание международной "Гистологической клас сификации опухолей экзокринной части поджелудочной железы" ВОЗ [18]. Принцип разделения новообразова ний в данной классификации базируется прежде всего на их биологическом поведении, поэтому эпителиальные опухоли экзокринной части поджелудочной железы под разделены на доброкачественные, пограничные и злока чественные. В ранее разработанных классификациях по граничные опухоли, или опухоли с непредсказуемым злокачественным потенциалом, отсутствовали. Сейчас к
ним отнесена группа новообразований, по своему гисто генезу сходных с аналогичными опухолями в яичниках. Эта группа включает муцинозную цистаденому, внутрипротоковую папиллярно-муцинозную аденому и солид но-псевдопапиллярную опухоль. После полной хирурги ческой резекции этих медленно растущих новообразова ний прогноз благоприятный, но нельзя недооценивать их злокачественный потенциал, так как он определен са мим нарушением закладки ткани в эмбриогенезе. На пример, гистологически доброкачественная солиднопсевдопапиллярная опухоль имеет склонность к рециди вам и метастазированию.
Международная гистологическая классификация опухолей экзокринной части поджелудочной железы [18]
1. Эпителиальные опухоли 1.1. Доброкачественные
1.1.1.Серозная цистаденома
1.1.2.Муцинозная цистаденома
1.1.3.Внутрипротоковая папиллярно-муцинозная
аденома
1.1.4.Зрелая тератома
1.2. Пограничные опухоли
1.2.1.Муцинозная цистаденома с умеренной диспла зиеи эпителия
1.2.2.Внутрипротоковая папиллярно-муцинозная аденома с умеренной дисплазиеи эпителия
1.2.3.Солидно-псевдопапиллярная опухоль
1.3.Злокачественные
1.3.1.Протоковая тяжелая дисплазия/рак in situ
1.3.2.Протоковая аденокарцинома
1.3.2.1.Муцинозная аденокарцинома
1.3.2.2.Перстневидно-клеточный рак
1.3.2.3.Железисто-плоскоклеточный рак
1.3.2.4.Недифференцированный (анапластический)
рак
45
1.3.2.5. Смешанный протоково-эндокринный рак
1.3.3.Остеокластоподобная гигантоклеточная опу
холь
1.3.4.Серозная цистаденокарцинома
1.3.5.Муцинозная цистаденокарцинома
1.3.5.1.неинвазивная
1.3.5.2.инвазивная
1.3.6. Внутрипротоковый папиллярно-муцинозный
рак
1.3.6.1.неинвазивный
1.3.6.2.инвазивный
1.3.7. Ацинарно-клеточный рак
1.3.7.1.Ацинарно-клеточная цистаденокарцинома
1.3.7.2.Смешанный ацинарно-эндокринный рак 1.3.8. Панкреатобластома
1.3.9.Солидно-псевдопапиллярный рак (злокачест венная солидно-псевдопапиллярная опухоль)
1.3.10.Смешанно-клеточные карциномы
2.Неэпителиальные опухоли
3.Вторичные опухоли
4.Опухолеподобные процессы
Для удобства мы приводим описание доброкачест венных эпителиальных опухолей поджелудочной железы с их пограничными и злокачественными вариантами вместе.
Серозная цистаденома развивается из внутридолькового протокового эпителия. Макроскопически выделяют микрокистозные и олигокистозные серозные аденомы [33]. Микрокистозные аденомы состоят из многочислен ных мелких кист (размерами от 0,01 до 0,5 см в диамет ре), образованных за счет радиально расходящихся тон ких перегородок от центрального рубца, что придает ему звездчатую форму. Олигокистозные серозные аденомы состоят из нескольких более крупных кист (в диаметре от 1 до 6 см), глубоко погруженных в паренхиму железы. Все кисты заполнены прозрачным серозным содержи мым и выстланы уплощенным или кубическим эпители ем со светлой цитоплазмой (рис. 1, а, на вклейке). Цистаденому следует отличать от врожденного поликистоза железы, для которого характерно наличие кистозных об разований по всей длине органа вдоль общего панкреа тического протока, нередко с его кистозным изменением и резкой атрофией других отделов паренхимы [2]. По данным иммуногистохимического и ультраструктурного исследований клетки эпителия содержат в цитоплазме гранулы гликогена [17], экспрессируют низкомолекуляр ные цитокератины (ЦК) и эпителиальный мембранный антиген. Серозные цистаденомы отличаются благопри ятным прогнозом и даже в случаях неполной резекции новообразования не рецидивируют [31]. Злокачествен ным аналогом серозной цистаденомы является серозная цистаденокарцинома. Подобно серозным цистадекарциномам яичников, для нее характерны тяжелая дисплазия эпителия с формированием истинных и псевдопапил лярных структур и выраженный инфильтрирующий рост (рис. 1, б, на вклейке). При ультраструктурном исследо вании в цитоплазме клеток серозных цистаденокарцином также были обнаружены гранулы гликогена [32]. Опухоль встречается очень редко, в пожилом возрасте, независимо от пола. Муцинозная цистаденома, муци нозная цистаденома с умеренной дисплазией эпителия (пограничный тип) и муцинозная цистаденокарцинома представляют группу кистозных опухолей поджелудоч ной железы, которых объединяет наличие гастроэнтеропанкреатической дифференцировки (муцинпродуцирующий эпителий, рис. 1, в, на вклейке) и наличие "овариоподобной" стромы [37]. Данные новообразования встречаются преимущественно у женщин в возрасте 40— 50 лет, каждая третья из которых страдает сахарным диа бетом [35], и составляют 10% всех панкреатических кист и 1% опухолей поджелудочной железы [13], в 80% случа ев локализуются в теле и хвосте поджелудочной железы. Размеры этих опухолей варьируют в пределах 2—35 см и
всреднем составляют 6—10 см в диаметре. Доброкачест венные опухоли по сравнению с пограничным и злока чественным типами имеют небольшие размеры — до 3 см
вдиаметре. Внешне все три типа представляют собой единичные опухолевые узлы с крупнобугристой блестя щей поверхностью (рис. 1, г, на вклейке), при разрезе ко торых в центре видна большая полость с более мелкими полостями по периферии, все полости заполнены слизи стым содержимым. От паренхимы железы опухоли отде лены фиброзной капсулой различной толщины. В муци нозных цистаденокарциномах часть полостей частично или полностью заполнена опухолевыми массами. Глав ными микроскопическими признаками данных новооб разований являются: высокий цилиндрический муцинпродуцирующий эпителий (положительные PAS-реак- ция и окраска альциановым синим), формирующий па пиллярные структуры, и клеточная строма, напоминаю щая строму яичников, с участками гиалиноза и кальциноза. Наличие "овариоподобной" стромы свидетельству ют об общем предшественнике этих опухолей в подже лудочной железе и яичниках [36]. Ridder и соавт. [30] приводят наблюдение, где муцинозная цистаденокарци нома в теле поджелудочной железы сочетается с муцинозной цистаденомой в правом яичнике.
Разделение данных опухолей на доброкачественные, пограничные и злокачественные основывается на степе ни выраженности дисплазии эпителиального компонен та. Доброкачественный эпителий представлен высокими цилиндрической формы клетками с базально располо женными ядрами и светлой муцинсодержащей цитоплаз мой. В пограничных кистозных опухолях выстилающий эпителий умеренной степени дисплазии, в злокачествен ных — тяжелой степени дисплазии. В зависимости от от сутствия или наличия инвазии стенки кисты и фиброз ных перегородок выделяют неинвазивный и инвазивный типы муцинозной цистаденокарциномы, в последнем случае частота мутации гена K-ras выше [6]. Иногда в капсуле и перегородках пограничных муцинозных цистаденом и цистаденокарцином встречаются псевдосар коматозные или истинные саркоматозные участки. При иммуногистохимическом исследовании в эпителиальных клетках пограничных и злокачественных муцинозных кистозных опухолей выявляется экспрессия раково-эм- брионального антигена (РЭА) и СА19-9, а также различ ных ЦК, в 70% случаев это ЦК-7, в 50% - ЦК-20, очень редко — ЦК-19. Клетки стромы дают положительную ре акцию с антителами к виментину, гладкомышечному ак тину и в 20—70% случаев к эстрогеновым рецепторам [6]. Мутации или накопление онкопротеина р53 в целом не характерно для муцинозных кистозных опухолей подже лудочной железы [6].
Внутрипротоковые папиллярно-муцинозные опухоли поджелудочной железы составляют вторую группу опу холей, объединенных наличием желудочно-кишечной дифференцировки. Согласно степени дисплазии эпите лия опухоли делятся на доброкачественную, погранич ную и злокачественные формы. Данные опухоли с оди наковой частотой поражают лиц обоего пола, диагности руются в пожилом возрасте, локализуются в главном панкреатическом протоке в области головки поджелу дочной железы и составляют около 1 % всех опухолей экзокринной части поджелудочной железы [14, 27]. Выра женная гиперсекреция муцина лежит и в основе харак терного клинического признака: вытекание слизи из фатерова соска при эндоскопическом исследовании боль ных [38]. Внутрипротоковая папиллярно-муцинозная аденома (синонимы — виллезная аденома, муцинпродуцирующая опухоль, муцингиперсекретирующая опухоль, муцинозно-протоковая эктазия) макроскопически в ви де единичного полиповидной формы узла на широком основании. Микроскопически, подобно кишечным аде номам, она имеет фиброваскулярную "ножку", от кото рой в просвет протока ответвляются сосочки, выстлан ные высоким цилиндрическим муцинпродуцирующим эпителием с расположенными базально, мелкими оваль-
46
ными ядрами с примесью единичных бокаловидных или эндокринных клеток. При умеренной дисплазии эпите лия опухоль расценивают как пограничную внутрипротоковую папиллярную аденому, при тяжелой дисплазии — как внутрипротоковый папиллярно-муцинозный рак. Последний представлен муцинпродуцирующим эпите лием с признаками тяжелой дисплазии, формирующим сосочки (обычно без фиброваскулярной стромы), кото рые ветвятся или, сливаясь между собой, образуют криброзные структуры. В опухолевых клетках отмечаются вы раженный ядерный полиморфизм, многочисленные ми тозы. Опухоль обладает мультицентричным внутрипротоковым ростом и выраженной продукцией муцина, за счет чего пораженные протоки всегда кистозно расши рены [16], может переходить в инвазивную форму. Диф ференциальная диагностика муцинозной аденокарциномы с инвазивной формой внутрипротокового папилляр- но-муцинозного рака основывается на преобладании в последнем папиллярных структур, а с инвазивной фор мой муцинозной цистаденомы — на отсутствии "овариоподобной" стромы и кистозной полости с фиброзной капсулой. Обнаружено, что иммуногистохимические ха рактеристики муцина при внутрипротоковом папилляр- но-муцинозном раке отличаются от таковых при протоковой аденокарциноме [29, 40]. Также для внутрипротоковых папиллярных раков в отличие от протоковых аденокарцином характерна гиперэкспрессия с-егbВ-2 [33, 34].
Зрелая тератома является доброкачественной экстра гонадной опухолью, состоящей из нескольких тканей, представляющих два или три зародышевых листка. В поджелудочной железе чаще всего встречается в виде дермоидной кисты.
Солидно-псевдопапиллярная опухоль (синонимы — солидно-папиллярная, солидно-кистозная, папиллярнокистозная опухоль) встречается у молодых женщин и ча ще поражает хвост поджелудочной железы [9]. Макро скопически представляет собой узел размерами от 2 до 17 см в диаметре, на разрезе кистозного вида с солидны ми участками и бурого цвета за счет многочисленных кровоизлияний. Кровоизлияния в ткань опухоли связы вают с наличием прогестероновых рецепторов в клетках и циклическими изменениями уровня прогестерона во время менструального цикла [9]. Микроскопически опу холь построена из мелких мономорфных клеток, обра зующих солидные и псевдопапиллярные структуры (рис. 1, д). Ядра опухолевых клеток округлой или овальной формы, митозы редки, цитоплазма прозрачная или светлоэозинофильная, может содержать PAS-положитель- ные гранулы, резистентные к диастазе. Иммуногистохимически опухоль положительна с эпителиальными и нейроэндокринными маркерами, энзимами (трипсин, антитрипсин, амилаза и фосфолипаза), антителами к эстрогеновым и прогестероновым рецепторам [33]. Причи ной возникновения солидно-псевдопапиллярной опухо ли является нарушение эмбриогенеза в виде частичного попадания закладки яичника в область поджелудочной железы, этим и объясняется своеобразный иммуногистохимический профиль опухоли. Опухоль отнесена к по граничному типу, так как у ряда больных были описаны рецидивы и переход опухоли в злокачественную форму с развитием метастазов, прорастанием в двенадцатипер стную кишку и окружающие ткани. Злокачественный ва риант данной опухоли — солидно-псевдопапиллярный рак, который относится к низкодифференцированным аденокарциномам и состоит из мономорфных клеток, формирующих солидные и псевдопапиллярные структу ры. Гистологическое строение соответствует солиднопсевдопапиллярной опухоли с признаками сосудистой и периневральной инвазии.
В первом издании международной "Гистологической классификации опухолей поджелудочной железы" в раз дел "Аномалии эпителия" входили гиперплазия, метапла зия и дисплазия эпителия. В современной классифика ции имеется отдельный раздел "Тяжелая протоковая дисплазия/рак in situ", включенный в группу злокачествен
ных новообразований. Выделение подобного раздела, видимо, связано с полученными данными о возможно сти прогрессии предшествующих неинвазивных измене ний эпителия в инфильтрирующий протоковый рак.
Тяжелая дисплазия эпителия наблюдается в протоках крупных и средних размеров, характеризуется потерей полярности клеток и полиморфизмом ядер с наличием в них грубого хроматина, плотных ядрышек, единичных фигур митоза, псевдостратификацией клеток и образо ванием эпителиальных сосочков (рис. 1, е, на вклейке). Данные изменения эпителия приравниваются к раку in situ. Часто их находят вблизи протоковой аденокарциномы, что может свидетельствовать о мультицентричном характере опухолевого роста. По аналогии с подобными изменениями в эпителии шейки матки, предстательной железы, молочной железы ряд авторов предлагают ввести термин "панкреатическая интраэпителиальная неоплазия" (PanlNs) и разделить ее на три степени согласно сте пени нарастания дисплазии эпителия [17]. При этом в последние годы выявлена одинаковая частота мутаций генов K-ras при Pan IN и инфильтрирующих аденокарциномах, что и позволило некоторым авторам [7] сформу лировать гистологически-генетическую модель опухоле вой прогрессии эпителия протоков поджелудочной же лезы. Эти данные лежат в основе ранней диагностики опухолей путем исследования генов K-ras в панкреати ческом соке, дуоденальном содержимом, сыворотке кро ви или кале.
Протоковая аденокарцинома составляет 75—85% всех первичных опухолей поджелудочной железы [3, 20, 33], в 2 раза чаще встречается у мужчин, после 40 лет, и до сих пор занимает одну из лидирующих позиций в списке причин смерти. В 50—60% случаев опухоль поражает го ловку поджелудочной железы. Макроскопически прото ковая аденокарцинома имеет вид плотного узла непра вильной формы, без четких границ, размерами от 2 до 10 см, на разрезе белесовато-серого или беловато-желтого цвета, волокнистого вида. Нередко в центре опухоли можно обнаружить очаги распада с формированием по лостей неправильной формы. Микроскопически опухоль представлена железистыми структурами из опухолевых клеток с различным содержанием муцина (рис. 2, а, на вклейке), выраженной десмопластической реакцией стромы и периневральным ростом (рис. 2, б, на вклейке). По аналогии с аденокарциномами других органов в про токовой аденокарциноме поджелудочной железы выде ляют высоко-, умеренно- и низкодифференцированную формы. Высокодифференцированные аденокарциномы представлены преимущественно крупными, запоминаю щими протоки железистыми и криброзными структура ми, неравномерно расположенными в склерозированной фиброзной строме, в которой встречаются единичные неизмененные протоки и островки железы. Опухолевые железы могут быть настолько хорошо дифференциро ванными, что их невозможно отличить от нормальных протоков. Неопластические клетки с эозинофильной, иногда бледной цитоплазмой, овальными полиморфны ми ядрами с отчетливыми ядрышками. Распространение опухолевого роста идет по междольковым перегородкам и протокам. В умереннодифференцированных формах в фиброзной строме преобладают средние по размеру же лезистые и тубулярные структуры, практически полно стью замещающие паренхиму органа. По мере уменьше ния дифференцировки клеточный атипизм и количество митозов нарастают, а способность клеток к продукции слизи снижается. Низкодифференцированные формы аденокарциномы состоят из плотно расположенных мел ких, неправильно сформированных желез в слабо разви той строме и солидных участков с фокусами некроза и кровоизлияний (рис. 2, в, на вклейке), а также наличием плоскоклеточной дифференцировки или полной клеточ ной анаплазии, но составляющей менее 20% всей опухо левой ткани. Согласно статистике преобладают высокодифференцированные формы протоковых аденокарцином, низкодифференцированные встречаются редко.
47
Главными клиническими признаками, ассоциирую щимися с поражением головки железы, являются нарас тающая боль в эпигастральной области и потеря массы тела. Признаки диабета присутствуют у 70% больных, 50% имеют его в анамнезе. При поражении тела и хвоста железы заболевание выявляется уже на стадии метастазирования в печень и в забрюшинное пространство (ас цит). Нередкое прорастание опухолью стенок двенадца типерстной кишки может явиться следствием не только длительного существования опухоли, но и возможного ее развития из элементов головки поджелудочной железы, расположенных в толще ее стенок [2].
Иммуногистохимически клетки экспрессируют РЭА, СА 19-9, Du Pan2, Spanl [33]. Уровень этих опухолевых маркеров повышен и в сыворотке крови, что можно ис пользовать для ранней диагностики (СА 19-9 > 37 Ед/мл, DuPan 2 > 300 Ед/мл, РЭА > 3 нг/мл). Также в опухоле вых клетках выявлен муцин MUC 1, который не харак терен для эпителия неизмененных протоков и протоков при хроническом панкреатите [23, 40].
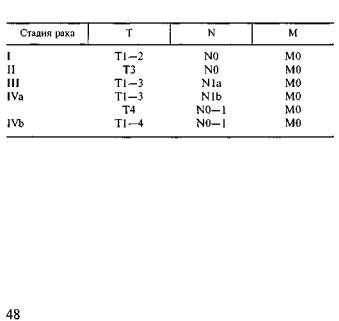
Основными факторами, определяющими исход забо левания и прогноз жизни больных, являются стадия раз вития опухоли (см. таблицу) и ее резектабельность [32].
Резектабельность определяется следующим образом:
•R0 — радикальное удаление опухоли;
•R1 — после резекции рака поджелудочной железы
воставшейся ткани при световой микроскопии наблю даются участки опухоли;
•R2 — макроскопически оставшаяся опухоль.
P. Hermanek [12] было показано, что средняя продол жительность жизни больных после радикального удале ния (R0) рака поджелудочной железы I стадии составляет
всреднем 38,7 мес. Больные с II стадией после R0 живут около 8,5 мес. По данным S. Yonezawa и соавт. [40], 20— 40% больных после R0 живут более 5 лет.
Выделяют следующие гистологические варианты протоковых аденокарцином: муцинозный, перстневид но-клеточный, железисто-плоскоклеточный, недиффе ренцированный и смешанный протоково-эндокринный. Муцинозная аденокарцинома (синоним — коллоидный или слизистый рак) встречается довольно редко в под желудочной железе и составляет около 3% всех опухолей. Более 50% опухолевой ткани представлено муцином, что придает поверхности рака на разрезе желатинозный или коллоидный вид [5]. Микроскопически среди "озер" сли зи видны небольшие группы или пласты опухолевых кле ток (рис. 2, г, на вклейке).
Перстневидно-клеточный рак поджелудочной желе зы, как и аналогичный рак желудка, состоит из перстне видных опухолевых клеток, содержащих муцин [10, 22]. Для данной формы опухоли характерны выраженный
Классификация стадий рака поджелудочной железы [32]
Примечание. Т1 — опухоль диаметром меньше 2 см на ходится в пределах поджелудочной железы; Т2 — опухоль диа метром более 2 см находится в пределах поджелудочной железы; ТЗ — опухоль прорастает двенадцатиперстную кишку, парапанкреатическую клетчатку или желчные протоки; Т4 — опухоль распространяется на желудок, селезенку, толстую кишку или соседние крупные сосуды; N0 — отсутствие метастазов в регио нарных лимфатических узлах; N1 — наличие метастазов в ре гионарных лимфатических узлах; Nla — единичный метастаз в одном регионарном лимфатическом узле; N lb — множествен ные метастазы в нескольких регионарных лимфатических узлах; МО — отсутствие отдаленных метастазов; Ml — наличие отда ленных метастазов.
инфильтрирующий рост с поражением практически всей поджелудочной железы и множественные метастазы. Этот тип рака составляет менее 1% всех опухолей под желудочной железы.
Железисто-плоскоклеточный рак состоит из желези стого и плоскоклеточного компонентов и составляет 2— 4% экзокринных опухолей поджелудочной железы [15]. В большинстве случаев поражается головка поджелудоч ной железы. Плоскоклеточный компонент имеет различ ную степень дифференцировки и занимает не менее 20% объема опухолевой ткани [15]. Развитие плоскоклеточ ного рака возможно в поджелудочной железе (рис. 2, д, на вклейке), но для его подтверждения необходимо ис ключить метастатический характер поражения. Часто при тщательном микроскопическом исследовании боль шого числа препаратов обнаруживают железистые струк туры. Данная форма рака метастазирует одним компо нентом опухоли — полоскоклеточным или железистым. Почти все исследователи отмечают плохой прогноз и считают, что железисто-плоскоклеточный рак возникает у больных после лучевой или химиотерапии по поводу злокачественных опухолей поджелудочной железы или других органов гепатодуоденальной зоны [15, 17]. Про должительность жизни больных, перенесших панкреатодуоденальную резекцию, составляет не более 10—13 мес.
Недифференцированный (анапластический) рак (си нонимы — саркомоподобный рак, полиморфная крупно клеточная карцинома, гигантоклеточная карцинома) представлен крупными полиморфными, гигантскими и/ или веретенообразными клетками. Микроскопически может напоминать саркому [33]. Однако при иммуногистохимическом исследовании в опухолевых клетках вы является ЦК и виментин в различных пропорциях. Дан ная опухоль с одинаковой частотой поражает головку и тело/хвост поджелудочной железы, характеризуется большими размерами (в среднем 11 см) и развитием нек розов, встречается в 2—7% наблюдений. Прогноз крайне неблагоприятный, больные живут около 2 мес.
Смешанный протоково-эндокринный рак состоит из смеси протоковых и эндокринных опухолевых клеток, последние должны занимать не менее 30% общего объе ма опухоли [35]. Протоковые клетки продуцируют муцин и дают положительную реакцию с РЭА, эндокринные клетки — с нейроэндокринными и гормональными мар керами [28]. Поведение опухоли зависит в основном от степени дифференцировки протокового компонента. Данные опухоли крайне редки и составляют менее 1%.
Остеокластоподобная гигантоклеточная опухоль яв ляется злокачественной опухолью поджелудочной желе зы и состоит из недифференцированных эпителиальных и/или мезенхимальных клеток и неопухолевых остеокластоподобных гигантских клеток [И]. Встречается чаще у женщин, средний возраст их 60 лет. Эта редкая опухоль поджелудочной железы напоминает гигантоклеточную опухоль кости. Эпителиальный компонент опухоли со стоит из веретенообразных клеток со слегка эозинофильной цитоплазмой, выраженным полиморфизмом ядер и многочисленными митозами. Вторая популяция клеток представлена неопухолевыми многоядерными остеокластоподобными гигантскими клетками. Кроме этого, в ткани опухоли могут наблюдаться участки остеоидной дифференцировки и протоковой аденокарциномы. Им муногистохимически опухолевые клетки экспрессируют в различных пропорциях ЦК и виментин, а остеокластоподобные клетки положительно реагируют с макрофагальными маркерами и общим лейкоцитарным антиге ном. Описан случай, когда опухоль развилась в фиброз ной стенке муцинозной цистаденокарциномы [33].
Ацинарно-клеточный рак представлен опухолевыми клетками с ацинарно-клеточной дифференцировкой, среди которых иногда встречаются эндокринные клетки. Опухоль в равной мере поражает головку, тело и хвост поджелудочной железы, макроскопически представляет собой узел желтого или красноватого вида, размером бо лее 11 см, часто с участками некроза и кистозной деге-
нерацией, что делает ее сходной с внутрипротоковыми папиляярно-муцинозными опухолями. Опухолевые клетки имеют относительно однотипные округлые ядра и зернистую цитоплазму, последняя PAS-позитивна и резистентна к диастазе. Наблюдаются фигуры митозы. При этом опухолевые клетки обычно формируют ацинарные структуры (рис. 2, е, на вклейке), также может наблюдаться чередование ацинарных структур с трабекулярными и солидными участками. Ацинарно-клеточный рак необходимо отличать от низкодифференцированных эндокринных раков, которые могут формировать струк туры, напоминающие ацинусы и их группы. При иммуногистохимическом исследовании в клетках выявляются панкреатические ферменты (трипсин, хемотрипсин, ли паза, амилаза), в случае наличия эндокринных клеток в них обнаруживаются нейроэндокринные маркеры (синаптофизин, хромогранин А) и панкреатические гормо ны. При ультраструктурном исследовании в опухолевых клетках обнаружены многочисленные митохондрии и микроворсинки, выраженный эндоплазматический ретикулум, плотные соединения типа десмосом, гранулы зимогена размером 660 нм [36, 39], а также гранулы боль ших размеров средней плотности, напоминающие отпе чатки пальцев. Выявленная в образцах опухоли теломераза является маркером ацинарно-клеточного рака и свидетельствует о его агрессивном течении [4]. У ряда больных установлены нарушения хромосом [4], в част ности в половине наблюдений хромосомы 11р, что также может использоваться для дифференциальной диагно стики [9].
Данная опухоль составляет менее 2% всех экзокринных новообразований поджелудочной железы, встреча ется преимущественно у лиц мужского пола в возрасте 50—70 лет. У ряда больных с ацинарно-клеточной кар циномой имеется характерная клиническая картина, обусловленная освобождением липазы из опухолевых клеток: подкожные жировые некрозы, эритемная сыпь, полиартралгии. Средняя продолжительность жизни больных с локальной формой данной опухоли составляет около 38 мес, при наличии метастазов — 14 мес [13]. При этом продолжительность жизни зависит от возраста больных, размера опухоли и клинических проявлений. Больные, имеющие опухоли менее 10 см, живут в сред нем 28 мес, при более крупных опухолях — около 17 мес. Больные моложе 60 лет живут в среднем 26 мес, старше 60 лет — около 13 мес. Больные ацинарно-клеточным ра ком с гиперпродукцией липазы имеют крайне плохой прогноз и живут менее 9 мес [13]. У больных после ре зекции поджелудочной железы нередко развиваются ре цидивы опухоли, что объясняется наличием микромета стазов в поджелудочной железе.
Кистозный вариант ацинарно-клеточного рака — ацинарно-клеточная цистаденокарцинома, редкая опу холь в виде большой, до 25 см, многокамерной инкапсу лированной кисты, заполненной опухолевыми массами, гистологически представлена ацинарными и криброзными структурами, сходными с ацинарно-клеточным раком [33]. Прогноз как при других вариантах ацинарно-кле точного рака.
Смешанная ацинарно-эндокринная карцинома также является редким вариантом ацинарно-клеточной опухо ли, в которой эндокринный компонент составляет не ме нее 30% общего объема опухолевой ткани. Необходимо отметить, что точный гистогенез опухолевых клеток ино гда можно установить лишь при иммуноморфологическом и электронно-микроскопическом исследовании [19]. Страдают в основном люди старшего возраста (50— 80 лет), заболевание может протекать бессимптомно или с развитием механической желтухи, возможно развитие метастазов.
Помимо перечисленных гистологических форм рака, в ктассификацию не вошли светлоклеточный [21], рес- нитчато-клеточный [24] и онкоцитарный [25] варианты карцином, а также хорионкарцинома [33].
Панкреатобластома состоит из эпителиальных клеток
сацинарно-клеточной дифференцировкой, гнезд плос кого эпителия и небольшого количества эндокринных клеток. Опухоль встречается у детей до 15 лет, чрезвы чайно редко у взрослых, составляет менее 1% всех опу холей поджелудочной железы [8]. Пик заболеваемости приходится на возраст от 2,5 до 5 лет, чаще встречается у мальчиков. Эта опухоль может сочетаться с различны ми наследственными синдромами, в частности с синдро мом Видемана—Бекуита [8]. Иногда наблюдается гипер продукция адренокортикотропного гормона с развитием синдрома Кушинга. Данные опухоли плотной конси стенции размером около 9 см, в капсуле, на разрезе белосерого цвета с участками некроза и обызвествления, микроскопически представлены дольками или гнездами мономорфных клеток, разделенных плотной фиброзной тканью. Клетки обычно формируют солидные, реже ацинарные структуры, которые содержат гнезда плоскокле точного эпителия в виде островков или концентрических структур, фрагменты хряща или кости. Клетки ацинар ных структур цилиндрической или кубической формы с бледной зернистой цитоплазмой и базально расположен ными круглыми или овальными ядрами. Иммуногистохимически выявляются панкреатические ферменты и а- фетопротеин. Плоскоклеточные структуры не реагируют
спанкреатическими ферментами и гормонами. При электронной микроскопии в опухолевых клетках наблю даются зимогенные и нейроэндокринные гранулы.
Прогноз жизни при резекции панкреатобластомы от носительно хороший — около 4 лет [15], но возможно метастазирование в печень. Опухоль достаточно хорошо поддается химиотерапевтическому лечению [8], что осо бенно актуально при невозможности выполнения ради кальной операции.
Из доброкачественных стромальных опухолей в под желудочной железе встречаются зернисто-клеточная опухоль, фиброзная гистиоцитома, ювенильная гемангиоэндотелиома, шваннома, из злокачественных — лейомиосаркома, злокачественная шваннома, фибросаркома, злокачественная фиброзная гистиоцитома, липосаркома, рабдомиосаркома и злокачественная гемангиоперицитома [25, 26].
Опухолеподобные поражения поджелудочной железы включают в себя хронический панкреатит, различные кисты, опухолеподобные изменения протоков, ацинусов, гетеротопию, гамартомы, воспалительную псевдо опухоль, липоматозную псевдогипертрофию и очаговую лимфоидную гиперплазию. Из всех перечисленных опухолеподобных поражений наибольшее значение имеет хронический панкреатит, так как при срочных исследо ваниях на замороженных срезах искривленные за счет разрастания фиброзной ткани протоки часто принимают за инфильтрирующий протоковый рак. Различные кисты поджелудочной железы неопухолевой природы в первую очередь представлены псевдокистами (постнекротиче скими кистами) как исходом некроза ткани при остром или хроническом панкреатите, а также ретенционными, паразитарными (эхинококковыми), различными врож денными, лимфоэпителиальными и эндометриальными кистами. Изменения протоков касаются плоскоклеточ ной, толстокишечной (бокалоклеточной) и тонкокишеч ной метаплазии выстилающего эпителия, а также аденоматозной протоковой гиперплазии.
Таким образом, быстрое развитие хирургии поджелу дочной железы в последние годы привело к значитель ному увеличению числа радикальных операций при раз нообразных поражениях этого органа, что, в свою оче редь, предоставило возможность морфологам, используя электронную микроскопию и иммуноморфологию, бо лее детально изучить характер новообразований, опреде лить фенотип опухолевых клеток, следовательно, при близиться к раскрытию гистогенеза новообразований и расширить классификацию опухолей и опухолеподобных поражений экзокринной части поджелудочной же лезы.
49
ЛИ Т Е Р А Т У Р А
1.Гистологическая классификация опухолей печени, желчных путей и поджелудочной железы. — Жене ва, 1983.
2.Саввина Т. В., Скуба Н. Д. // Патологоанатомическая диагностика опухолей человека / Под ред. Н. А. Краевского и др. — М., 1993. — Т. 2. — С. 114-136.
3.Саркисов Д. С, Савина Т. В. // Хирургия поджелу дочной железы / Под ред. М. Д. Данилова, В. Д. Федорова. — М., 1995.
4.Abraham S. С, Wu Т. Т., Hruban R. H. et al. // Am. J. Pathol. - 2002. - Vol. 160. - P. 953-962.
5.Adsay N. V., Pierson C, Sarkar F. et al. // Am. J. Surg. Pathol. - 2001. - Vol. 25. - P. 26-42.
6.Albores-Saavedra J., Angeles-Angeles A., Nadji M. et al. //Am. J. Surg. Pathol. - 1987. -Vol. 11 . - P . 11-20.
7.Bartsch D., Bastian D., Barth P. et al. // Ann. Surg. — 1998. - Vol. 228. - P. 79-86.
8.Buchino J. J., Castello F. M., Nagaraj H. S. // Cancer.
-1984. - Vol. 53. - P. 963-969.
9.Canzonieri V., Berretta M., Buonadonna A. et al. // Lan cet Oncol. - 2003. - Vol. 4. - P. 255-256.
10.Chow L. Т., Chow W. H. // Chin. Med. Sci. J. - 1994.
-Vol. 9. - P. 176-178.
11.Fernandez Garcia L. F., Blanco Fernandez G., Grau Talens J. S. et al. // Rev. Esp. Enferm. Dig. - 2003. -
Vol. 95. - P. 294-295.
12.Hermanek P. // Eur. J. Surg. Oncol. - 1991. - Vol. 17. - P. 167-172.
13.Holen К D., Klimstra D. S., Hummer A. // J. Clin. On col. - 2002. - Vol. 20. - P. 4673-4678.
14.Kakkos S. K, Vagenos С A., Spiliotis J. D. et al. // Hepatogastroenterology. — 1998. — Vol. 45. — P. 2410-2412.
15.Kardon D. E., Thompson L. D., Przygodzki R. M., Hef-
fess С S. И Mod. Pathol. - 2001. - Vol. 14. -
P.443-451.
16.Kimura W. // Nippon Geka Gakkai Zasshi. — 2003. - Vol. 104. - P. 460-470.
17.Kloppel G, Lingenthal G, von Billow M., Кет Н. F. //
Histopathology. - 1985. - Vol. 9. - P. 841-856.
18.Kloppel G, Solcia E., Longnecker D. S. et al. Histological Typing of Tumours of the Exocrine Pancrease. World Health Organization International Histological Classifi cation of Tumors. — 2-nd Ed. — Berlin et al., 1996.
19.Kloppel G. I/ Semin. Diagn. Pathol. - 2000. - Vol. 17.
-P. 104-108.
20.Lo J. W., Fung С H. K., Yonan T. N, Martinez N. //
Cancer. - 1977. - Vol. 39. - P. 2470-2474.
21.Luttges J., Vogel I., Menke M. et al. // Histopathology.
-1998. - Vol. 32. - P. 444-448.
22.Marcy M., Chetaille В., Charafe-Jauffret E. // Ann. Pathol. - 2002. - Vol. 22. - P. 314-316.
23.MongesG. M., Mathoulin-Portier M. P., Acres R. B.etal.
//Am. J. Clin. Pathol. - 1999. - Vol. 112. - P. 635— 640.
24.Morinaga S., Tsumuraya M., Nakajima T. et al. // Acta Pathol. Jpn. - 1986. - Vol. 36. - P. 1905-1910.
25.Morohoshi Т., Funo K, Kunimura T. et al. // Rinsho Byori. - 1994. - Vol. 42. - P. 143-149.
26.Nagakawa Т., Mori K, Nakano T. et al. // Br. J. Surg.
-1993. - Vol. 80. - P. 619-621.
27.Nobukawa В., Suda K, Yamasaki S. // Nippon Geka Gakkai Zasshi. - 2003. - Vol. 104. - P. 439-442.
28.Ohike N., Jurgensen A., Pipeleers-Marichal M., Kloppel G. H Virchows Arch. - 2003. - Bd 442. - S. 258-265.
29.Paye F, SauvanetA., Terries B. et al. // Surgery. — 2000.
-Vol. 127. - P . 536-544.
30.Ridder G. J., Maschek H., Flemming P. et al. // Virchows Arch. - 1998. - Bd 432. - S. 451-454.
31.Siech M., Tripp K, Schmidt-Rohlfmg B. et al. // Langenbeck's Arch. Surg. - 1998. - Vol. 383. - P. 56-61.
32.Sobin L. H, Wittekind Ch. UICC TNM Classification of Malignant Tumors. - New York, 1997. - P. 87-90.
33.Solcia E., Capella C, Kloppel G. / Ed. Washington, DC: Armed Forces Institute of Pathology, 1995.
34.Terada Т., Kawaguchi M., Furukawa К et al. // Pathol. Int. - 2002. - Vol. 52. - P. 740-746.
35.Thompson L. D., Becker R. C, Przygodzki R. M. et al. // Am. J. Surg. Pathol. - 1999. - Vol. 23. - P. 1-16.
36.Toyota N.. Takada Т., Ammori B. J. et al. // J. Hepato biliary Pancreat. Surg. - 2000. - Vol. 7. - P. 102— 106.
37.Whang E. E., Danial T, Dunn J. С et al. // Pancreas.
-2000. - Vol. 21. - P. 147-151.
38.Yamaguchi K, Tanaka M. // Am. J. Gastroenterol. — 1991. - Vol. 86. - P. 835-839.
39.Yonezawa S., Horinouchi M., Osako M. et al. // Pathol. Int. - 1999. - Vol. 49. - P. 45-54.
40.Yonezawa S., Nakamura A., Horinouchi M., Sato E. // J. Hepatobiliary Pancreat. Surg. — 2002. — Vol. 9. — P. 328-341.
Поступила в редакцию 20.10.05
CLASSIFICATION OF PANCREATIC EXOCRINE TU MOURS
O. V.Paklina', A. 1. Schegolev', G.A.Galil-Ogly2, N.D. Skuba'
'A.V.Vishnevsky Institute of Surgary, 113093, Moscow; 2Russian Scientific Centre of Roentgenoradiology, 117837, Moscow
Summar y — Current international histologic classifica tion of exocrine pancreatic tumours is presented. Macroand microscopic characteristics of benign and malignant tumors are described. The role of immunohistochemistry in differen tial diagnosis is shown.
Ark. Pathol., 2005, N. 3, P. 45-50.
50
