
arkhiv patologii_3_2005
.pdf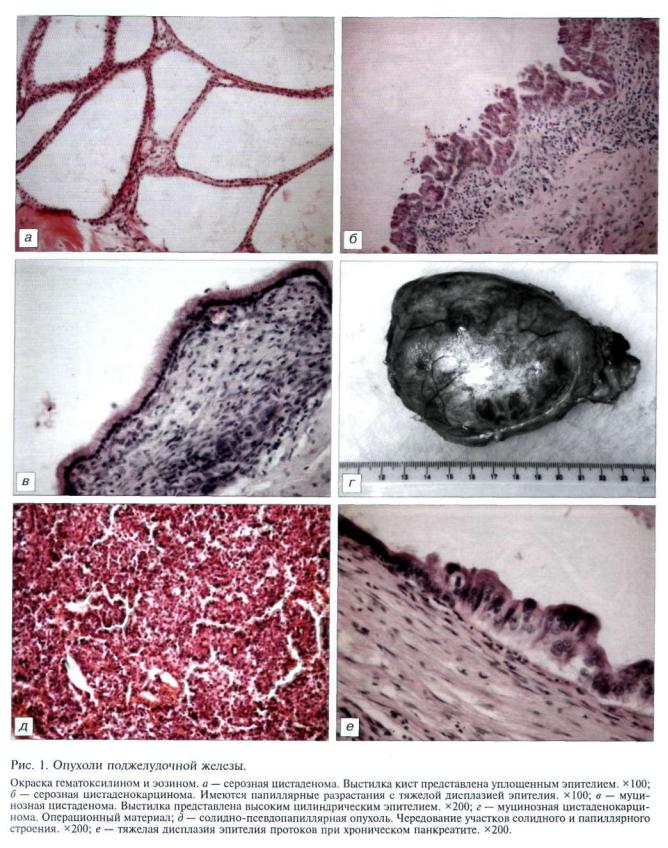
ков, секреция с нарушением кровообращения. Именно в этой группе отмечались образование тонкостенных кист типа "шоколадных" с кровяни стым содержимым и гемосидероз соединительной ткани.
Гистологической особенностью практически всех изученных случаев AM явилось сосуществова ние в пределах одного наблюдения очагов с различ ными тенденциями в эволюции и проявлениями морфофункциональной активности. AM характе ризовался мозаичной картиной экспрессии ядер ных рецепторов к эстрогену и прогестерону в пре делах одного наблюдения. При этом в 60—70% оча гов AM была отмечена высокая степень экспрессии рецепторов к стероидным гормонам как в эпителии желез, так и в клетках цитогенной стромы. В пре делах одного наблюдения сосуществовали очаги AM с высокой степенью экспрессии рецепторов как к эстрогену, так и к прогестерону (рис. 1, а, б, на вклейке). Интересно отметить, что корреляция между гистологическими проявлениями морфо функциональной активности очагов AM и экспрес сией рецепторов к эстрогену и прогестерону опре делялась не всегда. Так, гормонально-чувствитель ными были очаги регрессирующего AM с кистозной трансформацией желез и склерозом цитоген ной стромы (рис. 1, в, на вклейке), а в фокусах AM с пролиферативными изменениями эпителия же лез и цитогенной стромы экспрессия рецепторов к стероидным гормонам не определялась.
Морфологическим своеобразием изученных случаев AM явилось постоянство лейомиоматозной перифокальной гиперплазии миометрия. Та кая гиперплазия наблюдалась нами практически во всех случаях независимо от степени распростране ния AM, его морфофункциональной характеристи ки и наличия сопутствующей ЛМ. Отмечалась кор реляция степени ее выраженности с проявлениями функциональной активности гетеротопических эндометриальных очагов. Во многих наблюдениях перифокальные лейомиоматозные пролифераты трансформировались в микроскопические множе ственные лейомиомы (рис. 2, а, на вклейке).
Определение рецепторов эстрогена и прогесте рона в очагах AM и зонах перифокальной лейомиоматозной гиперплазии показало синхронность и постоянство их гормонального статуса. Показатели экспрессии рецепторов эстрогена и прогестерона варьировали в разных наблюдениях, однако в пре делах одного случая они были одинаковы для эпи телия желез и стромы эндометриальных гетеротопий, а также для зон перифокальной гиперплазии лейомиоцитов (см. рис. 1, б, г, на вклейке). Такое сходство гормонального статуса очагов AM и зон перифокальной лейомиоматозной гиперплазии по зволяет предположить общность их патогенеза.
При анализе изученного материала с позиций гистотопографических и морфологических особен ностей нами было установлено 3 варианта измене ний: 1) сочетание очагового и/или диффузного AM
иЛМ без их топографической связи — 100 (67%) наблюдений; 2) сочетание очагов AM в миометрии
ивнутри ЛМ — 30 (20%) наблюдений; 3) наличие очагов AM только внутри ЛМ при его отсутствии в миометрии — 20 (13%) наблюдений. В наших на блюдениях AM был обнаружен в растущих ЛМ, не имевших признаков фибропластической пере стройки. При этом в лейомиоцитах ЛМ с очагами
AM определялась выраженная экспрессия гладкомышечного актина (рис. 2, б, на вклейке). По мор фологическим данным и тенденциям развития AM внутри ЛМ не отличался от AM в миометрии. Мы также отметили асинхронность очагов, частое со четание прогрессивных и регрессивных изменений в пределах одного наблюдения. Это подтверждало и иллюстрировало дисгормональную природу про цесса, его волнообразное течение и различное со стояние гормональных рецепторов. Нами было от мечено отсутствие выраженной синхронности при значительных различиях в строении и эволюции очагов эндометриоза в матке и в ЛМ. Наличие ак тивных и инволютивных очагов AM в матке и ЛМ, "автономность" эволюции позволили нам предпо ложить их метахронное появление. С нашей точки зрения, при наличии AM внутри ЛМ возможен двоякий морфогенез: включение очагов AM мио метрия в зону роста ЛМ и самостоятельное разви тие AM в растущей миоме. Появление очагов AM внутри ЛМ при отсутствии AM в миометрии не подтверждает теорию о развитии AM из базального слоя эндометрия и создает предпосылки для даль нейшего изучения и обсуждения вопроса о стволо вых клетках миометрия как источнике эндомет риоза.
Полученные нами данные свидетельствуют о волнообразном течении AM с тенденцией к сохра нению функциональной активности эпителиаль ного и стромального компонентов даже в регрес сивных очагах, трансформированных в кисты. Это определяет спорность принятого положения о гор мональной инертности AM [1, 3, 7]. На основании полученных нами данных об экспрессии рецепто ров к стероидным гормонам в очагах AM можно предположить, что неэффективность консерватив ной гормональной терапии таких больных связана прежде всего с асинхронностью и мозаичностью гормональной чувствительности эпителиального и стромального компонентов AM в пределах одного наблюдения. Установленные нами постоянство и корреляция экспрессии рецепторов эстрогена и прогестерона в эпителии желез, клетках цитоген ной стромы очагов AM и в лейомиоцитах зон пе рифокальной гиперплазии миометрия свидетельст вуют о единстве патогенетических механизмов лейомиоматозного и аденомиозного процессов.
Наличие перифокальной гиперплазии лейомио цитов с формированием микроскопических очагов ЛМ и/или диффузным утолщением миометрия приводит к изменению размеров матки при AM. Степень выраженности гиперплазии коррелирует с толщиной миометрия и определяет размер маток больных с AM. Таким образом, характерное для AM увеличение размеров матки, причиной которо го считают циклические изменения эндо- и мио метрия [16], может быть обусловлено также нали чием перифокальной лейомиоматозной гиперпла зии. Обнаружение при бимануальном гинекологи ческом исследовании увеличения размеров матки без четко пальпируемых миоматозных узлов, наря ду с характерными клиническими проявлениями AM, может служить дифференциально-диагности ческим признаком, позволяющим заподозрить эту патологию.
Низкая эффективность гормональной терапии AM определяет важность своевременной диагно стики и выбора оптимальной тактики лечения, что
33
требует комплексного обследования больных с уче том частоты сочетанных форм и особенностей их клинико-морфологической оценки.
ЛИ Т Е Р А Т У Р А
1.АдамянЛ. В., Кулаков В. И. Эндометриозы: Руково дство для врачей. — М., 1998. — 320 с.
2.Баскаков В. П. Эндометриозы. — Л., 1990.
3.Баскаков В. П., Цвелев Ю. В., Кира Е. Ф. Эндометриоидная болезнь. — СПб., 2002.
4.Вихляева Е. М. // Вопр. онкол. — 1990. — № 6. —
С.683-688.
5.Вихляева Е. М., Железное Б. И., Запорожан В. И. Ру ководство по эндокринной гинекологии. — М., 1998.
6.Дамиров М. М. Аденомиоз: клиника, диагностика и лечение. — М.; Тверь, 2002.
7.Железное Б. И., Стрижаков А. Н. Генитальный эн дометриоз. — М., 1985.
8.Железное Б. И., Стрижаков А. Н., Талина И. С. //
Акуш. и гин. - 1990. — № 6. - С. 37-42.
9.Ищенко А. И., Кудрина Е. А. Эндометриоз: диагно стика и лечение. — М., 2002.
10.Кондриков Н. И., Беляева Л. А., Завалишина Л. Э. //
Акуш. и гин. — 1993. — № 1. — С. 33—41.
11.Кондриков Н. И., Адамян Л. В., Могиревская О. А., Бобкова М. В. II Эндоскопия в диагностике и лече нии патологии матки (с курсом эндоскопии): Мате риалы Международного конгресса. — М., 1997. — Т.
2.- С. 13-15.
12.Куценко И. И. Генитальный эндометриоз: проблемы диагностики и лечения. — Краснодар, 1994.
13.Майер И. О., Данелия Г. С. // Акуш. и гин. — 1983.
-№ 11. - С. 58-59.
14.Сидорова И. С, Коган Е. А., УнанянА. Л. и др. // Ма териалы пленума Российской ассоциации врачей акушеров и гинекологов. — Ижевск, 2000. —
С.240-244.
©КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 618.14-006.363-092:612.018]-008.9-092.18-078.33
15.Сидорова И. С, Коган Е. А., Зайратьянц О. В. и др. // Акуш. и гин. - 2002. — № 3. - С. 32-38.
16.Сметник В. П., Тумилович Л. Г. Неоперативная ги некология: Руководство для врачей. — М., 1998.
17.Стрижаков А. Н., Давыдов А. И. Эндометриоз: кли нические и теоретические аспекты. — М., 1996.
18.Bergholt Т., Eriksen L., Berendt N. et al. // Hum. Reprod. - 2001. - Vol. 16. - P. 2418-2421.
19.Fukamatsu Y, Tsukahara Y, Furuta T. // Acta Obstet. Gynaecol. Jpn. - 1984. - Vol. 36. - P. 431-436.
20.Sakamoto A. // Am. J. Obstet. Gynecol. — 1991. — Vol. 165, N 1. - P. 198-201.
21.Sammour F., Pirwany I., Usubutum A. et al. // Gynecol. Obstet. Invest. - 2002. - Vol. 54, N 4. - P. 213-216.
22.Schweppe K. W., Wynn R. M. // Eur. J. Obstet. Gynecol. Reprod. Biol. - 1984. - Vol. 17. - P. 193-208.
Поступила в редакцию 01.12.04
COMBINATION OF UTERINE ADENOMYOSIS WITH LEIOMYOMA
N.M.Anichkov, V.A.Pechenikova
Mechnikov State Medical Academy, 195067, St-Petersburg
S u m m a r y — A morphological analysis of 50 cases of adenomyosis (AM) and 150 cases of AM combination with lei omyoma (LM) with regard to their morphofunctional and histotopographical interrelations was performed. The asynchro nous character and mosaicism of estrogen/progesteron recep tors expression in the gland epithelium and AM stromal cells of one patient was established immunohistochemically. This probably determines uneffective hormonal therapy of AM pa tients. A correlation of steroid hormone receptor expression in AM foci and in leiomyocytes of perifocal myometrium hy perplasia was also found. This indicates a common pathogenic mechanism of AM and LM. An increase of the size of the uterus depended on the degree of perifocal leiomyocyte hy perplasia with microscopical nodule formation in LM.
Ark. Pathol., 2005, N. 3, P. 31-34.
К л ю ч е в ы е слова : лейомиомы матки, эпидермальный фактор роста, рецептор к эпидермальному фактору роста, инсулиноподобный фактор роста 1, фактор роста тромбоцитарных пластинок, трансформирующий фактор роста Д
Е. А. Коган, В. Е. Игнатова, Т. Н. Рухадзе, Е. А. Кудрина, А. И. Ищенко
РОЛЬ РОСТОВЫХ ФАКТОРОВ В РАЗВИТИИ РАЗНЫХ ГИСТОЛОГИЧЕСКИХ ТИПОВ ЛЕЙОМИОМЫ МАТКИ
Кафедра патологической анатомии (зав. — акад. РАН и РАМН, проф. М. А. Пальцев), кафедра акушерства и гинекологии (зав. — проф. Н. М. Побединский) ММА им. И. М. Сеченова, 119881, Москва
Лейомиомы матки (ЛМ) — гетерогенная группа опухолей, отличающихся своим гистологическим строением. При выделении различных гистологи ческих типов морфологи учитывают прежде всего характер роста опухоли, пролиферативную актив ность, наличие признаков клеточного атипизма и развитость стромы. В соответствии с данными при знаками выделяют следующие основные гистоло гические типы доброкачественных гладкомышечных опухолей матки: лейомиома (код 8890/0; в оте чественной литературе используется термин "про стая" ЛМ) и ее варианты — клеточная, митотически активная, эпителиоидная, миксоидная, атипи ческая ЛМ и липолейомиома (ВОЗ, 2003).
В ряде классификаций одни и те же гистологи ческие типы ЛМ обозначаются разными термина-
ми, например митотически активную ЛМ называ ют также пролиферирующей ЛМ [2].
В патогенезе ЛМ исследователи отводят значи тельное место гормональному дисбалансу стероид ных гормонов и их рецепторов, гонадотропных гормонов, развитию вторичного иммунодефицита, нарушениям функции щитовидной железы и коры надпочечников, наследственной отягощенности и другим факторам, которые служат фоном для раз вития патологического процесса в матке [6,10]. Ус тановлено, что ЛМ является истинной опухолью, которой свойственна моноклональность опухоле вых клеток [3]. Однако вопрос о том, что является пусковым механизмом, приводящим к возникно вению и дальнейшему развитию подобных патоло гических изменений, остается открытым. В послед нее время уделяется большое внимание роли фак-
34
торов роста в патогенезе ЛМ, которые, как извест но, являются проводниками действия гормонов, в частности эстрогенов, способны воспроизводить многие их эффекты в ткани матки и влиять на со отношение процессов пролиферации и гибели кле ток, в том числе и путем апоптоза [1, 5, 6]. Как бы ло установлено, апоптоз снижается при гормональ ных нарушениях, повышении продукции гонадотропинов, стрессах, старении организма, сниже нии иммунной и противоопухолевой защиты [6]. Продукция определенных факторов роста клетка ми ЛМ может также оказывать местное действие и на эндометрий, что способствует развитию сочетанной патологии — гиперпластических измене ний, аденомиоза.
Значение ростовых факторов в патогенезе ЛМ подтверждается также и тем, что одним из основ ных критериев определения злокачественного по тенциала ЛМ и их дифференциальной диагностики с лейомиосаркомами служит индекс митотической активности опухолевых клеток [4, 7, 8J. В литера туре указывается на экспрессию эпидермального фактора роста (ЭФР), рецепторов к эпидермальному фактору роста (ЭФР-Р), инсулиноподобного фактора роста 1-го типа (ИПФР1), основного фак тора роста фибробластов (ФРФ), фактора роста тромбоцитарных пластинок (ТПФР), трансформи рующего фактора роста р (ТФРр) [4, 7—10] в ткани ЛМ. Однако работы посвящены изучению одного или нескольких из перечисленных цитокинов. Анализ особенностей их экспрессии в разных гис тологических типах опухоли, различающихся своей пролиферативной активностью, а также клиникоморфологические параллели, как правило, отсутст вуют.
Цель исследования состояла в оценке роли фак торов роста в патогенезе и морфогенезе простой, клеточной и митотически активной ЛМ, различаю щихся пролиферативной активностью опухолевых клеток.
Исследование выполнено на операционном материа ле от 23 пациенток репродуктивного возраста (от 18 до 48 лет) с диагнозом ЛМ. Большинство больных (16 жен щин) предъявляли жалобы на обильные и длительные менструации, приводящие к развитию постгеморрагиче ской анемии. Всем женщинам было проведено оператив ное лечение лапароскопическим или лапаротомическим доступом: миомэктомии (14 пациенток), надвлагалищные ампутации матки (8), экстирпации матки (1). Опе рации преимущественно проводились в секреторную фа зу менструального цикла. У большинства пациенток [15] давность заболевания не превышала 3 лет, у 8 пациенток с ЛМ она составляла от 4 до 12 лет. Следует выделить 3 женщин, у которых был отмечен быстрый рост миоматозных узлов, т. е. увеличение матки на 5 нед беремен ности менее чем за 1 год наблюдения, а также 1 паци ентку с рецидивом данной доброкачественной опухоли матки через 7 лет после миомэктомии, у которой также наблюдался быстрый рост ЛМ в течение последнего года. Единичные узлы ЛМ выявлены у 7 (30%) женщин, мно жественные — у 16 (70%). Преобладали узлы интрамуральной (13 больных) и субсерозной (10 больных) лока лизации. Последние 2 года больные, включенные в ис следование, не применяли гормональных препаратов.
Изучали макропрепарат (удаленная матка и миоматозные узлы). При макроскопическом исследовании раз меры матки варьировали от 7 до 15 нед беременности, а сами узлы были диаметром от 1,5 до 10 см, бело-розового цвета, тяжистого вида, в некоторых определялись очаги вторичных изменений — гиалиноза, некроза, петрифи
кации и кистозной дегенерации. Из каждой опухоли вы резали от 2 до 5 кусочков, кроме того, исследовали интактный миоме хрий (1—2 кусочка) и ткань эндометрия. Проводили гистологическое исследование парафиновых срезов с окрасками гематоксилином и эозином и пикрофуксином по ван Гизону.
Иммуногистохимическое исследование выполняли на серийных парафиновых срезах из лейомиоматозных узлов, миометрия и эндометрия женщин. При этом ка ждый из анализируемых гистологических типов лейомиом был представлен как одиночными, так и первичномножественными опухолями. Иммуногистохимические реакции ставили по общепринятой методике с демаски ровкой антигенов в СВЧ-печи и использованием пер вичных антител к Ki-67 ("Dianova", 1:40), PCNA ("Novocastra", 1:100), ЭФР ("Santa Cruz Biotechnology", 1:100), ЭФР-Р ("Santa Cruz Biotechnology", 1:100), ТПФР ("Calbiochem", 1:100), ТФРр (RND, 1:100) и моноспецифиче ских сывороток ИПФР1 (Pepro Tech ECltd., 1:100). В ка честве вторичных антител и визуализирующей системы применяли LSAB KIT ("Dako"). Ставили отрицательные (без первичных антител) и положительные (рак легкого с известной экспрессией маркеров) контрольные реак ции. Результаты иммуногистохимических реакций оце нивали в баллах полуколичественным методом по про центу окрашенных клеток.
Оценку экспрессии Ki-67 и PCNA проводили путем подсчета процента окрашенных ядер на 1000 клеток.
Статистический анализ проводили по критерию Уай та для малых выборок.
В результате проведенного исследования уста новлены иммуногистохимические особенности разных гистологических типов ЛМ.
Не было обнаружено каких-либо макроскопи ческих различий между ЛМ в зависимости от их гистологического строения.
При гистологическом исследовании одиночных миоматозных узлов простая ЛМ диагностирована у 1 пациентки, клеточная — у 4, митотически актив ная — у 2 женщин. В случаях множественных ЛМ у одной и той же пациентки, как правило, обнару живались клеточные и митотически активные типы опухоли, часто с вторичными изменениями ткани. Митотически активные ЛМ выявлены нами у 9 больных с множественными узлами опухоли.
Простая ЛМ была построена из пучков гладкомышечных клеток, хаотично расположенных в раз витой строме. Миоциты вытянутой формы, сред них размеров, с небольшими ядрами. Фигуры ми тоза не определялись. В строме имелось небольшое количество сосудов, преимущественно синусоидного типа, часто со склерозированными стенками. В толще крупных узлов, как правило, обнаружива лись вторичные изменения некротического и ишемического характера.
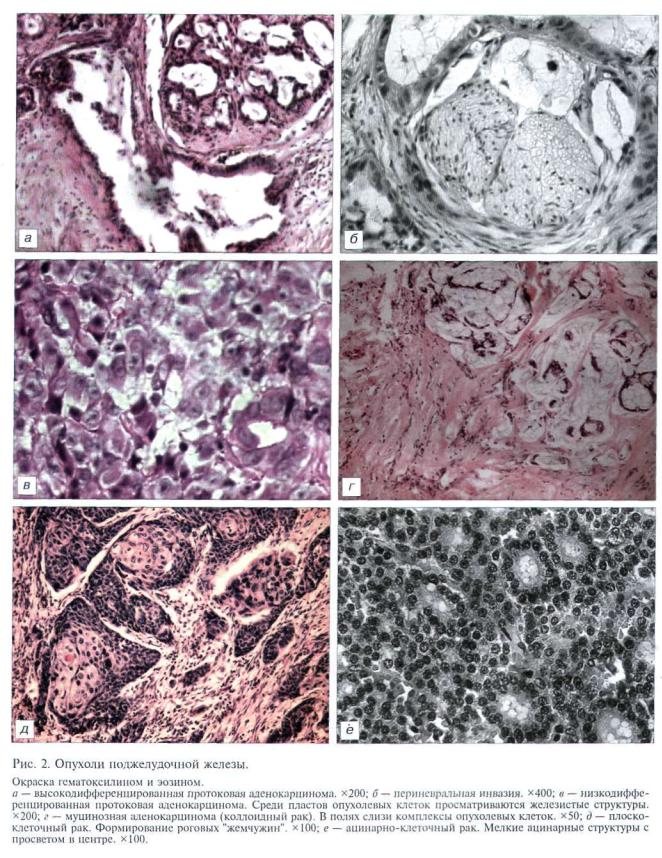
Клеточная ЛМ отличалась от простой высокой плотностью гладкомышечных элементов и слабой выраженностью стромы, которая была представле на лишь в виде тонкостенных сосудов капиллярно го и синусоидного типа (рис. 1, а, на вклейке).
Митотически активная ЛМ, так же как и кле точная, характеризовалась преобладанием мышеч ного компонента с митотической активностью около 5 фигур митоза при окраске гематоксилином и эозином в 10 полях зрения при большом увели чении. При этом митотическая активность носила очаговый характер и выявлялась в виде множест венных очагов пролиферации, локализованных, как правило, вокруг сосудов синусоидного типа. Значительно реже, чем при простой миоме, наблю-
35
дались вторичные изменения в толще узла (рис. 1, б, в, на вклейке).
ЛМ микроскопических размеров были, как пра вило, клеточными и митотически активными и со стояли из множественных зон роста, вокруг кото
рых располагались клетки округ лой формы с крупными гиперхромными ядрами и широким ободком цитоплазмы.
При исследовании Ki-67 про дукт реакции обнаруживался в ядрах единичных клеток только в митотически активной и клеточ ной ЛМ. В простой ЛМ митотическая активность по Ki-67 со ставила 0% (рис. 2, а). Ki-67-экс- прессирующие клетки выявля лись как среди перицитарных элементов сосудов, так и в при лежащих к ним гладкомышечных клетках. Митотически активная ЛМ превосходила клеточную как по среднему уровню экспрессии этого маркера (1,2 и 0,27% соот ветственно), так и по количеству очагов пролиферации (см. рис. 2, а). При этом Ki-67 не выявлялся в окружающем миомы миомет рий, а в секреторном эндометрии определялся на сравнительно низком уровне как в клетках стромы, так и в эпителии. В гиперплазированном эндометрии средний уровень экспрессии Ki67 составлял 2% в эпителии и строме.
PCNA обнаруживался в ядрах как гладкомышечных, так и стромальных клеток в несколько больших количествах по сравне нию с Ki-67, но повторяя те же закономерности распределения и количественных различий (рис. 1, г; на вклейке 2, б).
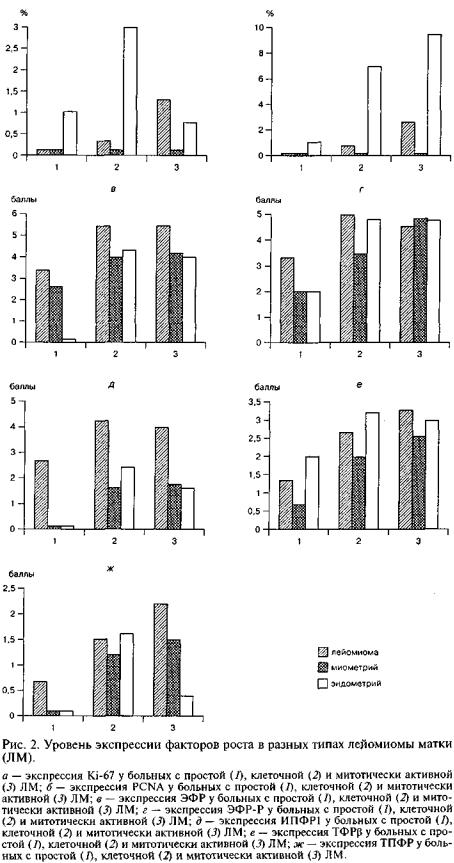
ЭФР локализовался в цито плазме клеток и выявлялся не только в ЛМ, но и в миометрий, а также в эндотелии сосудов стромы ЛМ и в эндометрии боль ных. Более высокая экспрессия ЭФР обнаружена у пациенток с митотически активными и кле точными ЛМ как в самих опухо лях, так и в сохранном миомет рий и эндометрии (рис. 2, в; 3, а, на вклейке).
ЭФР-Р выявлялся на клеточ ной мембране, в цитоплазме и в ядрах клеток ЛМ, миометрия, эндотелия сосудов стромы ЛМ и эндометрия больных. Более вы сокая экспрессия ЭФР-Р обна ружена у пациенток с митотиче ски активными и клеточными ЛМ как в ткани самих опухолей, так и в сохранном миометрий и эндометрии (рис. 2, г; 3, б, на вклейке).
ИПФР1 обнаружен в цитоплазме клеточных элементов ЛМ, миометрия, клетках стромы, эндо телии сосудов ЛМ и эндометрии больных (рис. 2, д; 3, в, на вклейке). Более высокая экспрессия ИПФР1 выявлена у пациенток с митотически ак-
36
тивными и клеточными ЛМ не только в самих опу холях, но и в сохранном миометрии и эндометрии. Кроме того, отмечена более высокая экспрессия фактора роста в миоме по сравнению с интактным миометрием и эндометрием независимо от гисто логического типа опухоли.
ТФРр выявлялся в цитоплазме и ядрах клеток всех изученных нами тканей (рис. 2, е; 3, г, на вклейке). Более высокая экспрессия ТФРр обнару жена у пациенток с митотически активными, чуть меньшая — с клеточными ЛМ и наименьшая — с простыми ЛМ. То же соотношение в экспрессии фактора роста сохранялось и при сравнении миометрия и эндометрия пациенток с различными ти пами ЛМ.
ТПФР обнаруживался в небольших количест вах в цитоплазме гладкомышечных клеток и эн дотелии сосудов стромы ЛМ. В митотически ак тивных ЛМ его экспрессия была выше, чем в про стых ЛМ (рис. 2, ж).
Особых различий в значениях экспрессии ис следуемых факторов в ткани миомы, миометрия и эндометрия в возрастных группах среди женщин репродуктивного и позднего репродуктивного воз раста выявлено не было. Однако следует отметить, что для женщин в возрасте от 40 до 48 лет харак терны более высокие показатели ТФРр. Так, в 1-й группе значение ТФРр в клетках миомы в среднем составило 2,5 балла, а во 2-й — 3,25 балла, что в 1,3 раза выше. В то же время в миометрии у моло дых женщин экспрессия данного фактора состави ла 1,25 балла, а среди женщин старше 40 лет — 4,67 балла.
В результате проведенных исследований уста новлена важная роль ЭФР, ЭФР-Р, ИПФР1, ТФРр и ТПФР в пато- и морфогенезе различных гисто логических типов ЛМ. Для всех гистологических типов миомы матки характерна максимальная вы раженность экспрессии ЭФР и его рецептора в сравнении с другими факторами. При этом значе ние экспрессии ЭФР и ЭФР-Р в митотически ак тивных миомах выше, чем в клеточных и особенно обычных миомах. Так, значение активности ЭФР в пролиферирующих миомах в среднем составило 5,45 балла, в клеточной — 5,42 балла, в простой — 3,33 балла.
Следует также выделить группу миом матки с отмеченным ростом. Все они относились к мито тически активным миомам. Экспрессия ЭФР в миомах с отмеченным ростом составила 6 баллов, в интактном миометрии — 5,33 балла, в других про лиферирующих миомах экспрессия ЭФР в ткани миомы соответствовала 5,14 балла, в миометрии — 3,5 балла. При этом во всех случаях отмечено пре обладание экспрессии ЭФР над ЭФР-Р.
Установлена определенная зависимость в экс прессии другого, не менее важного для развития и роста миоматозных узлов фактора — ИПФР1. И в пролиферирующей, и в клеточной, и в простой миомах отмечена более высокая экспрессия ИПФР в сравнении с интактным миометрием и эндомет рием.
ТПФР выявляется в клетках ЛМ в умеренных количествах, при этом прослеживается та же зако номерность: уровень ТПФР в клеточной миоме вы ше, чем в простой, и ниже, чем в пролиферирую щей.
Все перечисленные факторы роста обнаружива ются не только в клетках паренхимы, но и в строме ЛМ, особенно в эндотелии сосудов и капилляров. Также данные наблюдения показали, что рост ЛМ регулируется этими факторами роста. Новообразо ванные сосуды могут стать источником патологи ческих сильных кровотечений при ЛМ [9, 10]. Об наружена также связь между особенностями ангиогенеза в ЛМ и накоплением в них гепаринсвязывающих факторов роста, что может обосновывать создание новых методов терапии ЛМ путем ингибирования ангиогенеза.
Простая и клеточная миомы матки, возникнув как моноклональные опухоли, постепенно, мед ленно увеличиваются в размерах, в основном не за счет пролиферации опухолевых клеток, так как митотическая активность их очень низкая, а за счет вероятного увеличения продолжительности жизни самих клеток, сниженного апоптоза и возрастания массы соединительнотканного компонента (фибробластов и внеклеточного матрикса), о чем свиде тельствуют результаты нашего исследования, а так же данные литературы [5, 7].
Митотически активная миома матки может рас ти за счет активации пролиферативных процессов, что было показано нами и согласуется с данными литературы [2]. При этом рост опухоли может быть также следствием совокупности и других факторов, таких как вероятное увеличение продолжительно сти жизни самих клеток, сниженный апоптоз и возрастание массы соединительнотканного компо нента (фибробластов и внеклеточного матрикса).
Наши данные подтверждают, что миома матки — это истинная доброкачественная опухоль, так как разнообразие клеток находится в пределах фенотипического ряда. Увеличение экспрессии Ki-67, хо тя и свидетельствует о повышении пролиферативной активности в быстро растущих миоматозных узлах, сопровождается низким митотическим ин дексом.
Понимание механизмов развития и прогрессирования различных гистологических типов ЛМ важно не только для теоретического обоснования эволюции доброкачественных опухолей. Данная проблема имеет и большое практическое значение, поскольку современные органосохраняющие мето ды лечения ЛМ ставят перед морфологами задачу определения злокачественного потенциала опухо ли. Кроме того, обоснование участия факторов роста в патогенезе маточных кровотечений может способствовать разработке новых подходов к тера пии метроррагий.
За к л ю ч е н и е
Вразвитии лейомиомы (ЛМ) матки важную роль играют следующие факторы роста: ЭФР, ЭФР-Р, ТПФР, ТФРр и ИПФР1, стимулирующие пролиферацию клеток, стромы и ангиогенез в опу холи. Митотически активная ЛМ характеризуется более высоким содержанием перечисленных фак торов по сравнению с простой и клеточной JIM, что может стимулировать процессы ангиогенеза и способствовать маточному кровотечению.
ЛИТЕРАТУРА
1.Пальцев М. А., Иванов А. А., Северин С. Е. Межкле точные взаимодействия. — М, 2003.
37
2.Руководство по эндокринной гинекологии / Вихляева Е. М., Железное Б. И., Запорожан В. Н. и др.
-М., 1997.
3.Савицкий Г. А., Савицкий А. Г. Миома матки (про блемы патогенеза и патогенетической терапии). — СПб., 2003.
4.Anania Carol A., Stewart Elizabeth A., Quade Bradley J. et al. // Mol. Hum. Reprod. - 1997. - Vol. 3, N 8. - P. 685-691.
5.Gao Zhijian, Matsuo Hiroya, Wang Yin et al. // J. Clin. Endocrinol. Metab. — 2001. — Vol.86, N11. — P. 5593-5599.
6.Matsuo Hiroya, Maruo Takeshi, Samoto Takashi // J. Clin. Endocrinol. Metab. - 1997. - Vol. 82, N 1. - P. 293-299.
7.Shimomura Yosuke, Matsuo Hiroya, Samoto Takasi et al. //J. Clin. Endocrinol. Metab. - 1998. -Vol. 83, N 6.
-P. 2192-2198.
8.Somkuti Stephen G., Yuan Lingwen, Fritz Marc A., Lessey Bruce A. /I J. Clin. Endocrinol. Metab. - 1997. - Vol. 82, N 7. - P. 2192-2197.
9.Stewart Elizabeth A., Nowak Romana A. // Hum. Reprod. Update. - 1996. - Vol. 2, N 4. - P. 295-306.
10.Wu J., Cheng Y. // Chyng Hua Fu Chan Ко Tsa Chin.
-1995. - Vol. 30, N 10. - P. 603-607.
Поступила в редакцию 15.07.04
© A. H. БОБИН, Ю. Г. ПАРХОМЕНКО, 2005 УДК 616.127-02:616.927]-091.8
A ROLE OF GROWTH FACTORS IN DEVELOPMENT OF VARIOUS HISTOLOGICAL TYPES OF UTERINE LEIOMYOMA
E.A.Kogan, V.E. Ignatova, T.N.Rukhadze, E.A.Kudrina, A.I.Ischenko
I.M.Sechenov Moscow Medical Academy, 119881, Moscow
Summary — The following growth factors play a role in the development of uterine leiomyoma: EFRepidermal growth factor, EFR-R- receptor of EFR, TGFthrombocytic growth factor, TGFbtransforming growth factor beta, ILGF1 - insulin-like growth factor of the 1st type. These fac tors stimulate proliferation of cells, stroma and angiogenesis in the tumor. Mitotically active leiomyoma is characterized by a higher content of these growth factors vs ordinary and cellular leiomyomas. Treatment of uterine leiomyoma should be concentrated on removal of tumor cells from the body as leiomyomas especially its mitotically active variant produce growth factors which are able to stimulate tumor growth by the autocrine mechanism.
Ark. Pathol., 2005, N. 3, P. 34-38.
К л ю ч е в ы е слова : брюшной тиф, миокардит, морфология.
А. Н. Бобин1, Ю. Г. Пархоменко2
ПАТОМОРФОЛОГИЯ И МОРФОГЕНЕЗ МИОКАРДИТА ПРИ БРЮШНОМ ТИФЕ
1 5-й Центральный военный клинический госпиталь Военно-Воздушных Сил, 143140, Красногорск; 2 НИИ морфологии человека РАМН, 117418, Москва
До настоящего времени в литературе нет едино го мнения о характере и частоте поражений сердца при брюшном тифе (БТ), до конца неясны их па тогенез и танатогенетическая значимость. Имею щиеся сведения крайне противоречивы. Одни ав торы [1,2] считают, что изменения в миокарде ча ще носят дистрофический характер и реже — вос палительный, другие [4, 13] полагают, что их сле дует расценивать исключительно как миокардит, который является частым, но недиагностируемым осложнением и причиной смерти. В большинстве клинических наблюдений [5, 6, 11] частота миокар дита не превышает 12%, в отдельных сообщениях [16] достигает 32%. О структурных изменениях сердца при БТ данных мало [3, 8, 15]. Обычно от мечают картину неспецифического интерстициального миокардита, иногда — гранулематозного миокардита с "тифозными узелками". Эндокардит и перикардит встречаются редко [12].
Целью настоящего исследования явилось мор фологическое обоснование закономерного разви тия миокардита при тяжелом течении БТ, изучение его патоморфологии и морфогенеза.
Исследован материал 16 летальных исходов БТ от умерших военнослужащих советских войск в Афганиста не за период 1983—1984 гг. Все умершие — мужчины в возрасте от 18 до 34 лет, 13 из них в возрасте 18—20 лет. В основу работы положены результаты изучения архив ных образцов сердца, данные протоколов патолого-ана- томического вскрытия и историй болезни. В настоящее исследование не вошли случаи с гнойно-воспалительны ми осложнениями, что позволило исключить влияние на
сердце вторичного инфекционно-воспалительного эндотоксикоза.
В удовлетворительном состоянии поступили в госпи таль 5 больных, средней степени тяжести — 4, тяжелом — 4, крайне тяжелом — 3. Средний срок госпитализации составил 6,2 ± 1 день, средний срок диагностики — 7,3 ± 1 день с момента заболевания. Лабораторными ме тодами БТ при жизни подтвержден у 7 больных. В ос тальных случаях диагноз установлен на основании кли- нико-эпидемиологических данных, результатов вскры тия и посмертного бактериологического исследования желчи. Этиотропное лечение проводилось левомицетином. У 13 больных наблюдались различные симптомы поражения сердечно-сосудистой системы и лишь у 5 на основании клинической картины и данных ЭКГ диагно стирован инфекционно-токсический миокардит. На 1-й неделе заболевания умерли 4 больных, на 2-й — 6, на 3-й — 4, на 4-й — 2. Продолжительность заболевания в среднем составила 12,3 ± 1,6 дня (с колебаниями от 4 до 23 дней). Непосредственной причиной смерти послужи ли миокардит (6 случаев), кишечное язвенное кровоте чение (5), инфекционно-токсический шок (4), тромбо эмболия легочной артерии (1).
Для морфологического исследования использовали архивные гистологические препараты и образцы сердца, хранившиеся в 10% растворе нейтрального формалина. Парафиновые срезы толщиной 5—7 мкм окрашивали ге матоксилином и эозином, азуром II — эозином, пикрофуксином по ван Гизону с докраской эластических во локон резорцин — фуксином, гематоксилином — основ ным фуксином — пикриновой кислотой (ГОФПК), пик- ро-Маллори III, ставили ШИК-реакцию. Гистоморфометрическое исследование проводили с применением количественных и полуколичественных методик. Для ко личественной оценки использовали систему интерактив-
38
ного анализа изображения ЛЭТИ и окулярную морфометрическую сетку. В поляризованном свете исследова ли окрашенные срезы на универсальном биологическом микроскопе "Jenamed-2" ("Karl Zeiss").
Полученные результаты подвергали статистической обработке с применением статистического графического пакета Statgraphics 5.O. Средние значения изучаемых па раметров сравнивали по тесту Колмогорова—Смирнова (пакет Statgraphics) и ^-критерию Стьюдента. Значимыми считали различия при вероятности ошибки (р) не более 0,05. Регрессионные модели считали достоверными при уровне значимости (р) менее 0,05.
У 13 умерших обнаружены изменения стенок сосудов микроциркуляторного русла сердца, преж де всего артериол и венул, которые можно опреде лить как васкулит. Он характеризовался набухани ем, повреждением эндотелиоцитов, вплоть до их гибели с отслойкой клеток и оголением базальной мембраны, деструкцией стенок в виде мукоидного набухания, иногда фибриноидного некроза, их клеточной инфильтрацией (рис. 1, о, на вклейке).
Микроциркуляторные нарушения в интрамуральных сосудах сердца характеризовались прежде всего дистонией и разной степенью кровенаполне ния. Артериолы в основном были спазмированы, находились в состоянии неравномерного кровена полнения. Капилляры и венулы, как правило, вы глядели расширенными, полнокровными. Обраща ли на себя внимание гемореологические наруше ния в венозной сети — стаз, сладж эритроцитов, лейкоцитарные агрегаты, иногда микротромбы (рис. 1, б, на вклейке).
Воспалительный инфильтрат в межуточной и периваскулярной строме миокарда обнаружен у всех умерших. Клеточный состав его был представ лен лимфоцитами, макрофагами, плазматически ми, тучными клетками, фибробластами. Нейтрофилы встречались редко. Преобладали лимфоциты и макрофаги. Очаги воспалительной инфильтра ции были небольшими, множественными или представлены скоплениями (рис. 1, в, на вклейке).
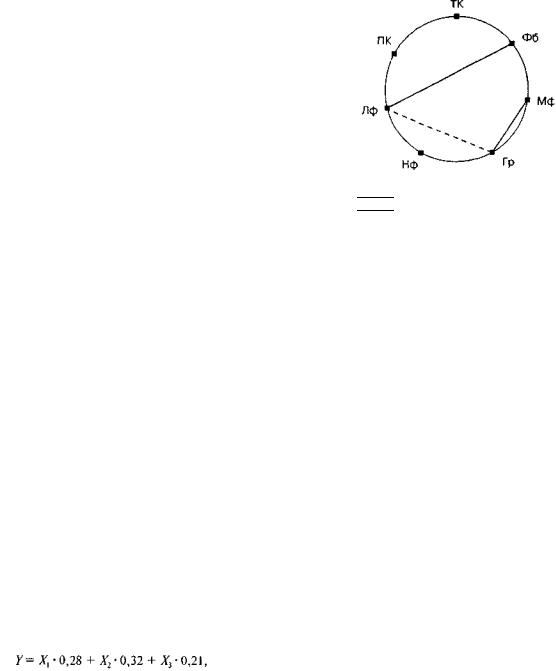
Степень статистического веса отдельных клеток в составе инфильтрата миокарда, определяемая как отношение количества клеток инфильтрата к числу ядер кардиомиоцитов, попавших на тестовую сис тему, найдена путем регрессионного анализа:
где Y — выраженность общей инфильтрации мио карда; Х1, — содержание нейтрофилов; Х2 — содер жание лимфоцитов; Хъ — содержание макрофагов.
Регрессионная модель (п = 16) обладает высо кой информационной способностью (R2 = 0,99) и является значимой (р < 0,05). Из нее следует, что наибольшим статистическим весом обладают лим фоциты (91%), гораздо в меньшей степени — мак рофаги (7%), минимальным — нейтрофилы (2%). Это свидетельствует о преимущественно лимфоци- тарно-макрофагальном характере инфильтрата.
У большинства умерших в составе инфильтрата мы находили так называемые брюшнотифозные клетки. Это крупные макрофаги с большим округ лым светлым ядром, смещенным к периферии, и обильной пенистой слегка эозинофильной цито плазмой. Брюшнотифозные гранулемы обнаруже ны у 4 умерших. Они представляли собой очаговые скопления брюшнотифозных клеток, среди кото рых в небольшом числе встречались лимфоциты
прямая корреляционная связь обратная корреляционная связь
Рис. 2. Корреляционные связи между клетками воспали тельного инфильтрата в миокарде (объяснение в тексте).
Гр — брюшнотифозные гранулемы, Лф — лимфоциты, Мф — макрофаги, ПК — плазматические клетки, Нф — нейтрофилы, ТК — тучные клетки, Фб — фибробласты.
(рис. 1, г, на вклейке). Такие гранулемы являются субстратом иммунной реакции, протекающей с яв лениями гиперчувствительности замедленного ти па, которой принадлежит важная роль в процессах выздоровления при БТ [14].
В ходе анализа клеточного инфильтрата четко прослеживались корреляционные связи между макрофагами и гранулемами (г = 0,45, р < 0,05), лимфоцитами и гранулемами (г = -0,65, р < 0,05), лимфоцитами и фибробластами (г =0,55, р < 0,05), что укладывается в современную концеп цию мононуклеарного гранулематозного воспале ния [7] (рис. 2).
Кроме миокарда, воспалительные изменения выявлялись и в других оболочках сердца. В эпикар де клеточный инфильтрат обнаружен у 12 умерших. В его составе также присутствовали брюшнотифоз ные клетки, в ряде случаев с формированием гра нулем. В пристеночном эндокарде очаговая лимфоцитарная инфильтрация обнаружена у 3 умер ших.
Изменения кардиомиоцитов включали практи чески все известные типы их повреждения, выяв ляемые при поляризационной микроскопии. Сег ментарные контрактуры определялись по усиле нию анизотропии и разной степени сближения анизотропных дисков миофибрилл. Расстояния между дисками сохранялись близкими к норме (контрактуры I степени), укорачивались (контрак туры II степени), исчезали с превращением мио фибрилл в сплошной анизотропный конгломерат (контрактуры III степени). Внутриклеточный миоцитолизис проявлялся зонами исчезновения ани зотропии на отдельных участках мышечных клеток. При глыбчатом распаде миофибрилл глыбки ани зотропной субстанции хаотично чередовались с ли шенными анизотропных структур участками. До минирующим был контрактурный тип поврежде ния (рис. 1, д, на вклейке). Обнаруживались также фрагментация миоцитов, отложение в саркоплазме зерен липофусцина, очаги атрофии и гипертрофии мышечных волокон.
Коагуляционный некроз выявлен у 14 умерших. Зоны некроза, как правило, захватывали парал лельно лежащие мышечные волокна и хорошо оп ределялись при окраске ГОФПК. Кардиомиоциты
39
теряли фибриллярную структуру и представляли собой гомогенные яркие оранжево-красные участ ки (рис. 1, е, на вклейке). Ядра мышечных клеток отличались измененными формой и размерами, извитостью контуров, деформацией, обеднением хроматином или неравномерным его распределе нием, наблюдался кариопикноз. Повреждения кардиомиоцитов носили множественный мелкоочаго вый характер, редко захватывали большие участки. Свойственной была их мозаичность, когда в одном препарате выявлялись клетки на разных стадиях патологических изменений.
Пошаговый многофакторный регрессионный анализ (л = 16, R2 = 0,96, р < 0,05) показал, что по вреждения миофибрилл в наибольшей степени ста тистически связаны с выраженностью васкулита (99%), а также стромального отека (1%). Следова тельно, изменения кардиомиоцитов в значитель ной мере определялись метаболическими наруше ниями, обусловленными тканевой гипоксией вследствие поражения сосудов и отека миокарда, который был выявлен у 13 умерших. Он носил как приваскулярный, так и интерстициальный харак тер. В течение болезни отек имел тенденцию к на растанию.
Исходом миокардита при БТ является склероз межмышечной и периваскулярной стромы, а также стенок сосудов [8]. В наших наблюдениях слабо выраженные склеротические изменения стромы обнаружены в 2 случаях. Эти больные умерли на 22-е и 23-е сутки заболевания.
Согласно современным представлениям, основ ными гистологическими признаками острого ин фекционного миокардита являются лимфоцитарные инфильтраты и некрозы миоцитов, а для персистирующего течения — очаги фиброза [9, 17]. Острый миокардит может быть диагностирован при наличии в среднем в 20 полях зрения более 5 лимфоцитов при увеличении микроскопа в 400 раз при просмотре нескольких образцов из различных отделов желудочков сердца [10]. В исследованном нами материале среднее количество лимфоцитов составило 11,6 ± 1,3, в отдельных случаях этот по казатель колебался от 5,7 до 20,4 клетки. Таким об разом, учитывая, что некрозы кардиомиоцитов об наружены у 14 умерших, об очаговом интерстициальном (экссудативно-пролиферативном) миокар дите можно говорить во всех этих случаях. Исклю чение составили 2 наблюдения, когда смерть насту пила на 4-е и 6-е сутки заболевания, в связи с чем, вероятно, миокардит не успел развиться.
З а к л ю ч е н и е
При брюшном тифе у военнослужащих совет ских войск в Афганистане в случаях летальных ис ходов, наступивших на 2-й неделе и позже, зако номерно развивался инфекционный миокардит, неотъемлемыми чертами которого явились воспа лительные изменения интрамуральных сосудов, микроциркуляторные нарушения, отек и преиму щественно лимфоцитарно-макрофагальная ин фильтрация стромы, в части случаев с формирова нием гранулем, дистрофические и некротические изменения кардиомиоцитов. В морфогенезе изме
нений в миокарде ведущее значение имел васкулит. По нашему мнению, его следует рассматривать как местное проявление генерализованной брюшноти фозной васкулопатии, связанной с миграцией воз будителя за пределы сосудистого русла, воздейст вием эндотоксина, иммунных комплексов. Кроме миокарда, воспалительный процесс в сердце часто захватывал эпикард и нередко пристеночный эндо кард, что позволяет говорить в этих случаях о панкардите.
ЛИТЕРАТУРА
1.Анисимова В. А. // Сов. мед. — 1960. — № 6. —
С.39-45.
2.Бунин К. В. II Научные труды I Моск. мед. ин-та. — 1967. - Т. 53. - С. 295-305.
3.Вогралик Г. Ф. Заболевания тифо-паратифозной группы. — Томск, 1938.
4.Гапочко К. Г. // Тер. арх. - 1958. - Т. 30, № 9. -
С.73-83.
5.Кожокарь В. И. Концепция интенсивной терапии тяжелой инфекционной патологии в экстремальных условиях: Дис. ... д-ра мед. наук. — Кишинев, 1996.
6.Лобзин Ю. В., Волжанин В. М., Коваленко А. Н. // Воен.-мед. журн. - 2001. — № 12. — С. 41—48.
7.Маянский Д. Н. Хроническое воспаление. — М., 1991.
8.Палеев Н. Р., Одинокова В. А., Гуревич М. А., Найштут Г. М. Миокардиты. — М., 1982.
9.Aretz Н. Т. И Hum. Pathol. - 1987. - Vol. 18, N 6.
-P. 619-624.
10.Edwards W. D., Holmes D. R., Reeder G S. // Mayo Clin. Proc. - 1982. - Vol. 57, N 7-8. - P. 419-425.
11.Gendron Y, Thevenieau D., Touze J.-E. 11 Med. Trop.
-1981. - Vol. 11, N 6. - P. 625-631.
12.Hewage U. C, Kamaladasa A. I., Amarasinghe A. K., Amarasekera N. I I Ceylon Med. J. — 1994. — Vol. 39, N 3. - P. 43-44.
13.Khosla S. N. // J. Trop. Med. Hyg. - 1981. - Vol. 84.
-P . 125-131.
14.Moudgil K. D., Narang M. D., Narang S. S. // Indian J. Pediatr. - 1985. - Vol. 52, N 417. - P. 371-378.
15.Rowland H. A. K. // J. Trop. Med. Hyg. - 1961. - Vol. 64. - P. 143-152.
16.Thiruvengadam K. V., Rama Shett M., Mallick M. A. // J. Indian Med. Assoc. - 1967. - Vol. 48. - P. 115— 119.
17.Yutani C, Go S., Kamiya T. //Arch. Pathol. Lab. Med.
-1981. - Vol. 105. - P. 470-473.
Поступила в редакцию 06.06.05
PATHOMORPHOLOGY AND MORPHOGENESIS OF MYOCARDITIS IN TYPHOID FEVER
A.NBobin', Yu.G.Parkhomenko2
'Central Military Clinical Hospital of the Military Air Force, 143140, Krasnogorsk; institute of Human Morphology, 117418, Moscow
S u m m a r y — Archives specimens of the heart, autopsy protocols and disease histories of 16 soldiers and officers of Soviet army who died in Afghanistan of typhoid fever were studied. It is concluded on the basis of morphology and sta tistics that interstitial myocarditis and sometimes pancarditis develop on the 2nd week of the basic disease. Characteristic features of typhoid fever myocarditis are inflammation of the heart intramural vessels, microcirculatory disturbances, ede ma and lymphocytic-macrophogeal infiltration of the stroma, sometimes with formation of granulomas, dystrophic and necrotic changes of cardiomyocytes.
Ark. Pathol., 2005, N. 3, P. 38-40.
40
