
arkhiv patologii_3_2005
.pdfзультаты, полученные в Институте молекулярной медицины Калифорнийского университета (США), согласно которым существуют линии мышей с на следственным дефектом гена KChIP2 (Kv ChannelInteracting Protein 2), экспрессируемого в норме в кардиомиоцитах. Мыши с дефектом этого гена предрасположены к развитию фатальных аритмий сердца с исходом в фибрилляцию желудочков, т. е. представляют собой природную модель ВСС [9]. Актуальной остается задача выявления лиц из групп риска ВСС. Есть основания считать, что од ним из факторов, благоприятствующих внезапной смерти у больных ИБС, может быть развитие без болевых форм ишемии миокарда (silent ischemia), при которых не предпринимаются необходимые лечебные и профилактические мероприятия. Рас крытие механизмов безболевой ишемии, в частно сти нарушения нервной афферентации, немало важно для предотвращения ВСС.
Проблема ВСС носит комплексный характер в силу нозологической гетерогенности этой патоло гии, ее многоаспектности, и разработка этой про блемы требует междисциплинарного подхода с объединением усилий специалистов разного про филя.
ЛИТЕРАТУРА
1.Внезапная сердечная смерть / Под ред. А. М. Вихерта, Б. Лауна. — М., 1980.
2.Дощицин В. Л. Лечение аритмий сердца. — М., 1993.
3.Кактурский Л. В. // Арх. пат. — 1985. — Вып. 1. — С. 86-91.
4.Кактурский Л. В. Внезапная сердечная смерть (кли ническая морфология). — М., 2000.
5.Aufderheide Т. Р. // Emerg. Med. Clin. N. Am. - 1998. - Vol. 16, N 3. - P. 583-600.
6.Brugada P., Brugada J. // J. Am. Coll. Cardiol. - 1992.
-Vol. 20, N 6. - P. 1391-1396.
7.Jackman W. M., Friday K. J., Anderson J. L. et al. // Progr. Cardiovasc. Dis. - 1998. - Vol. 31. - P. 115172.
8.Karppanen H., Pennanen R., Passinen L. //Adv. Cardiol.
-1978. - Vol. 25. - P. 9-24.
9.Km H., Cheng C, Chien K. et al. // Cell. — 2001. — Vol. 107, N 6. - P. 801-813.
10.Lown B. //Am. J. Cardiol. - 1979. - Vol. 43, N 2. - P. 313-328.
11.Luoma H., Aromaa A., Helminen S. et al. // Acta Med. Scand. - 1983. - Vol. 213, N 3. - P. 171-176.
12.Punsar S., Carvonen M. J. // Adv. Cardiol. - 1978. - Vol. 25. - P. 25-26.
Поступила в редакцию 24.01.05
SUDDEN CARDIAC DEATH: STATE OF THE ART
L. V.Kaktursky
State Research Institute of Human Morphology, 117418, Moscow
Summary — Sudden cardiac death (SCD) is an integral term for several heart diseases among which SCD caused by ischemic heart disease (IHD) designated as sudden coronary death (SCD) ranks first. SCD associated with alcoholic car diomyopathy ranks second. Risk factors and pathologic man ifestations of SCD correspond to those of IHD, atheroscle rosis, myocardial infarction. Cardiac arrest takes place be cause of fibrillation of ventricular myocardium. Factor induc ing fibrillation is an advanced irreversable myocardial ischemia complicated with reperfusion. The latter promotes elimination of arrythmogenic substances from the ishemic zone leading to electric unstability of the myocardium and fa tal arrythmia. Possibility of idiopathic ventricular fibrillation and its mechanisms is discussed.
Ark. Pathol., 2005, N. 3, P. 8-11.
Оригинальные исследования
© КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 616.62-006.6-008.9-092.18-078.33
Ключевые слова: уротелиальная карцинома, молекулы адгезии, коллаген, ламинин, тенасцин.
Г. А. Франк, Л. Э. Завалишина, Ю. Ю. Андреева
СОСТОЯНИЕ ВНЕКЛЕТОЧНОГО МАТРИКСА И МАРКЕРЫ АДГЕЗИИ В УРОТЕЛИАЛЬНОМ РАКЕ МОЧЕВОГО ПУЗЫРЯ
Московский научно-исследовательский онкологический институт им. П. А. Герцена, 125248, Москва
В классификации ВОЗ 1999 г. переходно-кле- |
сификация настоятельно рекомендует относить к |
точный (уротелиальный) рак мочевого пузыря оп |
карциноме in situ лишь плоские поражения и не |
ределяется как любая злокачественная эпителиаль |
включать в это понятие папиллярный поверхност |
ная опухоль, содержащая полностью или частично |
ный рак. |
анаплазированный уротелий [13]. При постановке |
Первая степень анаплазии (G1) характеризуется |
диагноза уротелиальной карциномы оценивается |
легкой структурной и клеточной атипией, незначи |
наличие сосочковых структур, инвазивной части |
тельным нарушением ядерной полярности, разме |
опухоли и структур карциномы in situ, а также их |
ров ядер, их формы и хроматина. Вторая степень |
сочетание, кроме того, определяется градация ядер |
анаплазии (G2) является промежуточной, она от |
и стадия опухоли (глубина инвазивного роста). |
личается от первой преимущественно нарастанием |
Степень анаплазии (дифференцировки) ядер |
структурной атипии, но с относительным сохране |
оценивается в папиллярных и инфильтрирующих |
нием полярности и мономорфности ядер, что не |
карциномах, в карциноме in situ степень анаплазии |
наблюдается при третьей степени анаплазии, ред |
не определяется. Важно отметить, что данная клас- |
кими патологическими митозами. Третья степень |
11
анаплазии (G3) характеризуется выраженным кле точным полиморфизмом с отсутствием полярно сти, утратой поверхностных клеток (нарушение вызревания), выраженной вариабельностью ядер ных параметров, многочисленными патологиче скими митозами.
Степень анаплазии опухоли является важным прогностическим фактором, чем она выше, тем ху же прогноз течения заболевания, однако помимо этого существует целый ряд других факторов, оп ределяющих прогноз. Прежде всего к ним относят ся клиническая стадия заболевания, наличие сосу дистой инвазии и др. В последние годы усилия морфологов и онкологов направлены на выявление дополнительных прогностических признаков, ко торые позволяют выяснить причины различного поведения опухолей при одинаковой клинической стадии и степени дифференцировки. Как возмож ные факторы прогноза исследуются маркеры пролиферативной активности и апоптоза, регуляторные белки клеточного цикла, факторы ангиогенеза, маркеры адгезии.
Плохой прогноз заболевания связан с биологи ческой агрессивностью конкретной опухоли. По казателями этой агрессивности являются увеличе ние пролиферативной активности и способности опухолевых клеток к миграции и инвазивному рос ту, снижение апоптотической активности, неоангиогенез и др. Инвазивный рост опухоли связан с изменениями в межклеточной адгезии, усилением миграционной способности клеток, изменениями в состоянии межклеточного матрикса и протеолитических ферментов, его разрушающих, деструк цией базальных мембран [16].
Одними из основных белков, связанных с меж клеточной адгезией как нормальных, так и опухо левых клеток, являются кадгерины — кальцийзависимые гомофильные белки [15]. Кадгерины — это суперсемейство трансмембранных гликопротеинов, обеспечивающих межклеточные контакты че рез их взаимодействие с цитоскелетом. Кроме под держания целостности клеточных пластов, они участвуют в механизмах сигнальной трансдукции, регулирующих процессы пролиферации, диффе ренцировки и миграции клеток [1, 3, 14]. Цитоплазматический домен Е-кадгерина (эпителиаль ного кадгерина) связан с рядом цитоплазматических белков — у-катенином и р-катенином, кото рые, связываясь с а-катенином, обеспечивают прикрепление к актиновому цитоскелету [16, 18]. Катенины выполняют не только связующую роль между кадгеринами и цитоскелетом, но (5-катенин играет еще и ключевую роль в особом типе сиг нальной трансдукции (Wnt-опосредованной сиг нальной трансдукции) [5, 12]. Помимо участия в межклеточной адгезии, Е-кадгерин способен свя зываться и с а^-интегрином, участвуя в клеточноматриксном взаимодействии [17]. Снижение адге зивной активности кадгеринов показано для неко торых карцином [2, 6, 16]. Кроме кадгеринов и катенинов существенную роль в межклеточной и кле- точно-матриксной адгезии играют и неспецифиче ские молекулы адгезии CD44 — семейство транс мембранных адгезивных гликопротеинов, принци пиальным лигандом которых является гиалуроновая кислота [8, 9]. CD44 не только способствует миграции и метастазированию опухолевых клеток,
но и участвует в механизмах сигнальной трансдук ции внеклеточных сигналов и взаимодействует с од ним из рецепторов эпидермального фактора роста c-erbB-2 (HER-2/neu, р185), являющимся фактором плохого прогноза для некоторых опухолей [1, 11].
Важным показателем инвазивной способности клеток опухоли является состояние базальных мем бран, основными структурными элементами кото рых являются коллаген IV типа и ламинин. Разру шение коллагена IV типа и ламинина-5 металлопротеиназами облегчает миграцию эпителиальных клеток и ведет к появлению метастазов опухоли [7]. Вместе с тем усиление миграционной способности клеток связано не только с деструкцией базальных мембран и межклеточного матрикса, но и с изме нением состояния гликопротеинов межклеточного матрикса, обладающих антиадгезивными свойства ми, в том числе тенасцина [4, 10].
Поэтому, учитывая роль молекул адгезии и со стояния межклеточного матрикса в инвазивной способности опухолевых клеток, мы определили цель данной работы — изучить экспрессию Е-кад герина, (3-катенина, CD44, коллагена IV типа, ламинина и тенасцина в переходно-клеточном раке мочевого пузыря различной степени дифференци ровки.
Исследовали 39 случаев переходно-клеточного уротелиального рака мочевого пузыря, в том числе 15 случаев высокодифференцированного (G1) и по 12 случаев уме ренно-дифференцированного (G2) и низкодифференцированного (G3) рака. В группе высокодифференциро ванного рака выделяли случаи с хорошим и плохим про гнозом заболевания.
Материал фиксировали нейтральным формалином, заливали в парафин и готовили срезы толщиной 4 мкм. Для иммуногистохимического исследования использо вали моноклональные антитела к Е-кадгерину, р-кате- нину, CD44, коллагену IV типа, ламинину и тенасцину производства "Dako Cytomation" и "Pick Cell". Для вос становления антигенной активности срезы обрабатывали
вцитратном буфере в мини-автоклаве "2100 Retriever" ("Pick Cell"). В качестве детекционной системы приме няли систему "EnVision" ("Dako Cytomation"). Иммуногистохимические реакции проводили с использованием иммуногистостейнера "DakoAvtostainer" ("Dako Cytoma tion"). Результаты оценивали полуколичественным мето дом с помощью анализатора изображения "Leica Q550". Для оценки экспрессии Е-кадгерина, р-катенина и CD44 ввели следующую шкалу: 0 — отсутствие реакции, 1+ — интенсивность реакции слабая, реакция положительная
в1—20% клеток, 2+ — положительная реакция в 21—50% клеток, 3+ — положительная реакция более чем в 50% клеток.
Результаты экспрессии изучаемых молекул адге зии показали связь между выраженностью экспрес сии, локализацией реакции в клетке и степенью анаплазии опухоли. Яркая экспрессия Е-кадгерина была обнаружена в большинстве случаев высокодифференцированного рака (9 из 12). Реакция име ла вид ровной четкой линии, очерчивающей гра ницы опухолевых клеток (рис. 1, а, на вклейке). В группе умеренно-дифференцированных карцином уменьшалось количество случаев с сильной экс прессией Е-кадгерина, реакция становилась менее интенсивной и на мембранах части клеток появля лись участки, лишенные Е-кадгерина (рис. 1, б, на вклейке). В группе низкодифференцированных ра ков мы не обнаружили ни одного случая, в котором бы реакция оценивалась как 3+. Преобладали слу-
12

чаи с реакцией низкой интенсивности, присутст вующей на небольшом числе клеток опухоли, при чем у многих клеток положительная реакция на блюдалась лишь на части клеточной мембраны (см. таблицу, рис. 1, в, на вклейке).
Реакции с антителами к р-катенину и Е-кадге- рину имели сходные локализацию и основные тен денции в изменении интенсивности экспрессии: наиболее яркая реакция и подавляющее большин ство положительно окрашенных клеток наблюда лись в случаях высокодифференцированного рака (рис. 1, г, на вклейке). При снижении степени диф ференцировки отмечается уменьшение интенсив ности экспрессии р-катенина, появляется значи тельное число клеток, в которых реакция с антите лами отсутствует, а реакция во всех низкодифференцированных опухолях была оценена как 0/1+, наблюдалась лишь на мембранах отдельных клеток (рис. 1, д, на вклейке) и часто носила неравномер ный, прерывистый характер (см. таблицу). Инте ресно отметить, что в низкодифференцированных раках появлялись клетки с положительной реакци ей к р-катенину в ядрах клеток. Важно подчерк нуть, что в группе высокодифференцированных карцином были опухоли с хорошим и плохим про гнозом заболевания и в них проявились различия в состоянии молекул адгезии. Так, отмеченные в таблице случаи со снижением экспрессии и нару шением распределения на клеточной мембране мо лекул межклеточной адгезии, оцененные как 0/1+, относятся к опухолям с плохим прогнозом.
Изучение экспрессии CD44 показало более сложную взаимосвязь состояния этого гликопротеина со степенью анаплазии опухоли, так как экс прессия этой молекулы адгезии в опухолевых клет ках и в структурах внеклеточного матрикса (ВКМ) имеет разный характер. В высокодифференциро ванных карциномах отмечена выраженная экс прессия CD44 на мембранах опухолевых клеток (рис. 2, б, на вклейке) и слабая реакция в ВКМ. При снижении степени дифференцировки опухоли наблюдается уменьшение интенсивности экспрес сии CD44 в опухолевых клетках, вплоть до почти полного ее отсутствия в низкодифференцированном раке. Но при этом происходит увеличение ин тенсивности реакции в ВКМ (см. таблицу). В низ-
Выявление молекул адгезии в уротелиальных карциномах разной степени анаплазии
кодифференцированных опухолях положительная реакция с CD44 отмечается практически только в структурах ВКМ и лимфоидных элементах. Так же как и для Е-кадгерина и р-катенина, обращает на себя внимание тот факт, что в случаях высокодиф ференцированного рака с плохим прогнозом, как и в низкодифференцированных новообразованиях, происходит уменьшение экспрессии CD44 в клет ках опухоли и ее увеличение в ВКМ (см. таблицу, рис. 2, а, на вклейке).
Результаты наших исследований состояния базальных мембран (БМ) по реакциям с антителами к коллагену IV типа и ламинину показали, что в группе высокодифференцированного рака отмеча ется хорошее состояние БМ, окружающих опухо левые комплексы. Наблюдается ярко выраженная положительная реакция и с коллагеном, и с ламинином. БМ окружают опухолевые комплексы без разрывов и имеют ровную плотную структуру (рис. 2, д, на вклейке). В группе умеренно-дифференци рованного рака появляются комплексы клеток, у которых БМ частично разрушена, имеет неровную толщину и экспрессия коллагена и ламинина имеет разную интенсивность. В низкодифференцирован ных карциномах практически все БМ опухолевых комплексов разрушены (рис. 1, е, 2, е, на вклейке).
Поскольку миграция опухолевых клеток связана и с антиадгезивными свойствами ряда белков ВКМ, то показательным является количество и распределение в ВКМ гликопротеина тенасцина. В высокодифференцированных и умеренно-диффе ренцированных карциномах количество тенасцина в ВКМ невелико, однако в части умеренно-диффе ренцированных опухолей отмечена ярко выражен ная положительная реакция с антителами к тенасцину в цитоплазме большинства клеток опухоли при еще слабой реакции в структурах ВКМ (рис. 2, г, на вклейке). В низкодифференцированных раках отмечено увеличение количества тенасцина в ВКМ: наблюдаются большие "поля" с реакцией вы сокой интенсивности (рис. 2, в, на вклейке).
Полученные нами результаты подтверждают высказанную в ряде источников гипотезу о том, что нарушение состояния молекул адгезии существен но связано с приобретением опухолевыми клетка ми способности отделяться от первичной опухоле вой структуры, мигрировать и проникать в окру жающие ткани с образованием метастатических очагов [2, 6, 16]. Обнаруживается прямая связь на рушения адгезивных свойств клеток со степенью дифференцировки опухоли. На эту связь указывает и появление положительной реакции с р-катени- ном в ядрах опухолевых клеток низкодифференцированного рака, что может приводить к изменению транскрипционной активности ряда генов путем изменения функционирования некоторых факто ров транскрипции (LEF/TCF-зависимой транс крипции генов) [1, 12].
Отмеченные различия экспрессии CD44 в опу холевых клетках и структурах ВКМ могут отражать наличие и активность многочисленных изоформ CD44, которые образуются в результате альтерна тивного сплайсинга (преобразования первичного РНК-транскрипта в зрелую мРНК) и играют раз ную роль в связывании гиалуроновой кислоты. Ин тенсивность связывания CD44 с гиалуроновой ки слотой и остеопонтином ВКМ непосредственно влияет на способность клеток к миграции [1].
п
Необходимо подчеркнуть, что результаты изуче ния молекул адгезии дают основание выделить сре ди высокодифференцированных уротелиальных карцином особую группу, в которой появляются тенденции, характерные для низкодифференцированных форм и коррелирующие с плохим прогно зом данных опухолей.
Наблюдаемые изменения состояния БМ при снижении степени дифференцировки опухоли и увеличение содержания антиадгезивного компонен та ВКМ тенасцина также способствуют увеличению миграционной способности клеток и прямо корре лируют со степенью анаплазии опухоли. Эти данные также совпадают с результатами, полученными при изучении рака других локализаций [2, 6, 7].
З а к л ю ч е н и е
Таким образом, проведенное изучение состоя ния молекул адгезии, базальных мембран и внекле точного матрикса показало значимость нарушений адгезивных свойств клеток опухоли при снижении степени дифференцировки, более того, эти нару шения являются признаком биологической агрес сивности некоторых высокодифференцированных карцином. Полученные результаты позволяют ис пользовать изученные маркеры для определения индивидуального прогноза.
ЛИТЕРАТУРА
1.Пальцев М. А., Иванов А. А., Северин С. Е. Межкле точные взаимодействия. — М., 2003.
2.Чипышева Т. А., Гельштейн В. И., Ермилова В. Д.
и др. // Арх. пат. — 2003. — Т. 65, вып. 3. — С. 3—7.
3.Cavallato S., Christofori G. // Biochim. Biophys. Acta. - 2001. - Vol. 1552. - P. 39-45.
4.Chiquet-Ehrismann R., Chiquet M. // J. Pathol. — 2003. - Vol. 200, N 4. - P. 500-504.
5.Conacci-Sorell M., Zhurinsky Y, Ben-Ze ev A. //J. Clin. Invest. - 2002. - Vol. 109, N 8. - P. 987-991.
6.De Wever O., Mareel M. // J. Pathol. - 2003. - Vol. 200, N 4. - P. 429-447.
©КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 616.5-006.63-092:612.015.1.]-078.33
7.EngbringJ. A., Kieinman Н. К. // J. Pathol. - 2003. - Vol. 200, N 4. - P. 465-470.
8.Goodison S., Urquidi V., Tarin D. // J. Clin. Pathol. — 1999. -Vol. 52. - P. 189-196.
9.Imada J. Y, Uchida K., Tsunemasu K. et.al. // Pathol. Int. - 2004. - Vol. 54. - Suppl. 2. - P. A68.
10.Jones P. L., Jones F. S. // Matrix Biol. - 2000. - Vol. 19, N 7. - P. 581-596.
11.Knudson W. H Fronters. Biosci. - 1998. - Vol. 3. -
P.d604-d615.
12.Moon R. Т., Bowerman В., Boutros M., Perrimon N. 11
Science. - 2002. - Vol. 296. - P. 1644-1646.
13.Mostofl F. K., Davis С J., Sesterhenn I. A. Histological Typing of Urinary Bladder Tumors. — Berlin et al., 1999.
14.Steinberg M. S., Mc Nutt P. M. // Curr. Opin. Cell Biol.
-1999. - Vol. 11. - P. 554-560.
15.Troyanovsky S. M. // Curr. Opin. Cell Biol. - 1999. - Vol. 11. - P. 561-566.
16.Voutilaten K., Sillanpaa S., Anttila M. // Pathol. Int. — 2004. - Vol. 54. - Suppl. 2. - P. A72.
17.WhittardJ. D. et al. // Matrix Biol. - 2002. - Vol. 21,
N6. - P. 525.
18. Zhurinsky Y, Shtutman M., Ben-Ze ev A. 11 J. Cell Sci. - 2000. - Vol. 113. - P. 3127-3139.
Поступила в редакцию 26.01.05
STATUS OF EXTRACELLULAR MATRIX AND ADHE SION MARKERS IN UROTHELIAL CANCER OF THE URINARY BLADDER
G.A.Frank, L.E.Zavalishina, Yu.Yu. Andreeva
P.A.Herzen Cancer Research Institute, 125248, Moscow
Summary — 39 cases of transitory cell (15 cases of well differentiated, 12-moderately and 12poorly differentiated) urothelial bladder carcinoma were studied immunohistochemically. Expression of adhesion molecules, collagen, 1aminin and tenascsin was investigated. Their role in a decrease of a differentiation degree of urothelial carcinoma was re vealed. The possibility of the above markers use for individual prognosis is demonstrated.
Ark. Pathol., 2005, N. 3, P. 11-14.
К л ю ч е в ы е с л о в а : базально-клеточный рак кожи, метатипический рак кожи, матриксные металлопротеиназы, тканевые ингибиторы матриксных металлопротеиназ.
Е.С. Снарская1, В. А. Молочков1, Г. А. Франк2, Л. Э. Завалишина2
МАТРИКСНЫЕ МЕТАЛЛОПРОТЕИНАЗЫ И ИХ ТКАНЕВЫЕ ИНГИБИТОРЫ ПР И БАЗАЛЬНО-КЛЕТОЧНОМ И МЕТАТИПИЧЕСКОМ РАКЕ КОЖИ
'Кафедра кожных и венерических болезней (зав. — проф. В. А.' Молочков) факультета повышения последипломного образования ММА им. И. М. Сеченова, 119881, Москва; Отделение патологической анатомии (зав. — член-корр. РАМН, проф. Г. А. Франк) МНИОИ им. П. А. Герцена, 125248, Москва
Матриксные металлопротеиназы (ММР) — се |
люции молочных желез, эндометрия матки, тканей |
мейство цинкзависимых эндопептидаз, включаю |
простаты [4]. |
щее 26 энзимов, секретируемых клетками, регули |
Однако ММР могут играть важную роль в ряде |
руемых на уровне генной экспрессии и секреции |
патологических процессов, способствуя тканевой |
эндогенных тканевых ингибиторов (TIMP) [4, 14]. |
деструкции [11]. Отмечено, в частности, что опухо |
ММР ответственны за большинство изменений |
левые клетки могут секретировать ММР и TIMP 1, |
экстрацеллюлярных матриксных компонентов тка |
2, 3, 4 [7] при гематологических заболеваниях, |
ней и являются по характеру воздействия коллаге- |
ММР 2 и 9 при раке простаты, ММР 1, 3, 9 и 11 |
назами, желатиназами или стромелизином [11]. |
при бронхопульмональном раке [13], ММР 13 при |
Активизация ММР наблюдается в процессе рос |
раке головы и шеи [8] и плоскоклеточном раке |
та тканей, заживления ран, репродукции и инво- |
(ПКР) кожи [2], ММР 9 при раке прямой кишки. |
14
Предполагают, что дисбаланс ММР и TIMP в сторону активации ММР при опухолях увеличива ет способность опухолевых клеток к пролифера ции, инвазии и метастазированию, чему способст вует также активация ангиогенеза, обусловленная действием ряда ММР [4, 11].
В настоящее время получены данные о влиянии экстрацеллюлярных металлопротеиназ на состоя ние базальной мембраны эпидермиса, рост и раз витие эпителиальных клеток, фибробластический (FGF) и трансформирующий (TGFp) ростовые факторы [11]. Так, ММР 2 и 9 активируют превра щение латентной формы TGFp в активную [17], ММР 1 и 3 способствуют реализации FGF через воздействие на протеогликаны [19]. Инсулиноподобный фактор роста, связывающий протеины (IGF-BP), протеолизируется под воздействием ММР, генерируя активный IGF-лиганд [6], стиму лирующий опухолевый рост через блокирование TIMP-1 [10]. ММР 2, 3 и 9 воздействуют на протеолитические процессы, способствующие превра щению интерлейкина-ip (IL-ip) в активную форму
[15].ММР-9 вызывает депрессию IL-2-зависимой пролиферации Т-лимфоцитов, повреждая IL-2a- рецепторы на Т-лимфоцитах, обеспечивая иммуносупрессию, способствующую канцерогенезу
[16].Fas-лиганд идентифицирован как ММР-суб- страт [9]. ММР влияют на процесс клеточной ми грации. Так, ММР 3 и 7 нарушают клеточную ад гезию через воздействие на Е-кадгерин, стимули руя клеточную миграцию и инвазию через коллагеновый гель, а ММР-9 стимулирует ангиогенез в процессе канцерогенеза через воздействие на сосу дистый эндотелиальный ростовой фактор (VEGF), способствуя инвазии и миграции опухолевых кле ток [5].
Изучению ММР при эпителиальных злокачест венных опухолях кожи — базально-клеточном раке (БКР) и ПКР — посвящены единичные работы [1, 12, 18, 20], среди них работ отечественных авторов нам не встретилось. Авторы отметили увеличение экспрессии ММР в агрессивных БКР и ПКР кожи.
Присутствие стромелизина-3, относящегося к ММР, в строме ПКР отмечено в 70% случаев ме тастатических опухолей, в доброкачественных опу холях кожи он не выявлялся [3].
Работы по изучению ММР и их тканевых инги биторов при метатипическом раке (МТР) отсутст вуют.
Целью настоящего исследования явилось изуче ние активности ММР и их эндогенных тканевых ингибиторов при наиболее распространенном и упорно протекающем варианте базалиомы — яз- венно-нодулярном БКР и ее атипичной самостоя тельной форме — МТР, отличающемся наличием, помимо базалоидного пула клеток, характерного для БКР, пулом клеток с плоскоклеточной дифференцировкой, характерной для ПКР.
Для выявления экспрессии ММР и TIMP в опухолях кожи (язвенно-нодулярном БКР и МТР) использовали парафиновые срезы опухолей толщиной 5 мкм, нанесен ные на предметные сиалинизированные стекла ("Dako") и инкубированные с моноклональными антителами ("Novocastra") к ММР-1 1:10, ММР-9 1:40, TIMP-1 1:10, TIMP-2 1:25. Для визуализации применяли систему де текции "Envision" ("Dako"). В качестве хромогена исполь зовали диаминобензидин. Для восстановления антиген ной активности срезы обрабатывали в специализирован
ном миниавтоклаве "Retrivale-2100" при температуре 12 ГС в течение 20 мин с последующим охлаждением в течение 2 ч. Время инкубации с антителами составляло 60 мин при комнатной температуре. После проведения реакции срезы докрашивали гематоксилином. Положи тельная реакция на ММР и TIMP проявлялась в виде ко ричневого окрашивания цитоплазмы опухолевых клеток различной интенсивности.
Определение экспрессии пролиферирующего ядер ного антигена (PCNA), р53 проводили с использованием антител к р53 ("Dako"), PCNA ("Zymed"). На предвари тельном этапе антигенные сайты демаскировали путем нагревания срезов в СВЧ-печи. Использовали общепри нятую пероксидазную иммуногистохимическую методи ку [визуализация иммунного окрашивания стрептави- дин-биотин-авидиновым методом с использованием на бора LSAB ("Dako")]. Для фонового докрашивания ис пользовали гематоксилин.
Во всех срезах язвенно-нодулярных БКР отме чалась выраженная экспрессия ММР-1 (рис. 1, на вклейке) и ММР-9 (рис. 2, на вклейке), характери зующаяся интенсивно коричневым окрашиванием диффузного характера цитоплазмы практически всех клеток эпителиальных опухолевых тяжей, что свидетельствует об интенсивной секреции опухо левыми базалоидными клетками ММР 1 и 9.
При МТР во всех срезах также отмечалась вы раженная экспрессия ММР-1 (рис. 3, на вклейке)
иММР-9 (рис. 4, на вклейке), характеризующаяся интенсивно-коричневым окрашиванием диффуз ного характера цитоплазмы практически всех кле ток эпителиальных опухолевых тяжей. Однако по мимо этого экспрессия указанных ММР отмеча лась и в строме опухолевого комплекса в виде от дельных рассеянных мелких участков при положи тельной экспрессии цитокератинов в этих клетках, что свидетельствовало о проникновении клеток опухоли в окружающий стромальный каркас с вы соким уровнем содержания ММР 1 и 9.
При изучении результатов иммуногистохимических исследований на TIMP 1 и 2 была выявлена достаточно интенсивная экспрессия ингибиторов ММР в цитоплазме практически всех опухолевых клеток эпителиальных тяжей при БКР, проявив шаяся в виде диффузного коричневого окрашива ния их цитоплазмы на TIMP-1 (рис. 5, на вклейке)
иTIMP-2 (рис. 6, на вклейке), что может свиде тельствовать о сохранении процесса нейтрализа ции активности ММР за счет продукции их ткане вых ингибиторов.
При МТР во всех срезах отмечается резкое сни жение экспрессии TIMP-1 (рис. 10, на вклейке) и особенно TIMP-2 (рис. 8, на вклейке) — практиче ски до отрицательного результата.
Вцитоплазме опухолевых клеток окрашивание при выявлении TIMP-1 бледно-коричневое в отли чие от интенсивно-коричневого при БКР, а на TIMP-2 оно еще слабее в виде отдельных светлокоричневых точек в цитоплазме только части опу холевых клеток (~ 30%). Это может быть расценено как отрицательный результат и свидетельствует о резком снижении вплоть до отсутствия продукции тканевых ингибиторов ММР, что дает возможность усиления эффектов ММР.
При анализе полученных результатов можно от метить, что опухолевые клетки БКР, включая его атипичную форму — МТР, обладают высокой сек реторной активностью в плане выработки ММР 1
и9, экспрессия которых выражена в виде интен-
15
сивного диффузного коричневого окрашивания цитоплазмы клеток опухолевых комплексов при БКР и МТР, а также стромы опухоли при МТР за счет проникновения в нее (инвазии) отдельных опухолевых клеток. Таким образом, выраженная экспрессия ММР 1 и 9 характеризует как базалоидный пул клеток, так и клетки с плоскоклеточной дифференцировкой, характерные для МТР.
Однако при изучении характера экспрессии тка невых ингибиторов ММР выявлены некоторые различия. Если при язвенно-нодулярном БКР TIMP 1 и 2 секретируются достаточно активно, что проявляется интенсивным коричневым окрашива нием цитоплазмы опухолевых клеток, то при МРТ их активность довольно резко снижается (TIMP-1) вплоть до практически отрицательного результата (TIMP-2) в подавляющем большинстве клеток опу холевых комплексов. Высокая экспрессия ММР при ослаблении выработки TIMP ведет к их дисба лансу, что усиливает эффекты ММР в виде интен сивно выраженных опухолевой пролиферации, ин вазии, ангиогенеза, способствующих росту опухоли и метастазированию, а также иммуносупрессии че рез влияние ММР-9 на IL-2-зависимую пролифе рацию Т-лимфоцитов.
При изучении пролиферативной активности БКР и МТР с помощью маркера пролиферации PCNA получены подтверждения указанных эффек тов. Экспрессия PCNA, выявляемая в виде темнокоричневого окрашивания ядер, при БКР была об наружена только в 25—35% ядер опухолевых клеток (рис. 9, на вклейке), в то время при МТР — в 85— 90% ядер опухолевых клеток (рис. 7, на вклейке).
Параллельно при МТР отмечались интенсивное накопление в ядрах 50—70% опухолевых клеток мутантного стабильного р53, отражающего потерю его функции как супрессора малигнизации (рис. 11, на вклейке), а также участки интенсивной кон центрации высокомолекулярного цитокератина.
Вы в о д ы
1.Язвенно-нодулярный базально-клеточный рак (БКР) характеризуется выраженной экспресси ей в цитоплазме опухолевых клеток эпителиальных тяжей матриксных металлопротеиназ (ММР) 1 и 9 при сохранении секреции ингибиторов ММР — TIMP-1 иТ1МР-2.
2.При метатипическом раке (МТР) экспрессия ММР-1 и ММР-9 выражена не только в цитоплаз ме опухолевых клеток эпителиальных тяжей, но и
встроме опухоли за счет инвазии отдельных опу холевых клеток. Отмечен дисбаланс ММР с эндо генными тканевыми ингибиторами TIMP-1 и TIMP-2, экспрессия которых в опухолевых клетках резко снижена или отсутствует.
3.Дисбаланс ММР и TIMP при МТР обеспечи вает большую, чем при БКР, пролиферативную ак тивность и инвазивность опухолевых клеток, о чем свидетельствуют экспрессия PCNA в 85—90% опу
холевых клетках при МТР против 25—35% при яз венно-нодулярном БКР, а также интенсивная экс прессия р53 в 50—70% опухолевых клеток и высо комолекулярного цитокератина.
ЛИТЕРАТУРА
1.Стрекая Е. С, Молочное В. А. Базалиома. — М., 2003.
2.Airola К., Johansson N., Kariniemi A. L. et al. // J. In vest. Dermatol. - 1997. - Vol. 109. - P. 225-231.
3.Asch P. H., Basset P., Roos M. et al. // J. Dermatol. — 1999. - Vol. 21, N 2. - P. 146-150.
4.Bauer K. S., Rudek M. A., Lush R. M., Figg W. D. // Highlights Oncol. Pract. - 1998. - Vol. 16, N 1. - P. 3-11.
5.Berges G, Brekken R. et al. // Nat. Cell Biol. - 2000.
-Vol. 2. - P. 737-744.
6.Fowlkes J. L., Suruki K. et al. // Endocrinology. — 1994. -Vol. 135. - P. 2810-2813.
7.Guedez L., Urn M. S. et al. // Crit. Rev. Oncog. - 1996.
-N 7. - P. 205-225.
8.Jahansson N., Airola K., Grenman R. et al. // Am. J. Pathol. - Vol. 151. - P. 499-508.
9.Kayagaki N.. Kawasaki A. et al. // J. Exp. Med. - 1995.
-Vol. 182. - P. 1777-1783.
10.Martin D. C, Fowlkes J. L. et al. // J. Cell Biol. - 1999.
-Vol. 146. - P. 881-892.
11.McCawley L. J., Matrisian L. M. // Curr. Opin. Cell Bi ol. - 2001. - Vol. 12. - P. 534-546.
12.Muller D., Wolf C, Abecassis J. et al. // Cancer Res. — 1993. - Vol. 53. - P. 165-169.
13.Naweocki В., Polette M., Marchand V. et al. // Int. J. Cancer. - 1997. - Vol. 72. - P. 556-564.
14.Preston A. H Oncogene. - 2002. - Vol. 2. - P. 1-2.
15.Schonbeck V., Mach F., LibbyP. //J. Immunol. - 1998.
-Vol. 161. - P. 3340-3346.
16.Sheu B. C, Hsu S. M. et al. // Cancer. Res. - 2001. - Vol. 61. - P. 237-242.
17.Stamenkovic Y. O. // Genes Dev. - 2000. - Vol. 14.
-P. 163-176.
18.Under А. В., Sandstedt В., Bruce K. et al. // J. Invest. Dermatol. - 1996. - Vol. 107. - P. 147-153.
19.Whitelock J. M., Murdoch A. L. et al. // J. Biol. Chem.
-1996. - Vol. 271. - P. 10079-10086.
20.WolfG, ChenarM. P., Durand de Grossoure P. et al. // J. Invest. Dermatol. - 1992. - Vol. 99. - P. 870-872.
Поступила в редакцию 24.06.04
MATRIX METALLOPROTEINASES AND THEIR TIS SUE INHIBITORS IN BASAL CELL AND METATYPICAL CANCER OF THE SKIN
E.S.Snarskaya', V.A.Molochkov', G.A.Frank2, L.E. Zavalishina2
'I.M.Sechenov Moscow Medical Academy, 119881, Moscow; 2 P.A. Herzen Moscow Research Cancer Institute , 125248, Moscow
Summary — 10 cases of ulcerative-nodular basal cell car cinoma and 10 cases of metatypical carcinoma of the skin were studied immunohistochemically for immunoexpression of matrix metalloproteinases (MMP-1, MMP-9) and their endogenic tissue inhibitors (TIMP-1, TIMP-2) in combina tion with PCNA, p53 tumor complexes. Some differences are found in these types of tumors.
Ark. Pathol., 2005, N. 3, P. 14-16.
16
в КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 616.33-002.2-085.33J-076.5
К л ю ч е в ы е с л о в а : клеточное обновление, хронический гастрит.
А. В. Кононов1, С. И. Мозговой', М. А. Ливзан1, И. К. Предвечная2, Л. Д. Новикова2
М О Р Ф О Л О Г ИЯ ПОВЕРХНОСТНОГО И АТРОФИЧЕСКОГО ХРОНИЧЕСКОГО ГАСТРИТА П Р И ЭРАДИКАЦИИ HELICOBACTER PYLORI
'Кафедра патологической анатомии с курсом клинической патологии (зав. — проф. А. В. Кононов) Омской государственной медицинской академии, 644099, Омск; 2Омский диагностический центр, 644024, Омск
Процесс клеточного обновления слизистой обо лочки желудка включает пролиферацию эпители альных клеток в зоне перешейка желез, их дифференцировку и миграцию по направлению к просве ту и дну желез. Helicobacter pylori (HP) индуцирует апоптоз клеток железистого эпителия желудка и приводит к компенсаторному повышению пролиферативной активности в герминативных зонах слизистой оболочки [11]. Особенности клеточного обновления слизистой оболочки желудка главным образом рассматриваются либо при неизмененной слизистой оболочке желудка, либо при язвенном поражении [9], и основная масса работ, посвящен ных процессам апоптоза эпителия желудка, касает ся изучения механизмов НР-индуцированного апоптоза вне связи с основными морфологически ми типами гастрита — поверхностным и атрофическим. В настоящее время вопрос об обратимости атрофии слизистой оболочки желудка, в том числе и после эрадикации бактерии HP, остается откры тым [8].
Цель работы заключалась в установлении пара метров клеточного обновления и атрофии слизи стой оболочки желудка, а также механизмов персистенции мононуклеарного воспалительного ин фильтрата при основных морфологических типах HP-ассоциированного хронического гастрита (по верхностном и атрофическом) в условиях проведе ния эрадикационной терапии.
Материалом для изучения клеточного обновления слизистой оболочки желудка в зависимости от инфици рования HP послужили 328 гастробиоптатов, получен ных при фиброгастроскопии от 82 больных хроническим гастритом (из зоны малой кривизны + тела и антрального отдела желудка от каждого больного). Больным была проведена стандартная 7-дневная эрадикационная тера пия первой линии (омепразол 20 мг 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки в течение 7 дней).
Исследование соответствовало критериям когортного проспективного контролируемого. После гистологиче ской верификации состояния слизистой оболочки и на личия или отсутствия HP у пациентов они были подраз делены на 2 группы: исследуемая [70 НР-позитивных лиц, из которых 42 имели поверхностный гастрит (35 мужчин и 7 женщин), 28 — гастрит с атрофией желез раз личной степени (24 мужчины и 3 женщины] и группа сравнения [12 HP-негативных лиц с наличием поверхно стного гастрита (10 мужчин и 2 женщины)]. Контроль эрадикации проводили спустя 4 нед после окончания те рапии с взятием гастробиоптатов по аналогичной схеме.
Фрагменты слизистой оболочки фиксировали в 10% нейтральном забуференном формалине (рН 7,2—7,4) в течение 12—24 ч, заливали в парафин по общепринятой методике. Парафиновые срезы толщиной 5—7 мкм ок рашивали гематоксилином и эозином. Для оценки мор фологических изменений слизистой оболочки желудка использовали визуально-аналоговую шкалу на основе
Сиднейской системы [4]. Для гистобактериоскопической идентификации HP-инфекции использовали метод Гимзы. Иммуногистохимическое исследование выпол няли на парафиновых срезах с применением стрептави- дин-биотинового метода ("Dako", Дания, LSAB2 Systems, HRP). Демаскировку антигена проводили в цитратном буфере (рН 6,0) в бытовой СВЧ-печи "Samsung-M1774R". В качестве первичных антител использовали мышиные моноклональные антитела: Ki-67, клон MIB-1, готовые к использованию ("Dako", Дания); Вс1-2, клон 124, гото вые к использованию ("Dako", Дания); СРР-32 (каспаза- 3), клон JHM62, разведение 1:25 ("Novocastra", Велико британия); р53, клон DO-7, готовые к использованию ("Dako", Дания). В препаратах при 400-кратном увеличе нии микроскопа определяли индекс пролиферации — ИП (ядерная метка Ki-67) как процент положительно ок рашенных ядер эпителиоцитов слизистой оболочки же лудка в пределах пролиферативного компартмента (верх няя треть желез, регион перешейка и покровно-ямочный эпителий, где обнаруживается метка при расширении зо ны пролиферации) в 5 случайно выбранных полях зре ния (> 500 клеток). Индекс апоптоза — ИА (перинуклеарная или цитоплазматическая метка СРР-32 — caspase- 3) определяли как процент положительно окрашенных эпителиоцитов в 10 случайно выбранных полях зрения (> 1000 клеток), поскольку "зона апоптоза" в слизистой оболочке желудка расположена более вариабельно, чем зона пролиферации. Аналогичным образом, что и ИА, определяли индекс метки Bel-2 — супрессора апоптоза. Выявление экспрессии данных белков в мононуклеарных клетках собственной пластинки слизистой оболочки желудка (воспалительный инфильтрат) проводили при определении процента положительно окрашенных кле ток (с ядерной и цитоплазматической метками в зависи мости от использованного маркера) в 10 случайно вы бранных полях зрения (> 1000 клеток). Просмотр и фо тографирование микропрепаратов осуществляли на мик роскопе "Nikon Eclipse 400" фирмы "Nikon". Поскольку распределение не соответствовало критериям нормаль ного, для характеристики выборок использовали пред ставление данных в виде М + s, где М — значение сред ней арифметической, 5 — стандартное отклонение (сред нее квадратическое отклонение), тогда как для расчета достоверности различий применяли непараметрические критерии. За статистически достоверную разницу при нимали значение/? < 0,05. Также между различными па раметрами одной выборки рассчитывали коэффициент корреляции рангов Спирмена (р) и критерий его досто верности.
Висследовании была продемонстрирована пря мая корреляционная зависимость между активно стью и степенью воспаления и уровнем НР-коло- низации (р = 0,78 и р = 0,53 при/? < 0,01 для груп пы поверхностного гастрита и р = 0,65 при/? < 0,01
ир = 0,36 при р < 0,05 для группы атрофического гастрита).
Вначале исследования были выявлены измене ния гистоархитектоники слизистой оболочки — появление высоких валиков, извитых расширен ных ямок и регенераторного эпителия. В группе

биоптатов, где был верифицирован атрофический гастрит, происходило истончение слизистой обо лочки с уменьшением объемной плотности желез. Большая плотность воспалительного инфильтрата соответствовала участкам более выраженной инво люции желез. Уровень HP-колонизации имел об ратную корреляцию (р = -0,55) со степенью атро фии, что, вероятно, является следствием утраты первичного биотопа микроорганизма — в условиях дефицита слизеобразования снижается плотность популяции микроба.
Морфологические признаки хронического гаст рита, полуколичественно оцененные по Сидней ской системе (от 0 — отсутствие до 3 — выраженное проявление признака) у лиц с атрофическим и по верхностным гастритом до и после эрадикации HP, отражены в таблице.
В группе поверхностного гастрита успешная эрадикация приводила к снижению на 41% плот ности мононуклеарного инфильтрата, тогда как в группе лиц с атрофическим гастритом терапия приводила к 25% снижению того же показателя. Активность и степень воспаления после успешной НР-эрадикации достоверно снижались в обеих ис следованных группах (р < 0,05). Атрофические из менения обратному развитию не подвергались (Р > 0,05).
В группе HP-ассоциированного хронического атрофического гастрита после успешного курса эрадикационной терапии обнаружено замедленное по сравнению с группой поверхностного гастрита снижение плотности мононуклеарной воспали тельной инфильтрации собственной пластинки слизистой оболочки, а также отсутствие обратного развития атрофических изменений. Указанная за висимость была характерна для антрального отдела желудка вследствие преобладающей HP-колониза ции именно этого отдела.
HP прямым и опосредованным через воспали тельный инфильтрат воздействием на клетки желе зистого эпителия желудка инициирует их апоптоз. Ответной реакцией слизистой оболочки является усиление пролиферативной активности, причем процессы эти при поверхностном гастрите относи тельно уравновешены, в то время как при атрофическом гастрите апоптоз преобладает.
Значения ИП и ИА в эпителии слизистой обо лочки антрального отдела желудка у лиц с поверх ностным и атрофическим гастритом до и после эрадикационной терапии представлены на рис. 1.
При сравнительном анализе ИА и ИП в иссле дованных группах и в HP-негативной группе срав нения (ИП 15,4 ± 4,2; ИА 12,3 ± 3,5) до эрадика ции отмечалось значительное усиление апоптоза и
П р и м е ч а н и е . В числителе —до эрадикации, в знамена теле — после эрадикации; * — р < 0,05, ** — р > 0,05.
пролиферации (рис. 2, а—в, на вклейке) и, соответ ственно, увеличение ИА и ИП в эпителии слизи стой оболочки желудка у HP-позитивных лиц (р < 0,01), причем у лиц с атрофическими измене ниями слизистой оболочки ИА был достоверно вы ше (р < 0,001), чем у лиц с поверхностным гастри том. Выявленные закономерности особенно четко проявлялись в антральном отделе желудка вследст вие преобладающей HP-колонизации именно это го отдела. По-видимому, бактериальная колониза ция приводила к усилению процессов апоптоза, причем в условиях атрофического гастрита зона ги бели клеток не ограничивалась покровно-ямочным эпителием, а распространялась на железистый эпи телий.
Для компенсации дефицита клеток регенера торные возможности пролиферативного компартмента повышались: ИП возрастал (см. рис. 1), на блюдалось расширение генеративной зоны в верх нем и нижнем направлении. Данные феномены со ответствуют понятию об ускоренном клеточном обновлении эпителия слизистой оболочки желудка в ответ на его повреждение HP прямым или опо средованным образом и описаны в литературе [3]. Показатели ИП в обеих исследованных группах достоверно не различались, что приводило к не полной компенсации клеточного обновления, а при атрофическом гастрите к атрофии слизистой оболочки.
В условиях эрадикации инфекта происходило снижение ИА и ИП, но в обеих исследованных группах индексы были достоверно выше, чем в группе сравнения (HP-негативный гастрит). Это объясняется тем, что в отсутствие HP основным фактором, определяющим темп клеточного обнов ления слизистой оболочки желудка исследованных групп, помимо собственно бактерии становится мононуклеарный воспалительный инфильтрат соб ственной пластинки слизистой оболочки, исчезно вение которого после эрадикации инфекта проис ходит не сразу. Он осуществляет реализацию про граммы апоптоза путем индукции его через систе му FasL—FasR межэпителиальных CDS-лимфоци- тов и эпителиоцитов [10].
Интересно, что, несмотря на успешную эрадикацию, уровень апоптоза эпителиоцитов слизистой оболочки у лиц с атрофией оставался высоким и достоверно (р < 0,01) превышал аналогичный по казатель в группе поверхностного гастрита, тогда как ИП в группах с поверхностным и атрофиче ским гастритом достоверно не различался.
ИА в антральном отделе желудка у лиц с атро фией прямо коррелировал со степенью атрофии слизистой оболочки (р = 0,42), причем после ус пешной эрадикации HP связь была даже сильнее (р = 0,59). Данный результат является вполне объ яснимым и закономерным — уровень дефицита железистого эпителия определяется уровнем гибе ли слизистых клеток путем апоптоза.
Представляют интерес обнаруженные различия показателей корреляции между уровнем НР-коло- низации слизистой оболочки желудка и ИА: в груп пе поверхностного гастрита корреляционная связь определялась как прямая (р = 0,76), в группе атро фического — как обратная (р = -0,43). Уровень апоптоза напрямую связан с дефицитом желези стого эпителия — атрофией, что приводит к утрате HP своей биологической ниши и уменьшению
18

плотности колонизации. При атрофическом гастрите, являющемся эволюционным исходом поверхно стного, в связи с длительным (в те чение нескольких лет) существова нием системы патоген—хозяин при установившихся многочисленных путях взаимодействия эпителиаль ной клетки и HP основную триггерную роль в апоптозе эпителия игра ет уже не микроб, как при поверхно стном гастрите, а цитокины мононуклеарного воспалительного ин фильтрата. В нескольких работах при оценке роли воспаления как пуско вого фактора апоптоза эпителия слизистой оболочки желудка воспа ление рассматривалось как допол нительный путь реализации апопто за, помимо пути, напрямую опосре дованного бактерией [2, 3, 10].
Экспрессия белков р53 и Вс1-2 была выявлена лишь в единичных клетках слизистой оболочки желуд ка. Это указывает, что реализация программы апоптоза в слизистой оболочке желудка происходит пре
имущественно без генетически детерминированно го р53-зависимого пути запуска, на что указывают также другие исследователи [7]. Кроме того, оче видно, имеет смысл учитывать факт крайне корот кого периода полураспада дикого р53 в отличие от мутантных стабилизированных форм [13]. К тому же экспрессия Вс1-2 не является характерной для желудочного эпителия, поскольку в слизистой обо лочке обновление происходит достаточно быстро и обеспечение длительного "выживания" клеток здесь не является необходимым. Низкий уровень экспрессии Вс1-2 в слизистой оболочке желудка или даже его отсутствие также отмечались некото рыми исследователями [14].
В мононуклеарном воспалительном инфильтра те собственной пластинки слизистой оболочки же лудка распределение иммуногистохимических ме ток имело особенности. Экспрессия Ki-67 отмеча лась преимущественно в центре лимфоидных фол ликулов (рис. 2, г, на вклейке) при минимальном количестве Ki-67-позитивных клеток в составе диффузного инфильтрата (см. рис. 2, б, на вклей ке). Экспрессия Вс1-2 и каспазы-3 наблюдалась в клетках диффузного воспалительного инфильтрата (рис. 2, д, е, на вклейке), а также в лимфоидных фолликулах, причем экспрессия каспазы-3 — в центре фолликула (рис. 2, ж, на вклейке), что со ответствовало зоне выраженной экспрессии Ki-67, а Вс1-2 — в маргинальной зоне фолликула (рис. 2, з, на вклейке). Значения индексов экспрессии Bel-2 и каспазы-3 в мононуклеарном воспалительном инфильтрате слизистой оболочки антрального от дела желудка у лиц с поверхностным и атрофическим гастритом до и после эрадикационнои тера пии представлены на рис. 3.
В нашем исследовании персистенция мононуклеарного воспалительного инфильтрата в слизи стой оболочке антрального отдела желудка обеспе чивалась благодаря низкому уровню экспрессии эффекторной каспазы апоптоза — каспазы-3 по сравнению с высокой экспрессией Вс1-2. Это на-
блюдалось в группе поверхностного гастрита. В группе с атрофическими изменениями слизистой оболочки уровень экспрессии каспазы-3 в воспа лительном инфильтрате был достоверно (р < 0,01) ниже и, более того, оставался на прежнем уровне после успешной эрадикационнои терапии, тогда как при поверхностном гастрите достоверно {р < 0,01) повышался. Уровень Вс1-2 в воспали тельном инфильтрате оставался неизменным во всех исследованных группах (в НР-негативной группе сравнения составлял 24,31 ± 4,82 клетки), что дает основание полагать, что экспрессия Вс1-2 в лимфоцитах поддерживается на постоянном уровне, обеспечивая "выживание" лимфоцитов, и под действием антигенной стимуляции не изменя ется.
Эффект эрадикации, оцененный на иммуногистохимическом уровне, соответствует уже утвер дившимся представлениям о том, что персистен ция воспалительного инфильтрата в отсутствие инфекта сохраняется до полугода и более [6]. Фено мен "самостоятельного" персистирования ин фильтрата получил название ex-Helicobacter pyloriгастрит [12], и именно с такой персистенцией свя зана проблема оценки дальнейшего прогноза тече ния процесса [1].
HP-инфекция приводит к снижению экспрес сии каспазы-3 в мононуклеарном инфильтрате и обеспечивает наряду с постоянством экспрессии Вс1-2 его "выживание". Это соответствует поверх ностному гастриту при небольшом (восстанови мом) "уменьшении" относительного объема желез. Состояние это оказывается обратимым благодаря повышению темпов гибели воспалительных клеток инфильтрата после эрадикации инфекта, на что и указывает повышение экспрессии каспазы-3. В ре зультате при поверхностном гастрите после эради кации железы в теле и антральном отделе желудка достаточно быстро занимают объем, соответствую щий неизмененной слизистой оболочке.
19
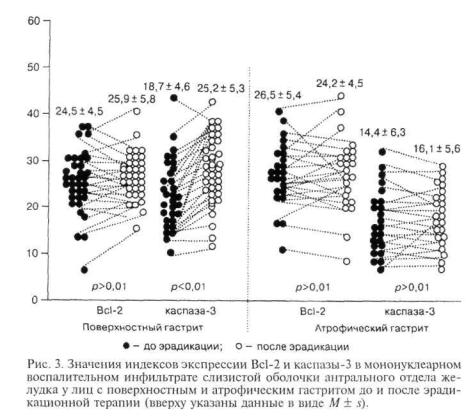
Иная ситуация наблюдается при атрофическом гастрите. Вероятно, длительная персистенция мононуклеарного воспалительного инфильтрата, по стоянно индуцируемого HP, приводит с течением времени к истинной утрате железистого эпителия с развитием собственно атрофии. При этом на ка ком-то этапе рекрутирование и локальная проли ферация мононуклеарных клеток в собственной пластинке становятся относительно независимыми от непосредственного присутствия HP на поверх ности слизистой оболочки и сохраняются даже в случае успешной эрадикации инфекта. Это обеспе чивается низким уровнем экспрессии каспазы-3 в клетках мононуклеарного воспалительного ин фильтрата, не изменяющимся и после эрадикации. Вероятно, популяция лимфоцитов может поддер живаться длительное время благодаря оставшемуся антигенному стимулу, который, возможно, обеспе чивается за счет аберрантной экспрессии антиге нов HP непрофессиональными антигенпрезентирующими клетками [1].
В нашем исследовании обратное развитие атрофических изменений слизистой оболочки с восста новлением объема желез в результате успешной эрадикации выявлено не было, однако отмечалось другими исследователями через 12 мес после про веденной терапии [5, 9]. Очевидно, приблизитель но такой временной период необходим для доста точной регрессии воспалительного инфильтрата и значительного снижения апоптозактивирующих сигналов. Таким образом, обратное развитие атрофических изменений в слизистой оболочке желуд ка определяется не столько эрадикацией инфекта, сколько временем постэрадикационного персистирования мононуклеарного воспалительного ин фильтрата в условиях экс-геликобактерного гаст рита (гастрита после удачной эрадикации бакте рии).
Вы в о д ы
1.При хроническом НР-ассо- циированном гастрите увеличива ется темп клеточного обновления слизистой оболочки (увеличение экспрессии каспазы-3 и маркера пролиферации Ki-67) с расширени ем пролиферативного компартмента и зон апоптоза, причем при ат рофическом гастрите преобладают процессы апоптоза. В условиях эра дикации происходит снижение пролиферативной активности и апоптоза эпителия слизистой обо лочки желудка, однако при атрофи ческом гастрите процессы апоптоза остаются доминирующими и после удаления инфекта.
2.После успешно проведенной эрадикационной терапии атрофические изменения слизистой обо лочки желудка не подвергаются не медленному обратному развитию.
3.В группе атрофического гаст рита по сравнению с поверхност ным гастритом регрессия мононук леарного воспалительного ин фильтрата после успешно прове денной эрадикации замедлена: низ
кий уровень каспазы-3, высокий Ki-67 в мононук леарных клетках.
4.В условиях эрадикации в группе поверхност ного гастрита происходит повышение индекса апоптоза в мононуклеарном воспалительном ин фильтрате собственной пластинки слизистой обо лочки желудка, что обеспечивает более быструю регрессию; в группе атрофического гастрита ин декс апоптоза остается неизменным, обусловливая длительную персистенцию воспаления и поддер жание апоптотических процессов эпителия, лежа щих в основе атрофии слизистой оболочки.
5.Возможность обратимости атрофических из менений слизистой оболочки желудка определяет ся длительностью персистенции воспалительного инфильтрата в условиях экс-геликобактерного га стрита.
ЛИТЕРАТУРА
1.Кононов А. В. II Омский научный вестник. — 2002.
-Вып. 21. - Прил. - С. 17-28.
2.Craig W. L. // Eur. J. Gastroenterol. Hepatol. - 2003.
-Vol. 11. — P. 1195-1201.
3.Demiray M., Gulten M., Manavoglu O. et al. // Hepato-
•Gastroenterology. - 2004. - Vol. 51. - P. 1531-1535.
4.Dixon M. F I/ Am. J. Surg. Pathol. - 1996. - Vol. 201.
-P. 1161-1181.
5.van Grieken N. С. Т., Meijer G. A., Kale I. et al. // Di gestion. - 2004. - Vol. 69. - P. 27-33.
6.Kumar D., DharA., Dattagupta S. et al. // Indian. J. Gas troenterol. - 2002. - Vol. 21 (1). - Jan.-Feb. - P. 7-10.
7.Maeda S., Yoshida H., MitsunoY. et al. // Mol. Pathol.
-2002. - Vol. 55 (2). - Oct. - P. 286-293.
Rugge M., Correa P., Dixon M. F. et al. //Aliment. Phar macol. Ther. - 2002. - Vol. 16. - P. 1249-1259.
Satoh K, Kawata H., Tokumaru К et al. // Dig. Liver. Dis. - 2003. - Vol. 35 (2). - P. 78-84.
20
