
arkhiv patologii_3_2005
.pdf10.Shimada M., Ina К. // Scand. J. Gastroenterol. — 2002.
-Vol. 37(5). - P . 501-511.
11.TariA., Kodama K., Kitadai Y. et al. // J. Gastroenterol. Hepatol. - 2003. - Vol. 18 (5). - May. - P. 498504.
12.Vieth M., Dirshmid K., Oehler U. //Am. J. Surg. Pathol.
-2001. - Vol. 25 (2). - Feb. - P. 259-262.
13.Wyllie J., Houghton M. // Exp. Cell. Res. - 2003. - Vol. 285 (2). - P. 236-242.
14.Xia H. H., Zhang G. S., Talley N. J. // Am. J. Gastro enterol. - 2002. - Vol. 97. - N 12. - P. 3023-3031.
Поступила в редакцию 11.01.05
© КОЛЛЕКТИВ АВТОРОВ, 2005 УДК 616.131/.132-007.271-07:616.127 + 616.45]-008.9-092.18-074-092.9
MORPHOLOGY OF SURFACE AND ATROPHIC GAS TRITIS IN ERADICATION OF HELICOBACTER PY LORI (HP)
A. V.Kononov', S.I.Mozgovoy', M.A.Livzan', I.K.Predvechnaya2, L.D.Novikova2
'Omsk State Medical Academy, 644099, Omsk; 2 Omsk Di agnostic Centre, 644024, Omsk
Summary — It is shown with the use of immunohistochemical detection of Bcl-2, caspase-3 and Ki-67 that erad ication of HP does not result in immediate reverse develop ment of atrophic changes. This depends on duration of per sistence of mononuclear inflammatory cells.
Ark. Pathol., 2005, N. 3, P. 17-21.
Ключевы е слова : гистохимия, адренергические нервные сплетения миокарда, мозговое вещество надпочечника, постнагрузка, левый желудочек, правый желудочек, острая сердечная недостаточность.
О. Д. Мишнев, М. С. Тверская, В. В. Карпова, М. А. Чумакова, Н. С. Измайлова, М. X. Кадырова, Н. 3. Абдулкеримова, В. Ю. Ключиков
ГИСТОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА АДРЕНЕРГИЧЕСКИХ ВОЛОКОН МИОКАРДА И НАДПОЧЕЧНИКОВ В ЭКСПЕРИМЕНТЕ П Р И СУЖЕНИИ АОРТЫ И ЛЕГОЧНОЙ АРТЕРИИ
Государственное образовательное учреждение высшего профессионального образования, Российский государственный медицинский университет МЗ и СР РФ, 117437, Москва
Острое увеличение нагрузки давлением (пост нагрузки) имеет место при сосудистых гипертензиях различного генеза и может осложняться сердеч ной недостаточностью (СН). Известно, что симпа- тико-адреналовая система (САС) играет важную роль как в компенсаторных реакциях сердца, так и в механизмах развития острой СН [4, 7, 9, 13]. Од нако сравнительному изучению влияния нервного и гормонального звеньев САС на эти процессы уде ляется мало внимания. Исследования отдельных авторов свидетельствуют о защитной роли медиа тора симпатической нервной системы в отноше нии миокарда при его очаговых повреждениях [7]. В ряде работ продемонстрировано снижение со держания катехоламинов (Ка) в адренергических нейронах и их терминалях, расположенных в мио карде, при внезапной сердечной смерти [9, 13], а также повышение роли гормонального звена САС по мере увеличения тяжести сердечно-сосудистой патологии [8]. Наличие гормонально-медиаторной диссоциации показано при экспериментальной ишемии миокарда [6].
Цель данной работы — изучить состояние адренергической иннервации миокарда и мозгового ве щества надпочечников при увеличении нагрузки давлением левого желудочка (ЛЖ) и правого желу дочка (ПЖ), а также выявить прогностически не благоприятные изменения в отношении развития острой СН.
Исследование проведено на 40 морских свинках мас сой 500—700 г в условиях открытой грудной клетки и при искусственной вентиляции легких. Для вводного наркоза использовали кетамин (25 мг внутримышечно), для под держивающего наркоза — тиопентал-натрий (60—80 мг/кг внутрибрюшинно).
Увеличение нагрузки давлением воспроизводили пу тем внешнего сужения просвета аорты или легочного
ствола (ЛС), которое сопровождалось повышением сис толического давления в желудочках сердца на 100% по сравнению с исходным уровнем. Продолжительность стеноза сосудов составила 30 мин.
Животные были разделены на 5 групп. 1-ю группу со ставили контрольные животные, у которых, так же как и у животных других групп, проводили вскрытие грудной клетки и катетеризацию желудочков сердца, но не вос производили стеноза сосудов (п = 10). Во 2-ю и 3-ю группы вошли животные, у которых стеноз аорты (п = 12) и стеноз ЛС (п = 10) не сопровождались разви тием острой СН. В 4-ю и 5-ю группы были включены животные, у которых стеноз аорты (и = 3) и стеноз ЛС (л = 5) осложнялись острой СН с летальным исходом в течение 30 мин с момента наложения лигатуры. Из опыта животных 1, 2 и 3-й групп выводили внутрибрюшинным введением летальной дозы тиопентала-натрия через 45 мин после завершения катетеризации.
Для гистохимического изучения забирали стенку ЛЖ, ПЖ и межжелудочковую перегородку (МЖП) сердца, а также левый надпочечник. Из замороженных сухим льдом образцов готовили криостатные срезы толщиной 25 мкм при температуре —15—20°С. Для гистохимическо го выявления Ка срезы обрабатывали 2% раствором глиоксиловой кислоты [12, 14] при рН 7,0. Относительную площадь, занимаемую адренергическими нервными сплетениями в миокарде, рассчитывали по методу Р. А. Стропуса [9], применяя планиметрическую окулярную сетку с 960 узловыми точками. Интенсивность люминес ценции Ка в мозговом веществе надпочечников регист рировали с помощью фотометрической насадки ФМЭЛ1У4,2 на люминесцентном микроскопе ЛЮМАМ-ИЗ. Полученные данные обрабатывали методами вариацион ной статистики с использованием ?-критерия Стьюдента.
При визуальном исследовании миокарда адренергические нервные сплетения выявляются в виде ветвящихся тяжей с характерным ярко-зеленым свечением, по ходу которых располагаются вари козные утолщения (см. рисунок, а, на вклейке).
91

Наибольшее количество сплетений обнаруживает ся вблизи сосудов (см. рисунок, б, на вклейке). При количественном изучении относительная площадь, занимаемая адренергическими нервными сплете ниями в миокарде контрольных животных, состав ляет 1,40 ± 0,07% в ПЖ, 0,99 ± 0,04% в ЛЖ и 1,26 ± 0,05% в МЖП, что согласуется с литератур ными данными о большей плотности симпатиче ской иннервации в правых отделах сердца [9, 13] (см. таблицу).
Во 2-й и 3-й группах, когда острое повышение сопротивления выбросу крови не осложняется раз витием острой СН, выявлены следующие измене ния в состоянии симпатической иннервации серд ца (см. таблицу). При стенозе аорты плотность ад ренергических нервных сплетений в миокарде ПЖ по сравнению с контролем увеличивается в 1,9 раза и составляет 2,61 ±0,13% (р < 0,001). В этих же случаях плотность нервных сплетений в миокарде ЛЖ по сравнению с контролем не изменяется и со ставляет 0,95 ± 0,05% (р > 0,1). При стенозе ЛС плотность адренергических нервных сплетений в миокарде ЛЖ по сравнению с контролем увеличи
вается в |
2 раза и составляет 2,78 ± 0,09% |
(р < 0,001). |
В этих же случаях плотность нервных |
сплетений в миокарде ПЖ по сравнению с контро лем практически не изменяется и составляет 1,29 + 0,08% (р>0,1).
Таким образом, увеличение плотности адренергической иннервации происходит в интактном (по отношению к нагрузке давлением) желудочке, т. е. при стенозе аорты в ПЖ, а при стенозе ЛС в ЛЖ. Изменения содержания Ка в нервных сплетениях интактного желудочка отражают реакцию симпа тической нервной системы. Полученные данные свидетельствуют об активации иннервирующих сердце адренергических нейронов в случаях, когда увеличение нагрузки давлением не приводит к де прессии сердечной деятельности. Это согласуется с результатами проведенных нами ранее исследова ний [5], которые выявили усиление функциональ ной активности адренергических нейронов, а так же повышение содержания Ка в структурах звезд чатого ганглия и в нервных сплетениях миокарда в случаях, когда увеличение нагрузки давлением ПЖ при воспроизведении массивной легочной эмбо лии не осложнялось развитием СН. Активация симпатической нервной системы не приводит к по вышению содержания Ка в адренергических спле тениях миокарда того желудочка, чья нагрузка дав лением увеличивается, т. е. при стенозе аорты в
ЛЖ, а при стенозе ЛС в ПЖ. Это, по-видимому, связано с преобладанием выделения Ка над их син тезом и нейрональным захватом. Недостаточность энергозависимых механизмов синтеза и нейронального захвата, а также интенсивное выделение Ка из нервных окончаний могут быть обусловлены резким усилением работы желудочка при остром увеличении нагрузки давлением. Аналогичные данные получены нами [5, 10] при воспроизведе нии массивной легочной эмболии у собак в случа ях, когда увеличение постнагрузки ПЖ не ослож нялось развитием СН.
Всовокупности результаты настоящей работы и проведенные нами ранее исследования [5, 10] сви детельствуют, что воспроизводимое у разных жи вотных (морские свинки, собаки) различными экс периментальными способами (стеноз аорты, сте ноз ЛС, эмболическая окклюзия легочных сосудов) увеличение нагрузки давлением ЛЖ и нагрузки давлением ПЖ приводит к сходным изменениям в состоянии симпатической иннервации сердца. Это позволяет говорить об общей закономерности, в соответствии с которой при остром увеличении на грузки давлением, не сопровождающемся развити ем СН, плотность адренергических нервных спле тений в миокарде нагруженного желудочка не из меняется, а в миокарде интактного желудочка уве личивается.
В4-й и 5-й группах, когда острое повышение сопротивления выбросу крови осложняется разви тием СН, плотность симпатической иннервации по сравнению с контролем достоверно уменьшается почти во всех исследуемых отделах сердца. При стенозе аорты относительная площадь, занимаемая адренергическими нервными сплетениями в мио карде, составляет в ПЖ 0,64 ± 0,12% (р < 0,001), в ЛЖ 0,55 + 0,08% О < 0,001), в МЖП 0,49 ± 0,06% (р < 0,001). При стенозе ЛС плотность адренерги ческих сплетений составляет в ПЖ 0,72 + 0,07% (р < 0,001), в ЛЖ 1,33 ±0,11% (р< 0,001), в МЖП 0,70 ± 0,09% (р < 0,001) При визуальном исследо вании миокарда наблюдается резкое уменьшение количества люминесцирующих нервных сплетений
иварикозных утолщении (см. рисунок, в, г, на вклейке). Десимпатизация сердечной мышцы име ет очаговый характер и в большей степени затраги вает ПЖ и МЖП. Сохранившиеся терминали име ют, как правило, небольшую протяженность.
Результаты настоящей работы согласуются с имеющимися в литературе данными о снижении содержания Ка в миокарде при внезапной сердеч-
ной смерти [9, 13]. Принято считать, что десимпатизация сердечной мышцы является прежде всего результатом подавления биосинтеза медиатора [4, 6], что может быть связано с деструктивными из менениями в адренергических нейронах [1, 2]. Это подтверждается и результатами проведенных нами ранее исследований [5], согласно которым при массивной легочной эмболии, осложненной СН, в большей части адренергических нейронов выявля лись выраженные деструктивные изменения, что сопровождалось резким уменьшением содержания Ка в структурах звездчатого ганглия и в нервных сплетениях миокарда. Повреждение нейронов мо жет быть обусловлено как их гиперфункцией, так и системными альтернативными воздействиями, такими, как артериальная гипоксия и нарушение периферического кровообращения. Значение по следнего фактора подтверждается нашими преды дущими исследованиями [5], которые при увеличе нии нагрузки давлением ПЖ выявили в симпати ческих ганглиях нейроны с морфологическими признаками ишемического повреждения.
При люминесцентном изучении надпочечников контрольных животных выявляется тусклое желтозеленое свечение коркового вещества и неоднород ное яркое изумрудное свечение мозгового вещества (см. рисунок, д, на вклейке). Хромаффиноциты расположены поодиночке или комплексами (от 2— 3 до 50—60 клеток), неравномерно распределены в мозговом веществе и часто контактируют с сосуда ми синусоидного типа. Хромаффинные клетки имеют разнообразную форму и разную интенсив ность свечения — от очень яркой до тусклой. В це лом люминесценция мозгового вещества характе ризуется полиморфизмом, что обусловлено асин хронным типом секреции хромаффиноцитов.
При количественном исследовании интенсив ности люминесценции мозгового вещества надпо чечников получены следующие данные (см. табли цу). В контрольной группе интенсивность люми несценции хромаффинных клеток составляет 4,26 ± 0,09 усл. ед. При остром увеличении пост нагрузки, не осложненном развитием СН, интен сивность люминесценции по сравнению с контро лем изменяется мало: увеличивается на 8% (р < 0,05) при стенозе аорты, составляя 4,59 ± 0,12 усл. ед., и на 13% (р < 0,05) при стенозе ЛС, со ставляя 4,82 ±0,12 усл. ед.
Напротив, в случаях, когда увеличение нагрузки давлением осложняется развитием острой СН, ин тенсивность люминесценции мозгового вещества надпочечников по сравнению с контролем значи тельно увеличивается (см. рисунок, е, на вклейке): на 64% (р < 0,001) при стенозе аорты — 7,00 + 0,41 усл. ед., на 29% (р < 0,001) при стенозе Л С — 5,51 ± 0,31 усл. ед.
Полученные данные согласуются с результатами проведенных нами ранее исследований [10], кото рые выявили повышение содержания Ка в хромаф финных клетках надпочечников в случаях, когда увеличение нагрузки давлением ПЖ при воспроиз ведении массивной легочной эмболии осложня лось развитием СН. В целом сопоставление изме нений, обнаруженных в адренергических структу рах миокарда и в мозговом веществе надпочечни ков при увеличении нагрузки давлением желудоч ков сердца, подтверждает существующее мнение об
отсутствии параллелей в реакциях гормонального и медиаторного звеньев САС [6, 11].
Сравнение состояния САС при остром увеличе нии нагрузки давлением, осложненном и не ослож ненном развитием СН, позволило выявить прогно стически неблагоприятные изменения. К ним от носятся: резкое уменьшение плотности адренерги ческих нервных сплетений в миокарде и повыше ние активности хромаффинных клеток надпочеч ников, которое на фоне десимпатизации сердечной мышцы обусловливает выраженное увеличение удельного значения гормонального звена в струк туре симпатико-адреналовых влияний на сердце. Полученные результаты согласуются с данными других авторов [8] о повышении роли гормональ ного звена САС по мере усиления гемодинамических нарушений. Известно, что реакции сердечно сосудистой системы на одинаковую степень повы шения нагрузки у особей одного вида, пола и воз раста могут существенно различаться, обусловли вая в одних случаях длительное поддержание на сосной функции сердца, а в других случаях — бы строе развитие острой СН. По мнению некоторых авторов [3], важным фактором индивидуальной ус тойчивости при состояниях напряжения является генетически детерминированная активность фер ментов синтеза Ка. Представляется, что течение острого периода увеличения нагрузки давлением желудочков сердца (поддержание сократительной способности миокарда или развитие СН) в опреде ленной мере зависит от индивидуальных особенно стей биохимических, физиологических и морфогенетических процессов, реализующих симпатикоадреналовые влияния.
З а к л ю ч е н и е
Таким образом, полученные данные свидетель ствуют об активации медиаторного звена симпати- ко-адреналовой системы при остром стенозе аорты и остром стенозе легочного ствола (ЛС). Выявлена закономерность, в соответствии с которой при ост ром повышении нагрузки давлением без развития сердечной недостаточности (СН) содержание катехоламинов (Ка) в адренергических нервных спле тениях миокарда интактного (по отношению к пе регрузке давлением) желудочка увеличивается, а в адренергических нервных сплетениях миокарда на груженного желудочка и клетках мозгового веще ства надпочечников не изменяется.
При остром стенозе аорты и остром стенозе ЛС, осложненных СН, выявлена нейрогормональная диссоциация: содержание Ка в адренергических нервных сплетениях миокарда уменьшается, а в клетках мозгового вещества надпочечников увели чивается.
Полученные результаты свидетельствуют о за щитной роли медиаторного звена в отношении миокарда и о важном значении симпатической нервной системы для поддержания сердечной дея тельности в условиях острой перегрузки сердца давлением. Выявленные нами в эксперименте десимпатизация сердечной мышцы и повышение удельного значения надпочечников в структуре симпатико-адреналовых влияний на сердце спо собствуют нарушению физиологических свойств миокарда и являются важным звеном патогенеза
73
СН при острых артериальных гипертензиях боль шого и малого кругов кровообращения.
ЛИ Т Е Р А Т У Р А
1.Амвросьев А. П., Рогов Ю. И. //Арх. пат. — 1987. — Т. 49, № 2. - С. 48-52.
2.Аникин А. Ю. Состояние адренергической иннерва ции сердца при внезапной смерти в зависимости от патологии миокарда и при экспериментальном ин фаркте: Автореф. дис. .. канд. мед. наук. — М., 1988.
3.Анохина И. П. // Мотивация и эмоциональный стресс. - М., 1987. - С. 3-8.
4.Меерсон Ф. 3. Патогенез и предупреждение стрессорных и ишемических повреждений сердца. — М., 1984.
5.Мишнев О. Д., Тверская М. С, Чумакова М. А. и др.
//Бюл. экспер. биол. и мед. — 1994. — Т. 118, № 10.
-С. 368-373.
6.Ольбинская Л. И., Литвицкий П. Ф. Коронарная и миокардиальная недостаточность. — М., 1986.
7.Серов Р. А. Морфологический анализ патогенетиче ской роли симпато-адреномедуллярной системы при очаговых метаболических повреждениях мио карда: Автореф. дис. ... д-ра мед. наук. — М., 1989.
8.Степанян Е. П., Ярлыкова Е. И., Кузнецова Б. А.
Энергетика оперированного сердца. — М., 1978.
9.Стропус Р. А. Холинергическая и адренергическая иннервация сердца и ее изменения при сердечно сосудистой патологии: Автореф. дис. ... д-ра мед. наук. - М., 1982.
10.Тверская М. С, Карпова В. В., Макарова Л. Д. и др.
//Бюл. экспер. биол. и мед. — 1993. — Т. 115, № 4.
-С. 347-350.
11.Теппермен Дж., Теппермен X. Физиология обмена веществ и эндокринной системы / Пер. с англ. — М., 1989.
12.Швалев В. Н., Жучкова Н. И. // Арх. анат. - 1979.
-Т . 76, № 6. - С. 114-116.
13.Швалев В. Н., Сосунов А. А., Гуски Г. Морфологиче ские основы иннервации сердца. — М., 1992.
14.Lindwall О., Bjor Klund A. // Histochemistry. — 1974.
-Vol. 39. - P. 97-127.
Поступила в редакцию 17.12.04
HISTOCHEMICAL CHARACTERISTICS OF ADREN ERGIC MYOCARDIAL AND ADRENAL FIBERS IN EX PERIMENTAL NARROWING OF THE AORTA AND PULMONARY ARTERY
O.D.Mishnev, M.S. Tverskaya, V. V.Karpova, M.A.Chumakova, N.S.Izmailova, M.Kh.Kadyrova, N.Z.Abdulkerimova,
V. Yu.Klyuchnikov
Russian State Medical University, 117437, Moscow
S u m m a r y — Ligation of the aorta or the pulmonary trunk was the method of experimental overloading of heart ventri cles. Histochemical studies indicated activation of mediator chain of the sympatho-adrenal system. Catecholamines con tent in the nervous plexus of the overloaded ventricle did not change but there was an increase of their content in the med ullary layer of the adrenals. Thus, chromaffin cells activity in creases and desympathization of the heart muscle may be an important step in pathogenesis of heart failure in acute arterial hypertension.
Ark. Pathol., 2005, N. 3, P. 21-24.
© КОЛЛЕКТИВ АВТОРОВ, 2005
УДК 616.127-005.8-036.11-091.8
Ключевы е слова : острый инфаркт миокарда, множественные нестабильные бляшки.
Т. П. Шлычкова, В. С. Жданов, Ю. А. Карпов, П. В. Чумаченко
ОСНОВНЫЕ ТИПЫ НЕСТАБИЛЬНЫХ АТЕРОСКЛЕРОТИЧЕСКИХ БЛЯШЕК И ИХ РАСПРОСТРАНЕННОСТЬ В КОРОНАРНЫХ АРТЕРИЯХ ПРИ ОСТРОМ ИНФАРКТЕ МИОКАРДА
Лаборатория патоморфологии сердечно-сосудистых заболеваний отдела сердечно-сосудистой патологии (руководитель — член-корр. РАМН проф. Ю. В. Постнов) Института кардиологии им. А. Л. Мясникова РКНПК МЗ и СР РФ, 121552, Москва
Многочисленные исследования показали, что морфологической основой острого инфаркта мио карда (ОИМ) являются так называемые нестабиль ные бляшки, склонные к разрыву и изъязвлению с последующим тромбозом [1, 4, 6, 9—11, 15]. Одна ко остается недостаточно изученным вопрос о рас пространенности нестабильных атеросклеротических бляшек в коронарных артериях у больных с ОИМ. Проводимые в последнее время исследова ния по изучению этой проблемы были в основном представлены ангиоскопическими [5, 12], ангиографическими [7, 8, 13, 14] и внутрисосудистыми ультразвуковыми [16, 18] исследованиями у боль ных с ОИМ.
Целью настоящего исследования явилось изуче ние типов нестабильных атеросклеротических бля шек и их распространенности в коронарных арте риях у умерших от ОИМ на основе данных макро- и микроскопических исследований и сопоставле ния полученных данных с анамнезом, клинической картиной заболевания и некоторыми факторами
риска (артериальная гипертония, гиперхолестеринемия, повышенная масса тела, курение).
Материалом для исследования послужили 180 коро нарных артерий 60 умерших (38 мужчин и 22 женщины) в отделе неотложной кардиологии Института клиниче ской кардиологии им. А. Л. Мясникова (руководитель отдела — проф. М. Я. Руда) от ОИМ (в основном на 1 — 2-е сутки от начала заболевания) в возрасте от 41 года до
79 лет (средний возраст 63+11 лет). Все умершие по данным анамнеза были разделены на 3 группы по 20 че ловек в каждой. В 1-й группе ОИМ развился без пред шествующего коронарного анамнеза. Во 2-й группе в анамнезе отмечалась стабильная стенокардия. В 3-й группе ОИМ предшествовала нестабильная стенокардия.
80 всех случаях диагноз ОИМ был установлен на осно вании клинической симптоматики, данных электрокар диографии, реакции кардиоспецифических ферментов и подтвержден при вскрытии умерших. Непосредственной причиной смерти в 28 наблюдениях был кардиогенный шок, в 23 — разрыв сердца, в остальных 9 — нарастающая сердечная недостаточность.
Коронарные артерии исследовали с интервалом 5 мм на поперечных срезах (всего изучено 1080 срезов арте-
24
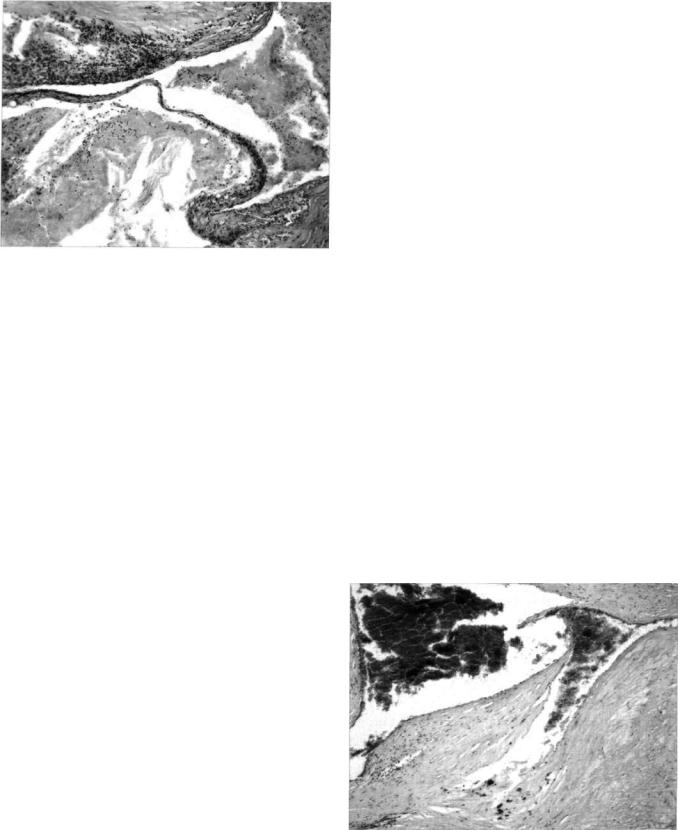
Рис. 1. Нестабильная бляшка липидного типа с резко ис тонченной фиброзной покрышкой с обтурирующим тромбом в просвете сосуда у мужчины 52 лет с острым инфарктом миокарда с анамнезом стабильной стенокар дии (6 лет) и нестабильной стенокардии (1 нед), с повы шенным уровнем липидов (холестерин 6,5 ммоль/л, триглицериды 1,81 ммоль/л).
Окраска гематоксилином и эозином. *40.
рий). Последние окрашивали гематоксилином и эози ном, по Массону (на коллаген), жировым красным О (на липиды). Клеточные элементы атеросклеротических бляшек идентифицировали иммуноморфологически двойным пероксидаза-антипероксидазным методом с помощью моноклональных антител фирмы "Dako" (Да ния) к моноцитам/макрофагам (Мн/Мф), к Т-лимфоци- там (Т-Лф) хелперам и киллерам/супрессорам (CD68, CD4 и CD8) в разведении 50 мкг/мл. Визуализацию ан тител проводили с использованием пероксидаза-антипе- роксидазного комплекса фирмы ICN (США) и 0,05% раствора диаминобензидина тетрагидрохлорида фирмы "Sigma" (США).
При исследовании различали следующие виды ост рых коронарных повреждений: разрыв или надрыв, эро зию фиброзной покрышки атеросклеротической бляшки
стромбозом или без него, кровоизлияния в бляшки. Раз рыв бляшки оценивали как дефект фиброзной покрыш ки, проникающий внутрь атероматозного ядра бляшки, а надрыв — как дефект, не проникающий в ядро бляшки
стромбозом в области покрышки или без него. К эрозии относили поверхностные дефекты фиброзной покрышки атеросклеротической бляшки, связанные с воспалитель ной клеточной реакцией.
Во всех случаях проводили морфометрию структур ных компонентов бляшки. Определяли толщину фиброз ной покрышки (в мкм) и относительную величину ли пидного ядра (в % от общей площади бляшки). Количе ство клеток воспаления — Т-Лф, Мн/Мф — в покрышке подсчитывали при 200-кратном увеличении светового микроскопа в поле зрения видеокамеры, выводимом на экран монитора компьютера, площадь которого состав ляла 0,06 мм2.
Для статистической обработки полученных данных проводили расчет средних величин (М) и стандартного отклонения (а). Взаимосвязь различных типов атеро склеротических бляшек с уровнем липидов в плазме кро ви определяли с помощью построения таблиц сопряжен ности с последующим расчетом коэффициента ранговой корреляции Спирмена (г); значимым считали г, > 0,3 при р < 0,05. Для оценки различий групп по факторам риска и коронарному анамнезу использовали метод %2 в модификации Фишера.
В результате исследования было выделено два морфологических типа нестабильных атеросклеро тических бляшек — липидный и дистрофическинекротический.
Липидный тип нестабильных бляшек (70% слу чаев) характеризуется наличием крупного атерома тозного ядра, которое занимает от 39,3 до 84,5% всей площади бляшки, и истончением фиброзной покрышки (до 15 мкм). В покрышках бляшек ли пидного типа часто выявляется большое количест во липидов, как внутриклеточных с образованием пенистых клеток, так и внеклеточных от капель разной величины до полного пропитывания по крышки. Между рыхло расположенными коллагеновыми волокнами фиброзной покрышки отмеча ется значительное скопление клеточных элемен тов, которые представлены CD4- и CDs-позитив ными Т-Лф и СБ68-положительными Мн/Мф с преобладанием последних. СБ68-положительные клетки встречались на всем протяжении фиброз ной покрышки, тогда как CD4- и СБ8-положи- тельные клетки лимфоцитарного ряда располага лись в основном в краевых частях бляшки и редко в центральной части покрышки. Следует отметить, что увеличение числа указанных клеток может быть выражено в разной степени — от незначи тельного их числа до скопления в покрышках не которых бляшек очень большого их количества (от 152,7 до 277,8 клетки на 0,06 мм2, в среднем 205 ± 38,7 клетки). В 13% исследованных случаев эта реакция была значительно выраженной в по верхностных слоях интимы с гибелью покрываю щих этот участок эндотелиальных клеток и разви тием воспалительной эрозии атеромы. Характер ным для бляшек липидного типа является также наличие некрозов в покрышках бляшек, выявлен ных в 27 (45%) случаях с воспалительной клеточ ной реакцией по периферии, в 9 (15%) случаях с одновременным обызвествлением некротизированных коллагеновых волокон. В нестабильных
Рис. 2. Нестабильная бляшка дистрофически-некротиче ского типа с краевым надрывом фиброзной покрышки с пристеночным и обтурирующим тромбами в просвете коронарной артерии у мужчины 78 лет с острым инфарк том миокарда с 15-летним анамнезом стабильной стено кардии, с длительным анамнезом артериальной гиперто нии (20 лет), с нормальным уровнем липидов (холесте рин 3,1 ммоль/л, триглицериды 0,71 ммоль/л).
Окраска гематоксилином и эозином. х40.
25
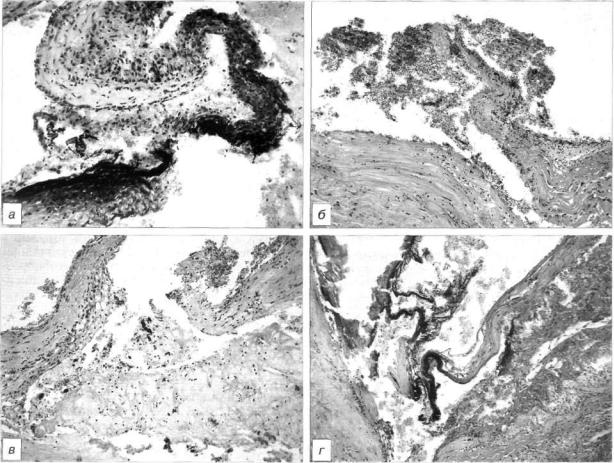
Рис. 3. Множественные нестабильные бляшки с центральными (а, в) и краевыми (б, г) разрывами у мужчины 42 лет с острым инфарктом миокарда передней локализации со стабильной стенокардией в анамнезе (1 год), с повышенным уровнем липидов (холестерин 7,3 ммоль/л, триглицериды 2,35 ммоль/л).
Окраска гематоксилином и эозином, а — в передней нисходящей артерии. хЮО; б, в, г — в огибающей артерии. хбЗ.
атеросклеротических бляшках липидного типа по стоянно наблюдаются надрывы и разрывы (цен тральные и краевые) их фиброзных покрышек, со четающиеся с пристеночным или обтурирующим коронарным тромбозом и с кровоизлияниями в подлежащие структуры. Поэтому бляшки с указан ными выше характеристиками без разрывов их фиброзных покрышек были отнесены нами к не стабильным бляшкам липидного типа (вследствие большого содержания атероматозных масс), так как они имеют высокую угрозу разрыва (рис. 1).
Для дистрофически-некротического типа неста бильных бляшек (30% случаев) характерны выра женные дистрофические изменения и некрозы в их покрышках. Этот тип бляшек характеризуется обычно толстой фиброзной покрышкой (> 45 мкм), которая имеет обширные бесструктурные и бесклеточные участки, соответствующие очагам некроза, при отсутствии или незначительной липидной инфильтрации. По периферии этих некро зов часто отмечаются участки обызвествления и умеренно выраженная воспалительная клеточная реакция (от 25,5 до 62,7 клетки на 0,06 мм2, в сред нем 37,8 ±11,7 клетки), коллагеновые волокна в некоторых местах могут быть разволокнены. Липидное ядро в таких бляшках небольшое, его раз меры в большинстве случаев не превышают 20% площади бляшки, в некоторых бляшках липидные включения не образуют локальных скоплений. В
покрышках таких бляшек отмечаются надрывы фиброзного покрова, чаще всего в краевых частях бляшек. Поскольку в этих бляшках встречаются надрывы фиброзных покрышек с пристеночным и обтурирующим тромбозом, нами они были отнесе ны к категории нестабильных бляшек дистрофиче ски-некротического типа (рис. 2).
При оценке взаимосвязи различных типов не стабильных бляшек с уровнем холестерина (ХС) и триглицеридов (ТГ) в плазме крови у умерших пу тем расчета коэффициента ранговой корреляции Спирмена была выявлена положительная корреля ционная связь. У лиц с липидным типом бляшек средний уровень ХС составил 6,64 ± 1,56 ммоль/л,
при дистрофически-некротическом |
типе |
— |
|||
3,9 ±1,09 |
ммоль/л (г, =+0,590), |
уровень ТГ |
- |
||
1,74 ± 0,79 |
и |
1,02 ± 0,22 ммоль/л |
соответственно |
||
(г, = +0,557), |
что свидетельствует |
о |
нарушениях |
||
липидного обмена у умерших с липидным типом бляшек.
На основании изучения в каждом случае трех ос новных коронарных артерий нами было выявлено, что бляшки с вышеописанными патоморфологическими признаками нестабильности встречаются с различной частотой. Так, в 56% исследованных на ми случаев нестабильные бляшки локализовались преимущественно в 2 коронарных артериях, в 12% — в 3 артериях и в 32% — в 1 артерии, причем в 43,3% случаев бляшки с разрывами и надрывами фиброз-
I II |
I |
II |
I II |
1 артерия |
2 артерии |
3 артерии |
|
Рис. 4. Соотношение (в %) единичных (У) и множествен ных (II) нестабильных бляшек при их наличии в 1, 2 и 3 коронарных артериях.
ного покрова отмечались одновременно в 2 артериях (рис. 3) и в 4 (6,7%) случаях — в 3 артериях. Коли чество нестабильных бляшек в пораженных артери ях было различным — от одной до нескольких не стабильных бляшек в 1 артерии (рис. 4).
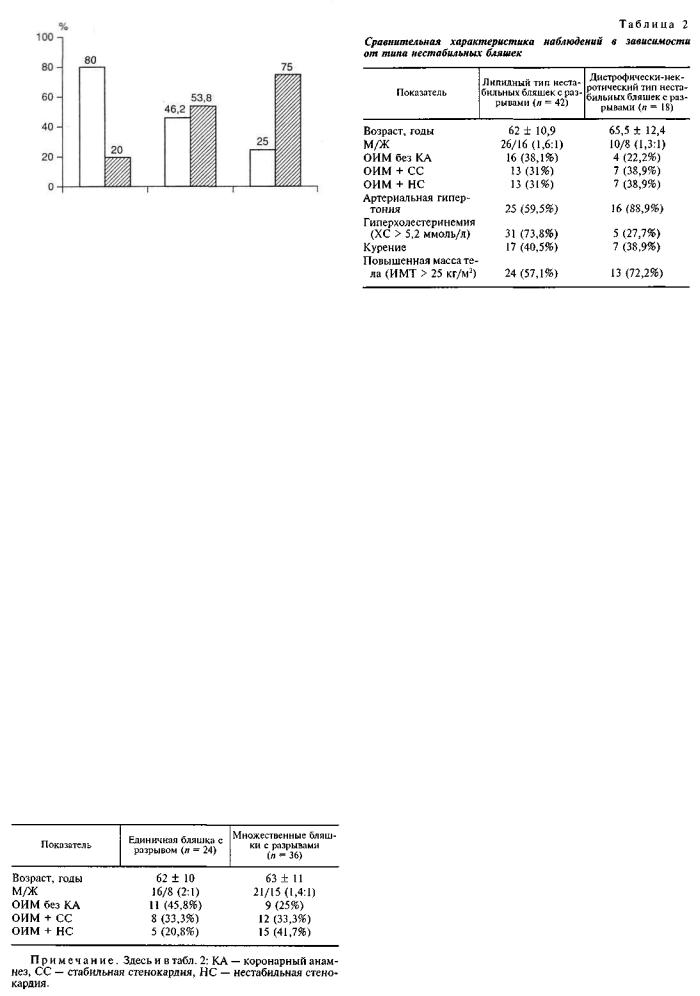
При анализе частоты встречаемости одиночных и множественных нестабильных бляшек в группах умерших в зависимости от предшествующего коро нарного анамнеза были выявлены некоторые осо бенности (табл. 1).
Так, в группе исследуемых с отсутствием коро нарного анамнеза единичные нестабильные бляш ки отмечались в 1,83 раза чаще, чем множествен ные (45,8% против 25%). Напротив, в группе с предшествующей нестабильной стенокардией оди ночные бляшки встречались в 2 раза реже, чем множественные (20,8% против 41,7%), а при ста бильной стенокардии в анамнезе одиночные и множественные бляшки наблюдались с одинако вой частотой (33,3% против 33,3%).
Умершие с одной и множественными неста бильными бляшками не различались значительно по возрасту, полу и наличию факторов риска: ар териальная гипертония (66,6% против 69,4%), гиперхолестеринемия (62,5% против 58,3%), курение (37,5% против 41,6%), повышенная масса тела (58,3% против 63,8%) при р > 0,05.
Однако между собой умершие с липидным и дис трофически-некротическим типом бляшек несколь ко различались по наличию факторов риска, но не различались по коронарному анамнезу (табл. 2).
Достоверные различия в группах по факторам риска отмечались по артериальной гипертонии
Таблица 1
Клинико-морфологическая характеристика наблюдений с еди ничными и множественными нестабильными бляшками
П р и м е ч а н и е . ИМТ — индекс массы тела.
(р < 0,05), которая чаще наблюдалась при дистро фически-некротическом типе бляшек по сравне нию с липидным типом нестабильных бляшек (88,9% против 59,5%). Гиперхолестеринемия, на оборот, отмечалась значительно чаще при липидном типе нестабильных бляшек (73,8% против 27,7%; р < 0,02). Статистически достоверных раз личий по другим исследуемым факторам риска не установлено. Также не было выявлено значитель ных различий между группами по возрасту. Сред ний возраст при липидном типе бляшек составил 62 ± 10,9 года, при дистрофически-некротическом типе — 65,5 ± 12,4 года.
Как показали проведенные исследования, воз никновение нестабильных бляшек обусловлено на личием ряда факторов, среди которых важную роль играют размер атероматозного ядра, толщина и особенности строения покрышки атеросклеротической бляшки: содержание коллагена, липидная инфильтрация, воспалительная клеточная реакция [17, 19, 20] и распространенные некрозы фиброз ной покрышки с кальцинозом [2—4].
По данным наших исследований, у большинст ва умерших от ОИМ в коронарных артериях отме чаются множественные бляшки с патоморфологическими характеристиками нестабильных, однако не все они являются разрушенными.
По данным некоторых авторов [5], использовав ших ангиоскопические исследования для выявления нестабильных бляшек в коронарных артериях у больных, перенесших ОИМ, множественные потен циально нестабильные бляшки с одинаковой часто той были выявлены как в инфарктсвязанной, так и в не связанных с инфарктом артериях, что указыва ет, по мнению авторов, на "панкоронарный" про цесс. Другие авторы [12], исследовавшие инфарктсвязанные артерии у 102 пациентов с ОИМ, множе ственные нестабильные бляшки с разрывами или эрозиями отмечали у 10% больных, причем 9 (8,8%) пациентов имели по 2 разорванные бляшки в одной артерии, а 1 пациент — 4 бляшки.
По данным ангиографических исследований 253 пациентов, проведенных J. A. Goldstein и соавт. [13], 40% пациентов с ОИМ имели множественные нестабильные бляшки с тромбозом и неблагопри ятный прогноз по сравнению с пациентами с еди-
27
ничными бляшками. Ангиографические данные других авторов свидетельствуют о наличии множе ственных бляшек в 38% [8] и 27% [14] случаев. G. Rioufol и соавт. [18] сообщили о 24 пациентах с ОИМ, которым выполнено ультразвуковое иссле дование (УЗИ) 3 сосудов, при этом были выявлены 50 разорванных бляшек у 24 пациентов, из них 17 (79%) пациентов имели разрывы бляшек в 2 арте риях и 3 (12,5%) — разрывы во всех 3 артериях. По добное исследование других авторов [16] показало, что у 33 (15%) из 226 пациентов были множествен ные нестабильные бляшки, из них 25 пациентов имели 2 разорванные бляшки в 1 артерии, 6 боль ных — 3 разорванные бляшки и 2 пациента — ра зорванные бляшки в 2 артериях, причем следует от метить, что только 29 из 226 пациентов проводи лось УЗИ 3 сосудов.
Таким образом, представленные результаты ис следований показывают, что ОИМ развивается вследствие разрыва одной или нескольких бляшек, склонных к разрыву и распространенных по всем коронарным артериям, а различия с данными, по лученными в других исследованиях, по-видимому, связаны с разной чувствительностью используемых методов исследования.
Учитывая вышеизложенное, можно предполо жить, что наличие множественных бляшек с патоморфологическими признаками нестабильности с ненарушенным фиброзным покровом у больных с ОИМ может способствовать развитию повторных ОИМ в дальнейшем [5], а множественные разрывы бляшек с тромбозом — утяжелять прогноз заболе вания вследствие более обширного поражения миокарда.
Наши данные и данные других авторов [12, 13, 16] о наличии факторов риска у пациентов с мно жественными и единичными нестабильными бляшками значительно не различались. Однако при оценке влияния факторов риска при различ ных типах нестабильных бляшек в нашем исследо вании гиперхолестеринемия значительно чаще от мечалась при липидном типе бляшек. Артериаль ная гипертония преобладала при дистрофически - некротическом типе бляшек, что, по-видимому, связано с гемодинамическим воздействием повы шенного кровяного давления на аваскулярную со судистую стенку, которое в дальнейшем приводит к ее некротизированию.
Вы в о д ы
1.В коронарных артериях наблюдаются два ос новных типа нестабильных атеросклеротических бляшек — липидный, выявленный в 70% исследо ванных случаев острого инфаркта миокарда (ОИМ)
исопровождающийся в 73,8% нарушениями липидного обмена и дистрофически-некротический, наблюдаемый в 30% случаев и сопровождающийся артериальной гипертонией в 88,9% наблюдений и гиперхолестеринемией только в 27,7%.
2.При ОИМ нестабильные бляшки в большин стве случаев имеют распространенный характер. Множественные нестабильные бляшки при пора жении 1 коронарной артерии встречались в 20% случаев, 2 артерий — в 53,8% и при поражении 3 коронарных артерий — в 75% случаев.
3.При ОИМ на фоне нестабильной стенокар дии преобладали множественные нестабильные
бляшки с разрывами, при развитии ОИМ в случаях отсутствия коронарного анамнеза — одиночные нестабильные бляшки, а при стабильной стенокар дии одиночные и множественные бляшки отмеча лись с одинаковой частотой.
ЛИТЕРАТУРА
1.Грацианский Н. А. // Кардиология. — 1996. — № 11.
-С. 4-16.
2.Жданов В. С, Вихерт А. М. // Арх. пат. - 1981. - Вып. 10. - С. 40-45.
3.Жданов В. С. II Арх. пат. - 1993. - Вып. 2. - С. 58-63.
4.Шлычкова Т. П., Черпаченко Н. М., Чумаченко П. В
и др. // Кардиология. - 2003. - № 12. - С. 42-46.
5.Asacura M., Ueda Y, Yamaguchi О. et al. // J. Am. Coll. Cardiol. - 2001. - Vol. 37, N 5. - P. 1284-1288.
6.Atherosclerosis and Coronary Artery Disease / Eds V. Fusteretal. - Philadelphia, 1996. -Vol. 1. - P. 491507.
7.Auer J., Punzengruber C, Berent R. et al. // Heart Ves sels. - 2002. - Vol. 16. - P. 211-213.
8.Chandra H. R., RaffG., Fry J. et al. // J. Am. Coll. Car diol. - 2002. - Vol. 39, N 5. - Suppl. A. - P. 307A.
9.Davies M. J. // Circulation. - 1996. - Vol. 94, N 8. - P. 2013-2020.
10.Folk E. //Atherosclerosis. - 2000. - Vol. 151, N 1. — P. 88.
11.Forrester J. S., Shah P. K. //J. Thrombos. Thrombolys.
-1998. - Vol. 5. - P. S89-S97.
12.Fujimori Y., Morio H., Terasawa K. et al. // J. Am. Coll.
Cardiol. - 2002. - Vol. 39, N 5. - Suppl. A. -
P. 307A
13.Goldstein J. A., Demetriou D., Grines С L. et al. // N. Engl. J. Med. - 2000. - Vol. 343. - P. 915-922.
14.Lee S.-G., Lee С W., Hong M.-K. et al. // J. Am. Coll.
Cardiol. - 2002. - Vol. 39, N 5. - Suppl. A. -
P. 307A.
15.Libby P. /J Circulation. - 1995. - Vol. 91. - P. 28442850.
16.Mintz G S., Maehara A., Bui А. В., Weissman N. J. //
Am. J. Cardiol. - 2003. - Vol. 91. - P. 1333-1335.
17.Moreno P. R., Falk E., Palacios I. F. et al. // Circulation. - 1994. - Vol. 90. - P. 775-778.
18.Rioufol G, Finet G, Ginon I. et al. // Circulation. — 2002. - Vol. 106. - P. 804-808.
19.van der Wal A. C, Becker A. E., Chris M. et al. // Cir culation. - 1994. - Vol. 89. - P. 36-44.
20.Zaman A. G, Helft G, Worthley S. G, Badimon J. J. // Atherosclerosis. - 2000. - Vol. 149. - P. 251-266.
Поступила в редакцию 23.04.04
MAJOR TYPES OF UNSTABLE ATHEROSCLEROTIC PLAQUES AND THEIR DISTRIBUTION IN CORO NARY ARTERIES IN ACUTE MYOCARDIAL INFARC TION
T.P.Shlychkova, V.S.Zhdanov, Yu.A.Karpov, P.V.Chumachenko
A.L.Myasnikov Institute of Cardiology, 121552, Moscow
Summary — A pathomorphological investigation of unsta ble atherosclerotic plaques and their distribution in coronary arteries were studied on successive (5 mm) transverse sections of autopsy material from 60 patients with acute myocardial in farction (AMI). Two morphological types of such plaques were distinguished: lipid one (70%) and dystrophic-necrotic (30%). Unstable plaques in AMI are spread. Numerous unstable plaques were more frequently observed in AMI with preceding unstable angina pectoris but single plaques were found in cases with absence of coronary anamnesis. There were no significant age, sex and risk factor differences between cases with multiple and single atherosclerotic plaques.
Ark. Pathol., 2005, N. 3, P. 24-28.
28
© КОЛЛЕКТИВ АВТОРОВ, 2005
УДК618Л4-006.363-008.9-074-078.33
Ключевые слова: лейомиомы матки, морфогенез, ангиогенез.
О.В. Зайратьянц1, И. С. Сидорова2, С. А. Леваков2, Е. М. Левин3, К. В. Опаленов1
ОСОБЕННОСТИ МОРФОГЕНЕЗА И АНГИОГЕНЕЗА Л Е Й О М И О М МАТКИ
'Кафедра патологической анатомии (зав. — проф. О. В. Зайратьянц) МГМСУ, 127473, Москва; 2кафедра акушерства и гинекологии (зав. — член-корр. РАМН, проф. И. С. Сидорова) ФППО ММАим. И. М. Сеченова, 119881, Москва; -городская клиническая больница № 55 (главный врач О. Н. Румянцев), 113152, Москва
Лейомиомы матки — наиболее частые доброка чественные опухоли женского полового тракта [1, 5, 14]. По последнему пересмотру Международной гистологической классификации (2003 г.) выделя ют лейомиомы без дополнительных уточнений (простые, обычные лейомиомы, фибромиомы — шифр по МКБ-О 8890/0), гистологические вариан ты лейомиом — клеточный (8892/0), эпителиоидный (8891/0), миксоидный (8896/0), атипический (8893/0), липолейомиому (8890/0) и ряд других, бо лее редких, опухолей [14]. Однако такое деление лейомиом малоинформативно для выбора тактики лечения и прогноза этих доброкачественных опу холей, особенно в связи с широким внедрением в практику разнообразных консервативных и хирур гических органосберегающих методов. И. А. Яков левой и Б. Г. Кукутэ [6], О. К. Хмельницким [5] на основании особенностей роста лейомиом были вы делены группы истинно растущих (пролиферирующих) и малигнизирующихся ("с явлениями предсаркомы") лейомиом. И. С. Сидоровой, С. А. Леваковым и соавт. в 2000—2002 гг. было обосновано деление лейомиом на два клинико-морфологиче- ских типа: простые, отличающиеся медленным ростом, тенденцией к фиброзу и самопроизволь ной регрессии, и пролиферирующие, характери зующиеся быстрым ростом, частым сочетанием с гиперпластическими и неопластическими процес сами эндометрия, шейки матки и яичников [1,3, 4]. В основу морфологической диагностики пролиферирующего типа лейомиом была положена оцен ка числа и активности периваскулярных зон роста — участков пролиферации, детально описанных в 1970 г. В. В. Серовым и Л. Н. Василевской [2].
Несмотря на большое число опубликованных исследований, выделение группы пролиферирующих лейомиом остается спорным, так как до на стоящего времени многие стороны их пато- и мор фогенеза неясны, мало изучены особенности кле точной пролиферации, клеточно-стромального взаимодействия и ангиогенеза [1, 2, 11, 14]. Веду щую роль в регуляции этих процессов в лейомиомах отводят эстрогенам и прогестерону, а также различным факторам роста, которые, особенно инсулиноподобный фактор роста 1 (IGF-1), называют медиаторами действия эстрогенов в матке. В лейомиомах выявлена прямая корреляция между про дукцией IGF-1 и уровнем экспрессии Ki-67 опухо левыми миоцитами. Большое значение придают трансформирующему фактору роста (3, (TGFP!), который в миометрии и лейомиомах угнетает кле точную пролиферацию и активирует апоптоз, уси ливает продукцию фибронектина и коллагена, ингибирует ферментативную деградацию коллагена, влияет на ангиогенез [8—10, 12]. Ангиогенез в мио метрии и лейомиомах зависит прежде всего от
уровня продукции сосудисто-эндотелиального фактора роста (VEGF) [7, 8, 13].
С целью уточнения особенностей морфогенеза и ан гиогенеза лейомиом исследовали матки с обычными и клеточными лейомиомами (наблюдения с аденомиозом, с лейомиомами при беременности были исключены), удаленные в ходе хирургических вмешательств у 147 больных (возраст от 23 до 65 лет), из них 5 женщин с бы стро растущими лейомиомами матки были оперированы после проведения курса терапии препаратами — блокаторами гонадотропинов. Кусочки ткани миометрия и лейомиом по общепринятой методике заливали в пара фин, гистологические срезы окрашивали гематоксили ном и эозином, пикрофуксином по ван Гизону. Иммуногистохимическое исследование проводили по стан дартной методике с помощью двойных антител с пред варительной демаскировкой антигенов в микроволновой печи. Использовали серийные гистологические срезы и 7 различных антител — к Ki-67 (негистоновый ядерный белок — маркер пролиферативной активности), рецеп торам эстрогенов и прогестерона, CD31 (мембранный рецептор — маркер эндотелиоцитов), VEGF, TGFp,, фибронектину. В качестве вторичных антител применя ли биотинилированные кроличьи иммуноглобулины (все антитела и другие реагенты производства фирмы "Novocastra"). Позитивный контроль ставили с помощью гис тологических препаратов с известной положительной ре акцией указанных биомаркеров, негативный контроль — исключая первичные антитела. Результаты оценивали в баллах (по общепринятой схеме от 1 до 3) для VEGF, TGFP[ и фибронектина или подсчитывали процент ок рашенных клеточных ядер (Ki-67, рецепторы эстрогенов и прогестерона).
Результаты исследования показали, что, ис пользуя как объективный критерий наличие экс прессии ядрами миоцитов опухоли Ki-67, лейо миомы можно разделить, прежде всего по числу и активности периваскулярных зон роста, на две раз личные по морфо- и ангиогенезу группы: со слабой и выраженной пролиферативной активностью опу холевых миоцитов.
В неизмененном миометрии экспрессия Ki-67 выявлялась в единичных ядрах миоцитов (преиму щественно субмукозного слоя и локализованных периваскулярно), клеток стромы и стенок сосудов. Наряду с другими выявленными особенностями миометрия, такими, как относительно высокий (2 балла) уровень экспрессии VEGF в субмукозном и низкий (1 балл) в субсерозном слое, обратная за висимость экспрессии TGF(3,, накопление экстрацеллюлярного матрикса по направлению от субму козного к субсерозному слою, это подтверждает наличие структурно-функциональной гетероген ности слоев миометрия.
Лейомиомы со слабо выраженной пролифератив ной активностью (Iгруппа). В 95 (65%) лейомиомах экспрессия Ki-67 выявлялась в ядрах единичных миоцитов опухоли в периваскулярных зонах роста
29
и реже — в пучках опухолевых миоцитов (рис. 1, а, на вклейке); их количество было равно в среднем 1,0 ± 0,07% (но в 10 раз выше, чем в неизмененном миометрии).
Лейомиомы I группы (из них у женщин репро дуктивного возраста — 27%, в пременопаузе — 33%, в менопаузе — 40%) локализовались субсерозно или интрамурально, редко (13%) были множе ственными (в том числе в сочетании с лейомиомами с выраженной пролиферативной активностью) и гистологически были представлены обычными лейомиомами (фибромиомами). Они отличались единичными и малоактивными, преимущественно субкапсулярными и склерозированными периваскулярными зонами роста (рис. 1, б, на вклейке), относительно небольшими по размерам и мономорфными опухолевыми миоцитами, митозы практически не наблюдались. Строма опухоли не редко преобладала над паренхимой, часто была гиалинизирована, с очагами кальциноза.
Визуализация эндотелиоцитов с помощью вы явления их мембранного рецептора CD31 показа ла, что сосудистая сеть лейомиом была развита умеренно и неравномерно, а в очагах склероза и гиалиноза или она была редуцирована, или, наобо рот, отмечалось сближение сосудов в результате коллапса стромы. Стенки многих сосудов были склерозированы и гиалинизированы. Просвет со судов в центре зон роста при прогрессировании склероза нередко подвергался облитерации. Слабо выраженный неоангиогенез, как и немногочислен ные сосуды синусоидного типа, наблюдался пре имущественно вокруг зон роста, сохранивших свою активность (рис. 1, в, на вклейке).
Исследование рецепторов эстрогенов и прогес терона выявило, что, как и в неизмененном мио метрии, практически все ядра миоцитов лейомиом экспрессировали оба указанных рецептора (уро вень экспрессии 2—3 балла). Этот показатель не за висел ни от возраста больных, ни от других усло вий. Ядра других клеток, в частности эндотелиоци тов, рецепторов к эстрогенам или прогестерону не экспрессировали. Таким образом, влияние этих гормонов на процессы ангиогенеза непрямое и опосредовано, по-видимому, различными факто рами роста.
Изучение экспрессии VEGF и TGFp, в клетках, строме и стенках сосудов в лейомиомах I группы обнаружило минимальный уровень для первого фактора (1 балл, в сохранившихся периваскулярных зонах роста) и высокий (2—3 балла) для вто рого (рис. 1, г, д, на вклейке). Было характерно так же повышенное содержание фибронектина (2—3 балла), особенно в очагах склероза, в том числе зон роста (рис. 1, е, на вклейке). Это указывает на низ кий уровень неоангиогенеза и преобладание син тетической функции опухолевых миоцитов в лейо миомах этой группы.
Лейомиомы с выраженной пролиферативной ак тивностью (II группа). В 52 (35%) наблюдениях лейомиом количество ядер миоцитов, экспрессирующих Ki-67, было равно в среднем 5,0 ± 0,2%, достигая в клеточных лейомиомах 10% и более (в 5—10 раз больше, чем в лейомиомах I группы). Ло кализация миоцитов опухоли с положительной экспрессией Ki-67 не ограничивалась пределами периваскулярных зон роста (хотя их количество
там было максимальным), они постоянно выявля лись в составе пучков опухолевых миоцитов (рис. 2, а, на вклейке). В лейомиомах II группы в отли чие от опухолей I группы Ki-67 экспрессировали также и многие эндотелиоциты.
Лейомиомы II группы (из них у женщин в ре продуктивном периоде — 48%, в пременопаузе — 44%, в менопаузе — 8%) локализовались интраму рально или субмукозно, нередко (в 57% наблюде ний) были множественными, а гистологически представлены обычными лейомиомами с множест венными очагами пролиферации — активными зо нами роста (38 наблюдений) и клеточными лейо миомами [14]. Их общими гистологическими при знаками были множественные и активные периваскулярные зоны роста (рис. 2, б, на вклейке), в час ти наблюдений клеточных лейомиом миоматозный узел был представлен конгломератом таких зон. Опухолевые миоциты были умеренно полиморф ны, гипертрофированы, многие с крупными эл липсовидными гиперхромными ядрами, но митозы были единичными. Строма была развита слабо или умеренно, причем паренхима всегда преобладала над стромой опухоли.
Исследование экспрессии CD31 выявило в лей омиомах II группы в отличие от опухолей I группы хорошо развитую сосудистую сеть. Определялось множество сосудов разного калибра, неравномерно распределенных в опухолевом узле. Многие сосуды были синусоидного типа, причем локализованные не только рядом с центральными сосудами зон рос та, но и расположенные в толще пучков миоцитов (рис. 2, в, на вклейке). Лишь отдельные сосуды бы ли склерозированы. Характерно было сдавление сосудов крупными пучками опухолевых миоцитов, в результате чего по периферии активных зон роста просвет сосудов имел вид узких щелей (рис. 2, г, на вклейке).
Изучение экспрессии рецепторов эстрогенов и прогестерона не выявило отличий от лейомиом I группы, но она была особенно выражена (3 балла) в гипертрофированных ядрах опухолевых миоци тов клеточных лейомиом (рис. 2, д, на вклейке).
Лейомиомы II группы характеризовались слабо выраженной синтетической функцией опухолевых миоцитов и активностью процессов неоангиогене за. Экспрессия VEGF была выражена в стенках со судов, в опухолевых миоцитах и строме, особенно в зонах роста (2—3 балла), a TGFp,, напротив, практически не обнаруживался. Известно, что низ кая выработка TGFp, сочетается с повышенной продукцией других факторов роста и рецепторов к ним, что сопровождается активной клеточной про лиферацией. Фибронектин выявлялся в неболь шом количестве (1—2 балла), за исключением его накопления в очагах склероза.
У 5 больных с быстро растущими лейомиомами, прошедших до операции курс лечения препарата ми — блокаторами гонадотропинов, были выявле ны клеточные лейомиомы, которые в целом соот ветствовали критериям опухолей с выраженной пролиферативной активностью, но отличались перифокальным концентрическим склерозом множе ственных периваскулярных зон роста (рис. 2, е, на вклейке), а иммуноморфологически — признаками трансформации в лейомиомы со слабо выражен ной пролиферативной активностью. Это демонст-
30
