
posobie
.pdf
Определяющее влияние на свойства наноразмерных катализаторов оказывает, как известно, размер частиц. Первичный размерный эффект в катализе, т.е. зависимость каталитической активности или селективности от размера кластера, определяется, помимо возрастания площади поверхности частиц с повышением дисперсности, двумя важнейшими факторами. Первый – зависимость энергетических параметров наночастиц от их размера, второй же связан со структурными изменениями поверхности кластеров: различной кривизной поверхности, выходом на поверхность элементов разных кристаллографических граней, ребер, вершин, наличием дефектов.
Химическая активность обычного гетерогенного катализатора пропорциональна eгo удельной поверхности, что обеспечивает наночастицам хорошую перспективу использования в качестве эффективных катализаторов. Удельная поверхность обычно указывается в единицах м2 на г (табл. 7.1). Формулы для расчета удельной поверхности представлены ниже.
rде а, d и L выражены в нанометрах, а плотность ρ – в г/cм3.
Таблица 7.1
Зависимость удельной поверхности от размера частиц
Размер, нм |
Удельная поверхность, |
м2/г |
|
4 |
281 |
6 |
187 |
10 |
112 |
20 |
57 |
30 |
38 |
40 |
29 |
60 |
19 |
100 |
11 |
200 |
6 |
Значительная доля атомов в наночастицах находится на поверхности. Многие свойства материалов, состоящих из зерен микро- и в особенности нанометровых размеров сильно зависят от их удельной поверхности. Например, можно ожидать, что плотность слабосвязанного гранулированного материала будет определяться контактной площадью отдельных зерен.
81

Однако из этого вовсе не следует, что каталитическая активность обязательно пропорциональна площади поверхности в диапазоне размеров наночастиц (рис. 7.2.).
Рис. 7.2. Зависимость скорости диссоциации монооксида углерода. Кластеры Rh, характеризующиеся различным количеством атомов Rh в агрегате, осаждали на пленках Al2O3. Rh покрывался CO до насыщения, после чего материал нагревали. Количество атомарного углерода – мера скорости диссоциации для каждого размера кластера (островка)
Следующий рисунок (рис. 7.3) показывает, что активность или количество циклов в единицу времени реакции гидрогенизации циклогексена в циклогексан, нормированная на концентрацию атомов Rh на поверхности, уменьшается с увеличением размеров частиц от 1.5 до 3.5 нм, а затем перестает от нее зависеть.
Рис. 7.3. Площадь поверхности наночастиц
Использование наночастиц металла для создания новых катализаторов привлекает пристальное внимание исследователей. Горение метана на воздухе стабильно при температуре более 1300 °С. Однако при этих темпера-
82
турах выделяются вредные оксиды азота. Актуален поиск новых катализаторов. Можно осуществлять процесс при 400 °С. Для этого использовали обратные эмульсии на основе изооктана, воды и ПАВ (продукты полиэтиленоксида со спиртами). Соли Ba(OC3H7)2 и Al(OC3H7)3 растворяли в изооктане и смешивали с микроэмульсией. Получался твердый кристалл наноразмерного гексаалюмината Ba, проявляющий каталитические свойства.
В водных буферных микроэмульсиях осуществлен ряд реакций, катализируемых наночастицами Pd. Реакция N,N-диметил-п-фенилендиамина с Со(NH3)5Cl2+. Лимитирующая стадия связана с адсорбцией органических соединений на частицах Pd d = 2.5 нм, находящихся внутри микроэмульсий. Энергия активации снижается от 97 кДж/моль при 15 °С до 39 кДж/моль при 40 °С.
Каталитическое окисление СО применяется для очистки воздуха, в технологии топливных элементов, основанных на использовании углеводородов. Обнаружена высокая каталитическая активность наночастиц Au, d ≈ 4 нм, нанесенных на оксид марганца. Имеет место частичный перенос заряда от центра на кластер Au. Для оксида Ti он составляет 0.15 заряда электрона. Изменения дефектных мест в TiO2 на границе между кластерами Au и ТiO2 определяют электронные и каталитические свойства частиц золота, изменяют активность TiO2, облегчая миграцию вакансий кислорода.
Фотокаталитическое восстановление бис(2-дипиридил)дисульфида (RSSR) в 2-меркаптопиридин (RSH) водой происходит селективно на поверхности TiO2:
2RS..TiO2 (e− ) + 2H+ Kt →2RSH+TiO2 .
Скорость процесса значительно увеличивается при нанесении наночастиц Ag (0.24 масс. %) размером менее 1 нм.
|
|
|
|
|
|
|
|
|
|
|
|
|
Ka |
|
|
|
−TiO2 |
, |
|
|
|
|
|
|
(1) |
|||||
|
|
RS −SR + Ag −TiO2 ← →2RS − Ag |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Iϕ |
|
|
|
|
|
− Ag −TiO2 (e |
− |
h |
+ |
), |
|
|
|
|
|
(2) |
|||||
|
|
2RS − Ag −TiO2 →2RS |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
2RS − Ag −TiO2 (e |
|
h |
|
) →2RS − Ag −TiO2 , |
|
|
|
|
|
(3) |
||||||||||||||||||
|
|
|
|
|
|
|
|
− |
|
|
+ |
|
|
|
kd1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2RS − Ag −TiO2 (e |
− |
h |
+ |
|
kcs |
|
|
|
2RS − Ag(e |
− |
)−TiO2 (h |
+ |
), |
|
|
(4) |
||||||||||||||
|
|
) → |
|
|
|
|
||||||||||||||||||||||||
|
|
2RS − Ag(e |
− |
)−TiO2 (h |
+ |
|
|
|
|
kd 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(5) |
|||||
|
|
|
|
) →2RS − Ag −TiO2 , |
|
|
|
|
|
|||||||||||||||||||||
2RS − Ag(e |
− |
)−TiO2 (h |
+ |
)+ H2O |
k0 |
|
|
|
|
|
− |
)−TiO2 |
+ 2H |
+ |
+ |
1 |
O2 |
, (6) |
||||||||||||
|
|
→2RS − Ag(e |
|
|
2 |
|||||||||||||||||||||||||
|
|
2RS − Ag(e |
− |
)−TiO2 + 2H |
+ |
|
kr |
|
|
|
|
|
|
|
|
|
|
|
|
|
(7) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
→2RSH + Ag −TiO2 |
|
|
|
|
||||||||||||||||||||||
где Ka – константа равновесия адсорбции, I – интенсивность света, φ – интенсивностьпоглощенногосвета, k – константаскоростисоответствующихстадий.
На стадии (1) селективная адсорбция RSSH на поверхности наночастиц серебра сопровождается разрывом связи S–S. На стадии (2) при возбуждении наночастиц в области запрещенной зоны TiO2 генерируется пара (е-) –
83
дырка (h+). Большинство электронно-дырочных пар рекомбинируют ((3), (5)). На стадии (4) происходит разделение зарядов. Наночастицы серебра присоединяют е-, дырки переходят на подложку TiO2. Положительный потенциал дырки достаточен для окисления воды и образования H+ и O2 (6). На стадии (7) каталитическая система восстанавливается и образуется RSH. Нанесенные наночастицы серебра вызывают:
–ускорение адсорбции RSSR;
–пространственное разделение позиций, на которых происходит вос-
становление частиц серебра, окисление подложки TiO2, т. е. эффект разделения зарядов.
–селективную адсорбцию окисляемого соединения (Н2О) в местах окисления и восстановления, обуславливающую высокую селективность процесса.
Энергия активации от присоединения Ag не изменяется, в результате чего предполагается, что лимитирующей является не фотокатализируемая стадия, а стадия (6).
Тиолы используются в агрохимии, нефтехимии, фармацевтике и для стабилизации наночастиц металлов.
В последние годы в катализе начали активно применять полупроводниковые наночастицы (оксиды, сульфиды) в полярных (ацетонитрил) органических растворителях, например, в реакции фотоокисления пентахлорфенола – токсичного соединения, используемого в качестве фунгицида, для консервации древесины. Важно отметить экстремально сильную зависи-
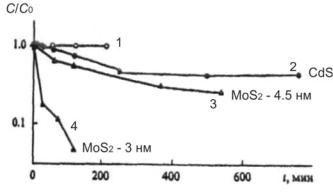
мость скорости реакции от размера частиц в случае с MoS2, которая в свою очередь отражает влияние ширины запрещенной зоны частицы и связана с соответствующим изменением потенциала восстановления (рис. 7.4).
Рис. 7.4. Изменение относительной концентрации (с) пентахлорфенола в воде в зависимости от времени облучения светом длиной волны 400 < λ < 700 нм: 1 – в отсутствии и 2–4 в присутствии катализаторов: 2 – порошок CdS (0.1 мг · мл1), 3 – частицы MoS2 диаметром 4.5 нм (0.036 мг · мл–1), 4 – частицы MoS2 диаметром 3 нм (0.09 мг · мл–1)
Широкое применение в катализе нашли пористые углеродные материалы. Пористые углеродные материалы могут использоваться как носители ка-
84
тализаторов из благородных металлов в реакциях гидрирования органических соединений, которые обычно осуществляются в жидких средах. Преимущество углеродных носителей предопределяется их относительно высокой химической стойкостью и высокой удельной площадью поверхности.
Нанесение на углеволокно катализаторов позволяет создавать каталитические системы с развитой поверхностью. Углеволокнистые катализаторы применяются в высокотемпературных процессах неорганического и органического синтеза для окисления содержащихся в газах примесей: СО до СО2, SO2 до SO3. Фуллерены имеют перспективы применения в катализе, при этом возможны три варианта их использования: в качестве активных компонентов, в гомогенном катализе в качестве лигандов, как носителей в гетерогенном катализе. Большое количество различных нанотрубок с уникальными свойствами и широкие возможности их модифицирования являются потенциальной основой создания принципиально нового поколения материалов.
Удалось разместить фрагменты графена в порах титаносиликатного цеолита (TS-1). Цеолиты представляют собой большую группу близких по составу и свойствам минералов, из подкласса каркасных силикатов. Отличительной чертой цеолитов является их пористое строение и высокое значение площади поверхности. Это свойство делает цеолиты идеальными кандидатами для создания каталитических систем. Внедрение титана в каркас цеолита придает цеолитам новое свойство – фотокаталитическую активность. Удалось провести гибридизацию графена с цеолитом, при этом полученная гибридная система характеризуется беспрецедентным увеличением фотокаталитической активности.
Предложен достаточно простой способ синтеза железоплатиновых наночастиц на поверхности графена (G/FePt) для дальнейшего их использования в качестве катализатора. Сама методика заключается в следующем: авторы смешивали диспергированные в гексане FePt наночастицы с растворенным в диметилформамиде (ДМФА) графеном и воздействовали на данную смесь ультразвуком, после чего добавляли этанол и центрифугировали полученную суспензию для выделения продукта G/FePt, который затем очищали от поверхностно активных веществ обработкой в уксусной кислоте. Диагностику синтезированных образцов проводили при помощи просвечивающей электронной микроскопии и рентгеновской дифракции. Исследователи показали, что полученные таким образом G/FePt наночастицы обладают высокой каталитической активностью и прекрасной стабильностью в случае реакции восстановления кислорода в растворе HClO4 по сравнению
с обычными катализаторами на основе наноструктурированной платины. Таким образом, графен является многообещающим материалом для решений задач прикладного катализа.
Среди многочисленных примеров, описывающих, как особенности свойств поверхности углеродных материалов могут быть использованы для
85
конструирования катализаторов, отметим два, полученных в исследованиях российских ученых. Первый пример демонстрирует важность учета гидро- фобно-гидрофильных взаимодействий. В этом отношении базальная грань микрокристалла пористого углеродного материала более гидрофобна, чем его боковая грань с кислородсодержащими группировками. Если молекулярный предшественник наносимого компонента является полимером, можно, во-первых, изменяя гидрофильные свойства полимера (вводя в его состав ионогенные группы) и, во-вторых, изменяя соотношение площадей гидрофобной и гидрофильной частей поверхности углеродного материала, целенаправленно создавать необходимую для проведения реакции «архитектуру» катализатора.
Так, при получении важнейших катализаторов гидрирования «палладий на угле» одной из стадий является синтез так называемого предшественника [Pd(OH)2]n /C, где [Pd(OH)2]n – полигидроксокомплекс палладия – линейный полимер, построенный из молекул Pd(OH)2. Поскольку этот полимер является частицей, имеющей гидрофильные свойства, он сорбируется преимущественно на участках углеродной поверхности, также проявляющей гидрофильные свойства, то есть на боковых гранях кристаллов, где сосредоточены гидроксильные и карбоксильные группировки. Следовательно, меняя концентрацию гидрофильных группировок на поверхности угля (например, окисляя её) или вводя в состав ионы щелочных металлов, можно широко варьировать энергию гидрофильных взаимодействий и таким образом влиять на каталитические свойства системы.
Второй пример демонстрирует возможность реализации на поверхности углерода эффектов «матричной активации реагента». Создавая углерод, поверхность которого будет «испещрена» большим количеством плоских щелеобразных пор размером ~ 0.35 нм, можно ставить задачи не только фильтрации плоских молекул ароматических соединений из углеводородного «супа», но и их селективного превращения. Эта идея реализуется для борьбы с хлорароматическими соединениями, опасными загрязнителями окружающей среды, источниками диоксинов.
7.2. Вторичный размерный эффект
При достижении определенного среднего расстояния между наночастицами или при определенной поверхностной плотности частиц осуществляется межкластерный перенос заряда. На рис. 7.5 представлены три предельных случая заполнения поверхности носителя наночастицами металла.
В первом – поверхностная концентрация частиц мала, частицы изолированы. Межкластерный перенос заряда невозможен, наночастицы «не чувствуют» друг друга и действуют независимо. Единственный путь возникновения зарядов в данном случае – перенос заряда между кластером и под-
86
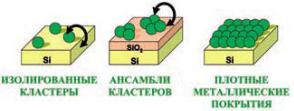
ложкой. Это становится возможным в случае проводящей подложки, например полупроводниковой, как в случае кремния.
Начиная с какой-то поверхностной плотности, на носителе возникают группы (ансамбли) наночастиц, в которых становится возможным перераспределение зарядов под действием тепловых флуктуаций. В этот момент следует ожидать сильного роста каталитической активности независимо от направления переноса заряда в лимитирующей стадии процесса, т.к. при межкластерном переносе заряженные частицы образуются парами, и в любом случае будет происходить активация катализатора.
Наконец, в третьем случае, когда на поверхности достигается высокая плотность частиц (степень заполнения поверхности близка к 100% или возникают многослойные покрытия), между ними возникает эффективный контакт, и электропроводность приближается к металлической. В этом случае происходит делокализация заряда. Здесь следует ожидать падения активности. Фактически речь идет о своеобразном размерном эффекте, который можно назвать, в отличие от обычного размерного эффекта, размерным эффектом второго рода (вторичный размерный эффект). Этот эффект должен проявляться при соблюдении следующих условий: размер частиц должен быть оптимальным и соответствовать нескольким нм; величина межгранульного зазора должна соответствовать расстоянию туннельного переноса электрона, т.е. в реальных условиях составлять около 1 нм; степень заполнения поверхности должна быть ниже 100%, ансамбли частиц отделены друг от друга промежутками; подложка является диэлектриком; реакция чувствительна к зарядовому состоянию катализатора. Ниже приведены экспериментальные и теоретические доказательства существования подобного размерного эффекта.
Рис. 7.5. Схема процессов переноса заряда между кластерами и носителем [Ростовщикова Т.Н., Смирнов В.В., Кожевин В.М., Явсин Д.А., Гуревич С.А. Межкластерные взаимодействия в катализе наноразмерными частицами // Российские нанотехнологии, 2007. Т. 2, № 1–2. С. 47–60]
На рис. 7.6 на примере изомеризации хлоролефинов приведена типичная зависимость каталитической активности нанокомпозита меди от содержания металла в полимере. Максимум активности наблюдается в области резкого скачка проводимости пленки, когда в узкой области концентраций металла происходит переход от типичного диэлектрика к полупроводнику. Средняя величина межчастичного зазора в катализаторах оптимального состава с максимальной каталитической активностью составляет 1–2 нм, т. е.
87

допускает возможность туннельного переноса электрона между нанокластерами металла. Эти данные позволили впервые предположить важную роль процессов перераспределения зарядов между наночастицами в формировании особых каталитических свойств ансамбля.
Рис. 7.6. Зависимости каталитической активности нанокомпозитов медь – полипараксилилен в изомеризации 3,4-дихлорбутена-1 в транс-1.4-дихлорбутен-2 при 100 °С и их удельного сопротивления от содержания меди (объемные %) [Ростовщикова Т.Н., Смирнов В.В., Кожевин В.М., Явсин Д.А., Гуревич С.А. Межкластерные взаимодействия в катализе наноразмерными частицами //
Российские нанотехнологии, 2007. Т. 2, № 1–2. С. 47–60]
Сильный размерный эффект наблюдается при окислении CO в СО2 в смеси СО : СО2 = 1 : 5 над нанесенными кластерами Au/TiO2 (рис. 7.7). Это связывают с переходом частиц, проявляющих неметаллические свойства, к частицам с металлическими свойствами. Наибольшая активность проявляется при 2.8–3.2 нм.
Рис. 7.7. Зависимость активности частиц золота, осажденных на TiO2 путем вакуумной конденсации (1) и химическим методом (2), от их размеров [Шабатина Т.И., Масцетти Д., Огден Д, Сергеев Г.Б. Криохимические конкурентные реакции атомов, кластеров и наноразмерных частиц переходных металлов // Успехи химии, 2007. Т. 76, № 12. С. 1202–1218]
88
Катализ относится к поверхностным явлениям, поэтому эффективные катализаторы должны иметь большую площадь поверхности, что предполагает малый размер активных частиц. Основными характеристиками при этом являются дисперсность частиц, то есть доля поверхностных атомов в частицах, и удельная поверхность, то есть поверхность, приходящаяся на единицу массы. Малые металлические частицы часто являются неустойчивыми, склонными к спеканию, в частности, при температурах, отвечающих типичным каталитическим реакциям. По этой причине большинство твердотельных катализаторов, используемых в промышленности, представляют собой частицы, распределенные в порах инертных носителей. Материалом носителей обычно служат кремнезем, оксиды алюминия, титана, магния, цинка, циркония, а также активированный уголь. Морфология частиц опять же определяется поверхностной энергией как частиц самих по себе, так и носителя.
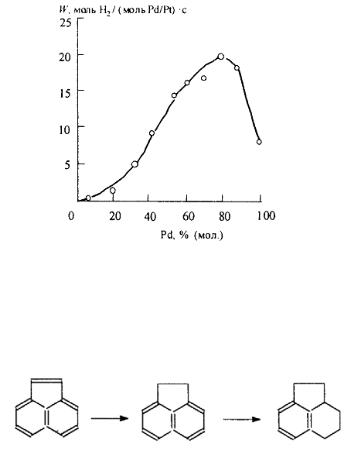
Для гидрирования высших олефинов используют полимериммобилизованные наноразмерные частицы Pt, закрепленные на сополимере стирола с дивинилбензолом, модифицированном иминодиацетатной кислотой (рис. 7.8). Приготовление катализатора включало дополнительную иммобилизацию в набухших матрицах Al3+, Mg2+ или Na+, затем обработку водным раствором H2PtCl6 с последующим восстановлением LiBH4. Размер частиц d = 2.6 нм.
Рис. 7.8. Начальная скорость гидрирования W 1,3-циклооктадиена (25 ммоль) при 30 °С как функция полимер-иммобилизованного Pd/Pt-биметаллического кластера (0.01 ммоль), приготовленного в атмосфере N2
Частично используют Pd/Pt НЧ в гидрировании двойных и тройных связей:
89
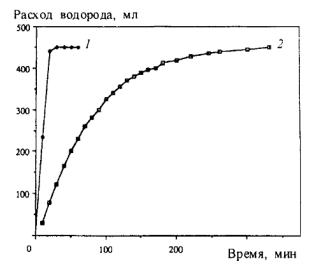
Процесс гидрирования аценафтилена полимерстабилизированным Pd (получаемым испарением Pd на охлажденные полимерные матрицы, d ≈ 3–1 нм) представлен на рис. 7.9:
Рис. 7.9. Зависимость расхода водорода от времени гидрирования аценафтилена (20 ммоль) 0.31 ммоль полимерстабилизированного коллоида Pd (1) и Pd/C (2)
(50 мл метилциклогексана; 25 °С; 0,1 МПа H2)
Разработанные методы управления размером частиц Ag были использованы для изучения катализируемого Ag восстановления паранитрофенола борогидридом натрия при 283-333 К. НЧ Ag размером 4 и 18 нм стабилизированы полиакриловой кислотой. Наблюдаемые величины скорости реакции, отнесенные к единичной поверхности катализатора, порядок реакции по катализатору и энергии активации реакций зависят от размера частиц Ag.
90
