
posobie
.pdfгде N1, Nj – концентрация мономера и j-мерных кластеров (см-1), j = 2, 3, …∞, kj – константа скорости роста (см3/с),
k'j – константа скорости диссоциации j-мерного кластера (с-1).
5.2.3. Кинетика фазообразования с участием твердых тел
Процесс фазообразования:
1)лимитируется скоростью химического превращения (реакция диссоциации, полимеризационные превращения);
2)лимитируется диффузией. К ним относится большинство твердофазных процессов, протекающих при достаточной толщине диффузионного слоя реакции на частицах какого-либо реагента;
3)лимитируется испарением. Скорость таких реакций зависит от упругости пара и размера частиц. Процессы образования шпинелей, альдегидов.
Для твердофазных реакций, протекающих без участия газообразных фаз,
вчастности, реакций термического разложения, особенностью является локализация процесса в пределах реакционной зоны между исходным твердым веществом и продуктами реакции. Скорость реакции прямо пропорциональна величине реакционной зоны в каждый момент времени. В свою очередь последняя зависит от числа зародышей и поверхности каждого из них.
Если число зародышей постоянно, скорость реакции растет до тех пор, пока зародыши не станут перекрываться, после чего реакционная поверхность начнет уменьшаться, и скорость реакции падает.
Обозначим через х – количество прореагировавшего вещества, а – начальное количество вещества, S – реакционную поверхность каждого зародыша. Скорость реакции в начальный период равна
dx |
= k' S . |
(5.46) |
dt |
|
|
Но S имеет размерность площади [L]2, а объем реагирующего вещества прямо пропорционален массе, имеет размерность [L]3. Следовательно, реакционная поверхность каждого зародыша при постоянстве их числа прямо
пропорциональна массе в степени 2/3. |
|
dx = kx2/ 3 , |
(5.47) |
dt |
|
x = const · t3, |
(5.48) |
S = const · t2. |
(5.49) |
Таким образом, для начального периода скорость прямо пропорциональна массе в степени 2/3, общее количество прореагировавшего вещества – кубу времени, а величина поверхности зародышей – квадрату времени. Начиная с момента, когда зародыши начнут перекрываться, скорость реакции будет определяться массой непрореагировавшего вещества.
61
dx |
2/ 3 |
|
|
dt |
= k(a – x) |
, |
(5.50) |
kt = a1/ 3 – (a – x)1/ 3 , |
(5.51) |
||
x = a – (a1/ 3 – kt)3 . |
(5.52) |
||
Последнее уравнение справедливо для реакций разложения KMnO4, углекислых солей серебра, Zn, Cu, в которых реакция возникает по всей поверхности. Это наблюдается не везде. Если скорость образования зародышей новой фазы относительно невелика, то зародыши новой фазы образуются в объеме исходной фазы. Если их число постоянно, то общая поверхность реакционной зоны будет расти пропорционально квадрату времени по закону
|
S = kN0t2 , |
|
|
(5.53) |
|
где N0 – число зародышей. |
|
|
|
время t, |
|
Обозначим через α |
долю прореагировавшего вещества за |
||||
(1 – α) – доля оставшегося исходного вещества. |
|
|
|
||
d α |
= – d(1 – α ) = k' S(1 – α )= k(1 – α)N0t2 . |
(5.54) |
|||
dt |
dt |
|
|
|
|
После интегрирования при t = 0, α = 0: |
|
|
|
|
|
|
α= 1 – e– kt3 |
, |
t3 |
|
(5.55) |
|
−ln(1 – α ) = N |
k |
. |
(5.56) |
|
|
3 |
||||
|
0 |
|
|
|
|
Если число зародышей переменно, но скорость их роста постоянна, то |
|||||
|
N = k'tm , |
|
|
|
(5.57) |
− d(1 – α) = k" Nt2 (1 – α)= ktm+2(1 – α ) . |
(5.58) |
||||
dt |
|
|
|
|
|
При t = 0, α = 0: |
α= 1 – e– ktn , |
|
|
|
|
где n = m+3, n ≥ 3. |
|
|
|
(5.59) |
|
|
|
|
|
|
|
Если k мало, то |
α =1 – e– ktn ≈ ktn . |
|
|
||
|
|
(5.60) |
|||
Последнее уравнение имеет такой же вид, что и уравнение диффузионной кинетики, но с другим численным значением n. Если имеет место бесконечная или полубесконечная диффузия вещества, которая носит необратимый характер, то количество прореагировавшего вещества растет по па-
раболическому закону |
|
α = kt1/ 2 . |
(5.61) |
При стационарной диффузии количество вещества Q, прошедшее через поверхность раздела (т.е. прореагировавшего) за время t, равно
62
Q = ∫t |
D |
c1 – c2 |
= dt = const t , |
|
(5.62) |
δ |
|
||||
0 |
|
α = kt . |
|
(5.63) |
|
|
|
1 |
|||
Таким образом, при диффузионной кинетике n меняется от |
≤ n ≤1. |
||||
|
|
|
|
2 |
|
Если нельзя считать диффузию бесконечной или полубесконечной (или стационарной), то n не остается постоянной в ходе процесса.
5.2.4. Скорость кластерообразования в матрицах
Кинетика процесса кластерообразования с участием лигандов L описывается последовательностью необратимых бимолекулярных реакций и серией линейных уравнений:
Me + L k1 →MeL
MeL + L k2 →MeL2 MeL2 + Me k3 →Me2L2
− − − − − − − − − − − − − −
Mej−1 + Me kn →MejL2
Скорость кластерообразования может быть представлена как непрерывное отложение атомов металла на пленке полимера во времени t со ско-
ростью v: |
|
|
|
|
|
|
|
|
|||
|
|
d [Me] |
p |
|
|
|
(5.64) |
||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
dt |
|
|
= ν − ∑km [Me] Mej L2 |
, |
|
||||
|
|
|
|
j=0 |
|
|
|
|
|
||
|
d [Men L2 ] |
= km [Me]([Men-1L2 ]- [Men L2 ]). |
(5.65) |
||||||||
|
dt |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||
Концентрация кластерных центров различной нуклеарности описыва- |
|||||||||||
ется выражением |
|
|
|
|
|
|
|
|
|||
|
[Men L2 ] |
|
|
n-1 |
2n-1 |
n-1 |
|
|
|||
|
[MeL2 ] |
= [Me0 ] |
|
= k [Me0 ] |
, |
(5.66) |
|||||
|
n![L0 ]n-1 |
||||||||||
где Me0 – общая масса атомов Ме, отложенных на полимерных пленках за время t, п – нуклеарность кластера.
Наклон кривых, изображенных на рис. 5.6, дает значение n – 1, т. е. позволяет определить нуклеарность кластеров MeL2 формирующихся под действием аргона (лиганда – матрицы).
63

Рис. 5.6. Линейные кинетические кривые для определения нуклеарности кластеров, формирующихся из моноядерных Ar2 – Mo центров
Нанокластеры металлов и оксидов металлов малого размера обладают способностью к динамике движения атомов внутри кластеров и самих кластеров. Матрицы полимерных или активных углей включают нанопоры, в которых как в нанореакторе могут происходить химические реакции, приводящие к образованию нанокластеров. Скорость таких реакций возрастает по сравнению со скоростью в макроскопическом пространстве, а размер кластера регулируется размерами нанопоры подобно нуклеации кластеров в обратной мицелле. Простая нуклеация сопровождается образованием критического минимального размера кластера:
r = |
32 a3 |
, |
(5.67) |
|
3ρ2Δμ3 |
||||
min |
|
|
где a – плотность поверхностной энергии кластера, ρ – плотность кластера, Δμ – изменение химического потенциала при образовании кластера. Максимальный размер кластера в нанопоре
μ |
|
rmax ≈ n0 2+ Δμ |
(5.68) |
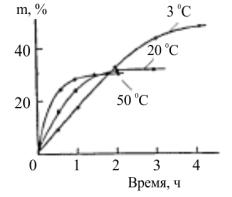
определяется количеством атомов в нанопоре n0, из которых образуется кластер, т.е. должен увеличиваться с увеличением размера нанопоры. В то же время минимальный критический размер зародыша в поре определяется термодинамикой нуклеации и исходной концентрацией атомов кластера в пространстве, что с ростом размера поры приводит к образованию нескольких кластеров меньшего размера в одной поре. Скорость нуклеации в нанопоре возрастает из-за понижения потенциального барьера нуклеации G вследствие влияния стенки поры (фактор гетерогенности k << 1) согласно уравнению
64
G = |
16πα3 k |
. |
(5.69) |
||
3ρ2 |
Δμ2 |
||||
|
|
|
|||
Таким образом, в пористых материалах с размерами пор до 10 нм могут образовываться изолированные нанокластеры с размерами от одного до нескольких нанометров в зависимости от размера пор и исходной концентрации.
Рассмотрим пример движения кластера как целого в нанопоре сульфосмолы (рис. 5.7). Топохимия металлических смол вдоль поперечного сечения полимерной матрицы определяется шириной реакционной области, в свою очередь зависящую от коэффициента диффузии D и константы скорости химической реакции k. При D << k скорость отложения металлических частиц лимитируется скоростью диффузии, и ширина реакционной области минимальна, тогда как при D >> k ситуация прямо противоположная: реакционная область распространяется на все поперечное сечение полимерной пленки.
Поскольку с повышением температуры константа скорости k возрастает значительно быстрее, чем коэффициент диффузии D, с ростом Т процесс переходит в диффузионную область, что сопровождается уменьшением размера металлического слоя.
Рис. 5.7. Зависимость массовой концентрации НЧ в полимере от времени
итемпературы восстановления
5.2.5.Фрактальные самоорганизующиеся структуры
Происходящая в природе агрегация кластеров приводит к возникновению нового типа кластеров, самоорганизующихся наноструктур под названием фрактальные кластеры (рыхлая ветвистая структура, кластеры жестко соединены между собой). Основное свойство фрактального кластера связано с уменьшением средней плотности вещества в объеме, ограниченном кластером. Такой агрегат представляет собой объединение первичных кластеров, включающих N атомов, которые образуют рыхлую надмолекулярную структуру. Под фрактальным кластером подразумевается агрегат с минимальным размером составляющей частицы (кластера) r0 и максимальным
65
размером rфр, характеризующим размер самого фрактального кластера, и обладающий свойством самоподобия (масштабной инвариантностью).
|
r |
D |
|
||
N (r) ~ |
|
, |
(5.70) |
||
|
|||||
r0 |
|
|
|
||
где N(r) — число частиц в объеме с линейным размером r (r0 ≤ r ≤ rфр), D – фрактальная размерность. Фрактальная размерность представляет собой показатель несовершенства системы.
6. НАНОТЕРМОДИНАМИКА И НАНОКИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
6.1. Термодинамика химических реакций с участием НЧ
В наночастицах значительное число атомов находится на поверхности, и доля их растет с уменьшением r. Соответственно увеличивается и вклад поверхностных атомов в энергию кристалла.
Влияние размерного фактора на сдвиг химического равновесия. Ис-
ходные вещества − Аi, продукты – Вj. Равновесие: |
|
|
|
||||||
|
∑νi Ai = ∑ν j Bj |
, |
|
|
(6.1) |
||||
|
i |
|
|
j |
|
|
|
|
|
|
− G0 = kT ln K , |
|
|
(6.2) |
|||||
|
G0 = ∑ν |
G0 |
|
− ∑ν |
G0 |
= G0 |
−G0 , |
(6.3) |
|
|
|
j B |
j |
i |
А |
|
f |
in |
|
|
|
|
|
i |
|
|
|
||
Здесь G0 , H 0 |
G0 = |
H 0 −T |
S0 . |
|
|
(6.4) |
|||
и S0 – стандартные энергия Гиббса, энтальпия и эн- |
|||||||||
тропия, К – константа равновесия. |
|
|
|
|
|
|
|
||
В справочниках |
H 0 и S0 приводятся только для массивной фазы. |
||||||||
Оказалось, что размер частицы является активной термодинамической переменной, определяющей состояние системы. Это обстоятельство можно использовать для реакций, равновесие которых смещено в сторону исход-
ных продуктов. В этом случае, если полная свободная энергия Gin0 исходного реагента меньше G0f , то G0 > 0 и процесс не идет (рис. 6.1).
Рис. 6.1. Изменение изобарного потенциала
66
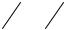
Участие наночастиц может изменить ситуацию. Значение потенциала Гиббса дисперсного реагента отличается от стандартных значений массивной фазы. При диспергировании реагента i изменение энергии Гиббса можно записать согласно (5.29) в виде
δG |
= |
2 |
|
A |
|
σi Si − kT (c |
|
−c |
)= |
|
A |
|
|
2σi |
− kT (c |
− c |
), (6.5) |
|
3 |
N |
|
|
ρ |
N |
|
r |
|||||||||||
i |
|
|
A |
|
ρV |
r |
∞ |
|
A |
r |
∞ |
|
||||||
|
|
|
|
|
|
i i |
|
|
|
i |
|
i |
|
|
|
|||
где σ – поверхностное натяжение, S – площадь поверхности, Vi – объем дисперсной частицы, ρi – плотность, cr = c∞ exp(2σ r V kT ) − относительное
число вакансий на атом, r – радиус частицы, V – изменение объема при замене атома в узле решетки вакансий, с∞ − концентрация вакансий в массиве,
А– атомная масса, NA – число Авогадро.
Вуравнении (6.5) первое согласное отражает вклад поверхностной энергии, второе – вакансий. Если конечный продукт диспергирован, то потенциал Гиббса также сдвигается согласно (6.5).
Изменения изобарного потенциала G = Gf −Gin для реакции (6.1) с
участием дисперсных реагентов |
|
|
G = G0 + ∑ν jδGi − ∑νiδGi , |
(6.6) |
|
j |
i |
|
где суммирование идет по дисперсным реагентам. Реакция возможна, если Gin превышает Gf, т.е. G < 0, как это показано на рис. 6.1.
Подставим (6.5) в (6.6), а затем (6.6) в (6.2):
|
∞ |
|
2 |
|
|
|
σ A |
σ j |
Aj |
|
|
i |
i |
j |
j |
|
|
||
K = K |
|
exp |
|
|
|
∑νi |
i |
i −∑ν j |
|
|
|
|
− |
∑νi (cr |
− c∞ )− ∑ν j (cr |
− cr |
) |
. (6.7) |
|
|
kTN |
|
ρ |
r |
|
||||||||||||||
|
|
|
А |
|
i |
ρ r |
j |
j |
|
|
i |
|
j |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Здесь K ∞ – константа равновесия массивного образца, определяемая по (6.2). ri характеризует размерный эффект. Оценка δGi для частиц r < 100
нм приводит к 0.1–1.0 эВ/атом. Полученные величины означают, что диспергирование может инициировать химические реакции с таким барьером.
Установление связи между количеством участвующих в реакции атомов и качественными химическими изменениями – основная задача нанохимии. Размер, форма и организация частиц металла в нанометровом диапазоне непосредственно влияют на химическую активность систем, стабильность и свойства получаемых материалов, возможность их применения в нанотехнологии.
Пример. Вследствие резкого уменьшения потенциала при переходе от больших к малым частицам металла возрастает разность потенциалов между кислородной и металлической парами (табл. 6.1), что способствует более полному окислению наночастиц кислородом.
67
Таблица 6.1
Разность равновесных потенциалов кислородной и металлической пары для различного размера частиц металла
Ион- |
|
|
0 |
− EMe , В |
|
металлическая |
E0 , В |
|
E = EO2 |
|
|
пара |
Me |
r = ∞ |
100 нм |
10 нм |
1 нм |
|
|||||
Cu2+/Cu |
0.337 |
0.893 |
0.894 |
0.906 |
1.023 |
Bi3+/Bi |
0.320 |
0.910 |
0.911 |
0.916 |
0.970 |
Ag+/Ag |
0.799 |
0.434 |
0.434 |
0.461 |
0.731 |
Для осуществления химических реакций при низких температурах необходима подвижность стабилизированных в конденсате активных частиц. В процессе нагревания осуществлен ряд новых необычных химических реакций атомов различных металлов со специально вводимыми в низкотемпературные конденсаты химическими соединениями. Подобные превращения в общем виде можно описать следующей схемой:
Направление 1 отражает процесс агрегации атомов металлов и образование димеров, тримеров и наночастиц; 2 – взаимодействие атомов с лигандами L и последующее получение комплексов или металлорганических соединений.
6.2. Кинетика кластерных реакций
Важное свойство НЧ: для мелких кластеров все атомы, составляющие НЧ, находятся на ее поверхности, что оказывает сильное влияние на колебательные уровни, стабильность и реакционную способность. Некоторые наночастицы, например, алюминия, имеют высокую реакционную способность. Если бы можно было поместить в воздухе изолированную наночастицу алюминия, она немедленно окислилась бы кислородом воздуха и покрылась слоем Al2O3. Al80 образует слой Al2O3 толщиной 3–5 нм.
Заполненные электронные оболочки кластера должны соответствовать их наибольшей стабильности и энергии ионизации.
68
Свободный электронный газ в форме s2p1 обеспечивает Al хорошую металлическую проводимость. Замкнутые оболочки образуются при 20, 40, 56, 70, 97, 138 и 198 электронах. Кластеры Al7, Al13, Al14 более стабильны, чем соседи. При взаимодействии кластеров алюминия с молекулами H2 и О2 активационный барьер реакции для кластеров малых размеров больше, чем для массивного материала. Для нейтральных кластеров продукты реакции возникают в виде AlnO2, причем отдельные атомы или димеры алюминия реагируют быстро, а далее с увеличением размера происходит вначале уменьшение, а затем увеличение реакционной способности. Для положительно заряженных кластеров Al с n < 7 основной продукт AlnO+. Для более крупных кластеров:
Al+n + O2 → Al+n−4 + 2Al2O
Al+n + O2 → Al+n−5 + 2Al2O + Al
Эти реакции обладают активационным барьером в десятые доли эВ для кластеров с n = 5–25, в то время как массивный алюминий легко окисляется, т.е. кластеры менее реакционноспособны, чем массивный металл. Кластер Ag17 обладает замкнутой 18-электронной оболочкой с низшей незанятой 2s- орбиталью. Нейтральный кластер Ag18 имеет замкнутые оболочки, включающие 18 электронов.
Различия получены при сравнении нанесенных НЧ и массивного Auобразца: активность меняется более чем на два порядка. Наиболее стабильные и наименее реакционноспособные высокосимметричные (обладающие осью симметрии 5-го порядка) кластеры Au с магическими числами атомов 13, 55, 147 и т.д. Так, кластер Au55 (d = 1.4 нм) не подвергается окислению под воздействием кислорода плазмы, тогда как кластер меньшего размера (< 1 нм) в этих условиях окисляется.
Интересны примеры реакций присоединения водорода с резкой зависимостью скорости от размера кластеров металла (рис. 1.15). Наблюдаются осцилляции в зависимости от числа атомов в кластере. Для Fe6, Fe7, Fe8, а также Fe15, Fe16, Fe17 минимальны скорость реакции и энергия ионизации. Исследования показывают, что продукты реакции содержат только четные числа Н. Молекулы водорода диссоциативно хемосорбируются на поверхности фольги из железа или кристалла. Подобное поведение следует ожидать и для малых кластеров. Константа скорости реакции Н2 с кластером Fen (n > 25 атомов) значительно больше, чем для кластеров меньших размеров, но слабо меняется при дальнейшем росте размера кластера. Поведение кластеров Fen (n > 25), по-видимому, уже подобно массивному металлу, по крайней мере, с точки зрения вовлечения локальных связей, обусловленных диссоциативной хемосорбцией.
Для химической реакции нужна адсорбция реагентов на поверхности НЧ. Такая реакция не может рассматриваться как процесс в бесконечном объеме с постоянной средней плотностью (концентрацией) молекул. Это связано с тем,
69

что размер поверхности наночастиц мал и сопоставим с размерами частиц реагентов. В подобных системах кинетика бимолекулярных реакций является кинетикой в ограниченном объеме и отличается от классической.
Классическая кинетика не учитывает флуктуации концентрации реагирующих веществ. Наночастицам, содержащим небольшое число взаимодействующих молекул, свойственны относительно большие колебания в числе реагентов. Это обстоятельство приводит к несовпадению изменений концентрации реагентов во времени на поверхности различных по размерам наночастиц. Отсюда их разная, зависящая от размера частицы реакционная способность.
Общий кинетический закон для макроскопического образца может быть получен усреднением кинетики по всем НЧ. Описание процессов в подобных системах основано на использовании стохастического подхода. Этот подход вместо концентрации учитывает число молекул реагентов, которое является случайной величиной и определяется статистическими флуктуациями в числе реагирующих частиц.
Реакции с участием малого числа молекул обычно являются диффузи- онно-контролируемыми. Анализ подобных реакций проводят в предположении, что они могут быть охарактеризованы константой скорости, одинаковой для всех пар реагентов. На основе этих предположений был проведен анализ кинетики реакций на поверхности. Для реакции A + A → C кинетика гибели реагентов описывается уравнением
|
|
|
∞ |
|
|
|
|
|
|
|
N(t) |
|
1 |
|
|
|
|
||
|
|
|
|
|
|||||
|
|
|
= ∑Bn exp - |
2 |
n(n- 1)kt |
|
, |
(6.10) |
|
N(0) |
n=1 |
|
|
|
|
|
|||
где n – число атомов в НЧ, N(t) и N(0) – соответственно текущая и началь-
ная концентрации реагентов на поверхности НЧ, средние по образцу, содержащему макроскопическое число НЧ; Вn – сложная функция. При получении уравнения использовано предложение о равенстве константы скорости реакции k для всех пар реагентов. Это применимо только в случае НЧ, размер которых как минимум на порядок превосходит размер реагентов.
Большинство кластерных реакций начинается после возникновения возбужденного кластерного состояния под действием того или иного источника энергии. Запишем уравнение реакции при образовании первоначального аддукта А:
|
→ |
* |
|
|
kn |
Mn A |
|
Mn + A ← |
(6.11) |
||
|
k−n |
. |
|
|
|
|
|
* |
ksn |
|
|
Mn A |
+ He →Mn A |
|
|
Скорости соответствующих реакций равны
70
