
posobie
.pdf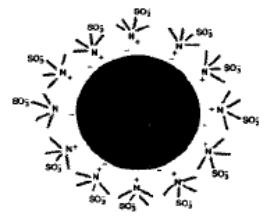
3.2. Макромолекулы как стабилизаторы НЧ
Для осуществления химических реакций необходима подвижность стабилизированных в конденсате активных частиц. В принципе, матричная изоляция и химические превращения – взаимоисключающие процессы. В растворах НЧ в отсутствие стабилизаторов представляют собой типичные лиофобные коллоиды, характеризующиеся низкой устойчивостью, особенно в неполярных органических средах. Зарядовой стабилизации явно недостаточно. Поэтому для повышения их устойчивости применяют самые раз-
нообразные вещества. К концу углеводородной цепочки NR+4 -иона прикрепляют SO3− группу, что делает её гидрофильной. Это конкретное металл-
стабилизированное гидрофильное соединение называется сульфобетаин
(рис. 3.1).
Рис. 3.1. Металлическая коллоидная частица, стабилизированная молекулами сульфобетаина, родственными NR4X, но с группой SO3− на конце одной
из алкиловых цепей R
Наибольшее значение как стабилизаторы имеют высокомолекулярные соединения (ВМС). Такая стабилизация получила название стерической. НЧ будут окружены предохранительным барьером, представляющим собой сплошной слой сольватированных полимерных цепей достаточных размеров. Ядро лиофобное, наружный слой лиофилен.
Важно, чтобы полимер не только содержал полярные группы, но и чтобы эти группы вступали во взаимодействие с поверхностными атомами Ме, например, играли роль доноров электронов. Полимерные цепи могут образовывать ковалентные, ионные или координационные связи с частицами дисперсной фазы (с атомами поверхностного слоя Ме). Введение в полимер разнообразных функциональных групп приводит к возрастанию роли кислотно-основных взаимодействий. Такие центры действуют одновременно по механизму зарядовой и стерической стабилизации (рис. 3.2).
31
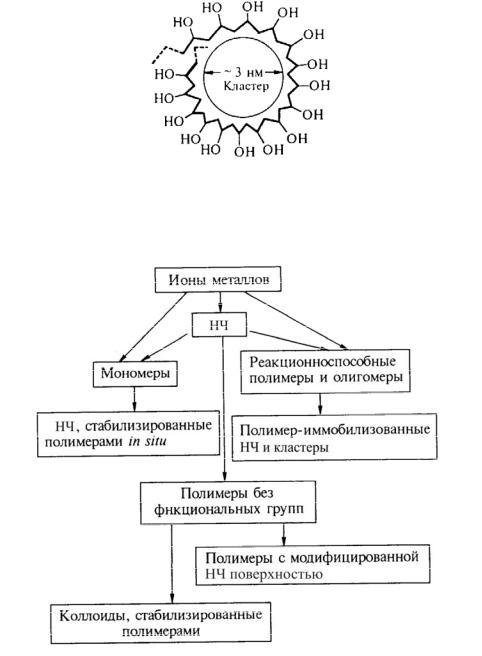
Рис. 3.2. Комплексы «включения», состоящие из ПВС (поливиниловый спирт) и Fe(OH)3-подобных кластеров
Происходит стабилизация частиц, включающих до 120 атомов железа. Общая картина образования НЧ в полимерах представлена на рис. 3.3.
Рис. 3.3. Общая схема образования НЧ в полимерах
Основные методы получения наночастиц в полимерах могут быть разделены на три группы: физические, физико-химические и химические. К физическим методам, базирующимся на отсутствии химического взаимодействия между дисперсной фазой и дисперсионной средой, следует отнести смешение НЧ с полимерами и олигомерами. К физико-химическим методам можно отнести образование новой фазы упариванием растворителя, экстракционное замещение. Если есть взаимодействие между компонентами, речь идет о химических методах.
НЧ, полученные в полимерах при термическом разложении прекурсо-
ров. При нагревании легколетучие металлообразующие предшественники
32

(прекурсоры) в органических средах и газовой фазе разлагаются с выделением металлов или оксидов в виде дисперсной фазы:
Fe(CO)5 → Fe2 (CO)9 → Fe3 (CO)12 → Fen .
Осуществление этих реакций в присутствии полимеров – самый распространенный метод введения больших количеств коллоидных частиц металлов в полимерные композиции.
Восстановление ионов металла в растворах полимеров. Механизм вос-
становительных процессов ионов металла, химически связанных с полимером, довольно сложен и детально выяснен лишь для формирования кластеров нульвалентных металлов Pd, Ru, Rh, Ag, Os, Ir, Pt, Au, Ni. При кипячении солей этих металлов в протонодонорных растворителях в присутствии полимеров (в частности, RhCl3 в смеси метанол–вода–ПВС) происходит следующая цепь химических реакций:
На первой стадии RhCl3 координируется с гидроксильными группами ПВС, затем образуется оксониевый продукт, который через алкоксид превращается в полимерсвязанный гидридный комплекс. Осуществление этих реакций необходимо для образования гомогенного коллоида, возникающего за счет диспропорционирования гидридов родия с последующим ростом частиц:
Восстановление НЧ в блок-сополимерах. Ядра блок-сополимерных ми-
целл могут служить своеобразным нанореактором для синтеза в них НЧ, которые одновременно стабилизируются неполярными блоками этих амфифильных блок-сополимеров (короной) (рис. 3.4).
Рис. 3.4. Получение блок-сополимера и формирование НЧ в нем
33
Ионы восстанавливаемого металла предварительно образуют макрокомплекс со звеньями ядра мицеллы с последующим восстановлением ионов металла и формированием НЧ.
3.3. Нанокомпозиты (НК)
Под композитами понимают гетерофазные материалы, состоящие из двух и более химически разнородных компонентов с четкой границей раздела между ними; доля каждого из компонентов не должна быть ниже 1– 5 %; свойства отдельных компонентов и композита в целом должны быть различны. Непрерывная фаза, которая имеет более высокую долю по объему материала, рассматривается в качестве матрицы.
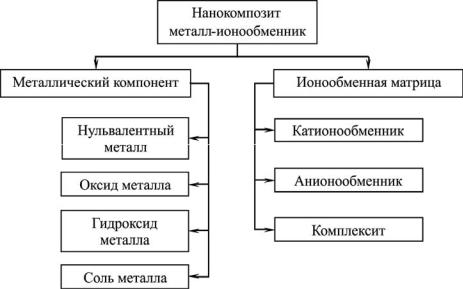
Нанокомпозиты содержат частицы компонентов и реакционные пространства нанометровых размеров. К нанокомпозитам металл-ионообменник относят материалы, состоящие из нанопористой полимерной матрицы, способной к ионному обмену с раствором за счет наличия фиксированных ионогенных центров, и дисперсного металлического компонента, распределенного по ее объему или поверхности. Металл может быть в виде высокодисперсных частиц (как правило, наночастицы) в нульвалентном состоянии или входить в состав оксидов, малорастворимых гидроксидов, простых и комплексообразующих солей, закрепленных в полимерной матрице (рис. 3.5). Матрица может обладать катионо-, анионообменными или комплексообразующими свойствами. Наличие противоионов, локализованных возле электрически заряженных фиксированных групп, обеспечивает композитам металл-ионообменник ионную проводимость. Металлический компонент, а также матрица с сопряженными связями, могут обеспечить композиту электронную проводимость.
Рис. 3.5. Компоненты нанокомпозита металл-ионообменник
Химическое осаждение металлов в ионообменные матрицы происходит по механизму ионообменного насыщения и реагентного восстановле-
34
ния. Ионообменная матрица обладает селективной проницаемостью по отношению к противоионам определенного знака заряда. Концентрация противоионов в ионообменнике выше, чем в растворе, а коионов (ионы раствора, одноименно заряженные с матрицей) меньше.
Один из наиболее распространенных способов синтеза нанокомпозитов металл-ионообменник состоит в последовательном насыщении ионообменника противоионами осаждаемого металла, его восстановлении и переведении полученного композита в исходную ионную форму
|
zR–SO3- H+ +Mez+ → (R–SO3- )zMez+ +zH+ , |
(3.1) |
||
(R–SO- ) |
Mez+ +Red, zNaOH →[R–SO- |
Na+ ] Meo +Ox+zOH- , |
(3.2) |
|
3 z |
|
3 |
z |
|
[R–SO- Na+ ] Meo +zH+ →[R–SO- H+ ] Meo +zNa+. |
(3.3) |
|||
|
3 |
z |
3 z |
|
Здесь R – полимерная матрица, −SO3− |
– ионогенный центр, z – заряд |
|||
ионов металла, Red, Ox – восстановленная и окисленная формы восстановителя, Мео – металл (Ag, Cu, Bi и др.). Многократное повторение цикла (1)–
(3) позволяет получить нанокомпозит с высоким содержанием равномерно распределенных частиц металла общей формулой [R −SO3−H+ ]z Meon , где
n – число атомов металла в расчете на z моль ионообменника.
Синтез наночастиц может осуществляться как в пористых ионообменниках (гранулы, мембраны, волокна), так и в дендримерных оболочках. В пористых матрицах частицы занимают, как правило, микро-, мезоили макропоры, что и определяет их конечный размер. Примером могут служить синтезированныенанопроволокиоксидовметалловв цеолитнойматрице(рис. 3.6).
1
2
3
Рис. 3.6. Схема синтеза нанокомпозита, состоящего из цеолитной матрицы и нанопроволок металлического компонента: 1 – исходная матрица; 2 – матрица, пропитанная раствором прекурсора (соль металла);
3 – нанопроволоки металлического компонента
[Kustov A.L., Kessler V.G., Romanovsky B.V. et al. Supported Re and Mo oxides prepared using binuclear precursors: synthesis and characterization // J. Molecular Catal. A: Chemical., 2004. Vol. 216. P. 101–106]
Частицы серебра и сульфида серебра получены в нанопорах перфторированной ионообменной мембраны. Палладийсодержащий композит создан на основе сульфокатионообменных волокон. Имеются работы по синтезу наночастиц серебра в пористых стеклах. В ионообменные полимерные
35
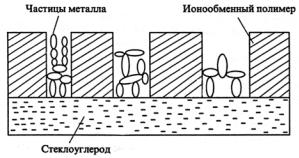
пленки, нанесенные на электродные материалы, электроосаждают металл для получения электрокатализаторов. Формирование частиц металла начинается от подложки, и дальнейший их рост происходит от частицы к частице с сохранением контакта между ними (рис. 3.7).
Рис. 3.7. Схема процесса накопления частиц металла в полимерной ионообменной пленке, сформированной на стеклоуглероде [Подловченко Б.И., Андреев В.Н. Электрокатализ на модифицированных полимерами электродах // Успехи химии. 2002. Т. 71, № 10. С. 950–965]
С использованием ионообменных полимерных матриц в виде пленок можно получать ультрадисперсные осадки металлов с диаметром кристаллитов 3–5 нм с большими удельными поверхностями.
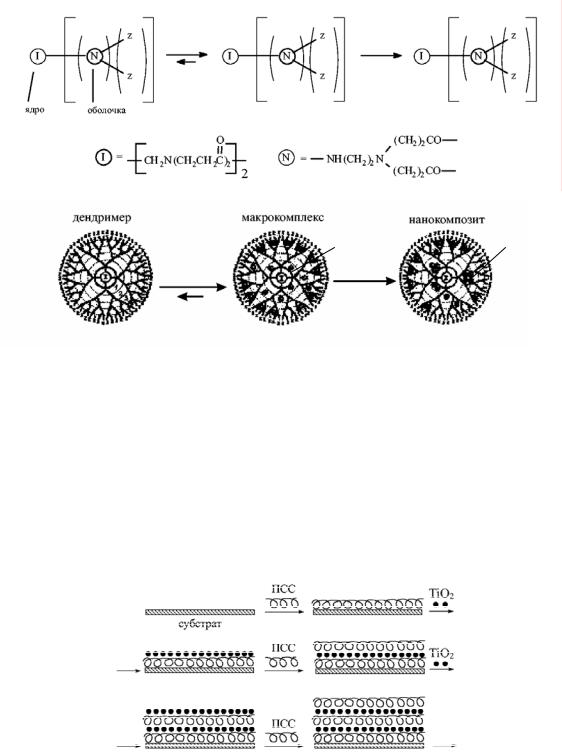
Естественными нанореакторами для синтеза наночастиц металлов являются некоторые дендримеры – полимеры с сильно разветвленной древовидной структурой, исходящей из центрального ядра, не имеющие замкнутых циклов. Их размеры изменяются в пределах от 2 до 15 нм. Внутри дендримеров имеются полости, в которых способны стабилизироваться молекулы и частицы нанометрового размера. Например, в дендримерах с концевыми амино- и карбоксилатными группами фотохимическим методом синтезированы частицы серебра размером 7 нм. Образование наночастиц происходит по следующему механизму
+ |
- |
hν |
o |
+[дендример]-COO |
• |
→ |
Ag |
+[дендример]-COO |
→Ag |
|
|||
|
→ Ago +[дендример]+CO2 |
|
(3.4) |
|||
Ag+ +[дендример]-NH2 hν→ Ago +[дендример]-NH+2•
Синтезированы композиты на основе дендримеров, содержащие наночастицы меди размером 2–4 нм и стабилизированные в полиамидоимине (рис. 3.8), наночастицы золота в полимере с тиольными или карбоксильными группами, наночастицы платины в дендримере на основе полиакрилового эфира. Получен композит, состоящий из наночастиц полистирола с последовательно адсорбированными полистиролсульфонатом и комплексом ионов железа (II), каждый слой которого содержит несколько тысяч ионов металла. Микроструктура самоорганизующихся нанокомпозитов на основе дендримеров определяется наличием ван-дер-ваальсовых, слабых водородных или гидрофильно-гидрофобных взаимодействий. В самоорганизован-
36
ные полимолекулярные слои вводят различные металлокомплексы и наночастицы. Методы послойного синтеза нанокомпозитов на основе самоорганизованных слоев (layer-by-layer) в последнее время получили широкое распространение.
(3.5)
Cu2+ |
Cuo |
Рис. 3.8. Стадии формирования дендримерного нанокомпозита (на примере полиамидоимина и Cu2+): I – инициатор, z – концевые группы [Помогайло А.Д. Металлополимерные нанокомпозиты с контролируемой молекулярной архитектурой // Рос. хим. журн. 2002. Т. 46, № 5. С. 64–73]
Еще одним типом нанокомпозитов металл-полимер с особенной архитектурой являются материалы на основе пленок Ленгмюра-Блоджетт. Размеры элементов в этих двумерных пленках не превышают 2–10 нм (рис. 3.9). Для получения регулярных ансамблей самоорганизованных слоев типа мультислоев используют электростатические взаимодействия между заряженными наночастицами и заряженными монослоями поверхности.
Рис. 3.9. Схема послойного синтеза композита TiO2/полистиролсульфонат
(ПСС) [Liu Y., Wang A., Claus R. Molecular Self-Assembly of TiO2/Polymer Nanocomposite Films // J. Phys. Chem. B. 1997. Vol. 101, № 8. Р. 1385–1388]
37
Области применения нанокомпозитов металлионообменник. Интерес к НК металл-ионообменник вызван высокой активностью дисперсных частиц металлического компонента в каталитических, электрокаталитических и сорбционных процессах (рис. 3.10). Помимо того, что матрица является носителем металлических частиц, она выполняет транспортную функцию и используется как реактор для осуществления химических превращений.
Нанокомпозиты металл-ионообменник
Катализ |
|
Электрокатализ |
|
Сорбция |
|
|
|
|
|
Рис. 3.10. Области применения композитов металл-ионообменник
Катализ. Нанокомпозиты металл-ионообменник применяются в качестве высокоэффективных катализаторов. Иммобилизация наночастиц металлов в ионообменные матрицы приводит к созданию бифункциональных катализаторов, то есть имеющих центры двух типов – металлические и кислотные. Так, при риформинге бензинов гидрирование и дегидрирование протекают на активных центрах металла, а изомеризация и циклизация – на кислотных центрах. Общую схему превращений углеводородов на бифункциональных катализаторах представляют следующим образом
(3.6)
Металлизацией цеолитов получено большое число каталитически активных композитов металл-ионообменник (Ir-, Pd-, Pt-, Ni-, Fe-, Ag-, Cu-, Znсодержащие цеолиты). Эти материалы обладают высокой термической стойкостью. Например, при гидрогенолизе бутана используют иридийсодержащий цеолит типа NaX. Для гидрирования нитросоединений были созданы катализаторы на основе палладия и органических сульфокатионообменников. Оксиды меди и железа в полимерных матрицах применяют, в частности, для окисления фенолов, содержащихся в сточных водах. Катализаторы на основе ионообменных волокон проявляют высокую активность в окислении водорода. Для каталитического восстановления кислорода из воды
O2 +2H2 |
→2H2O. |
(3.7) |
|
Pdo -мембрана |
|
созданы и применены палладийсодержащие волокнистые мембраны. Фирмой «Байер АГ» выпускаются палладийсодержащие катализаторы Lewatit,
38
использующиеся в установках для глубокого удаления растворенного в воде кислорода. С этой целью через воду пропускается водород, а затем данная смесь проходит через слой композитного катализатора. Реакция происходит на внешней поверхности палладиевых кластеров по следующей схеме
H2 + Pdо → Pdо + 2H• |
|
2H• + •O–O• → 2HO–OH. |
(3.8) |
2H• + 2HO–OH → 2H2O.
Металлсодержащие катализаторы (W, Mo, Fe, Co, Ni, Pt, Pd, Rh) на волокнистых носителях на основе природных неорганических матриц (асбест, диатомит, алюмосиликаты) и искусственно синтезированных (нитриды, карбиды титана, циркония, кремния, фосфат алюминия, силициды, стекла) используют при температурах до 600 оС и давлениях порядка 106 Па в реакциях селективного восстановления оксидов азота, очистки газов от СО и формальдегида, окислительной очистки выхлопных газов и др.
Композиты, состоящие из металла, его оксида или гидроксида, нанесенных на матрицу, относят к типу нанесенных катализаторов. Активный компонент вступает в химическое или сорбционное взаимодействие с матрицей. При этом изменяются свойства металла: размер частиц, их структура, заряжение, химическая связь с матрицей, их распределение на матрице. Для структурночувствительных каталитических реакций известна закономерность снижения активности катализатора при уменьшении размера частиц. Например, при уменьшении размеров кристаллов Pt, нанесенной на SiO2, каталитическая активность в окислении спиртов или разложении H2O2 снижается на два порядка. Причиной этого полагают уменьшение количества плоских участков поверхности в дисперсной платине, содержащих активный центр из нескольких атомов. Однако в катализе на нанесенных металлах наблюдается и противоположный эффект – рост каталитической активности при уменьшении размера частиц, что объясняют заряжением малых частиц металла. Например, рост скорости гидрогенолиза неопентана на кислотном катализаторе палладийсодержащем цеолите Pd/HY в расчете на один активный центр связывают с образованием PdH+. Помимо этого, в ряде систем возможно образование новых активных центров на границе металл/носитель. Так, считают, что при гидрировании связи С=О в карбонильных соединениях на катализаторах типа Pt/WO3, Pt/TiO2, Ru/ZrO2 молекула ориентирована углеродным концом к металлу, а кислородным концом к кислотному центру Льюиса на оксиде. Вследствие этого скорость реакции пропорциональна длине границы металл-оксид.
Электрокатализ. Многочисленны работы по созданию и исследованию нанокомпозитов металл-ионообменник как электрокаталитических материалов. Исследуемыми реакциями являются электроокисление водорода, метанола, этиленгликоля, СО, электровосстановление кислорода и другие, имеющие важное прикладное значение. Одним из наиболее исследованных
39
стадийных процессов является электровосстановление кислорода. Восстановление кислорода в кислых и щелочных растворах на многих металлах протекает через стадию образования пероксида водорода. Вследствие этого суммарный процесс можно представить в виде двухэлектронных стадий
кислая среда: O2 |
→H2O2 →2H2O |
|
(3.9) |
|||||
|
+2H+ +2e- |
|
+2H+ +2e- |
|
|
|
||
щелочная среда: O2 →OH |
+HO2 |
→4OH |
- |
. |
||||
|
+H |
O+2e- |
- |
- |
+H |
O+2e- |
|
|
|
2 |
|
|
|
2 |
|
|
|
Пероксид водорода может не только восстанавливаться электрохимическим путем, но и разлагаться каталитически под действием материала электрода
2H2O2 |
→ O2 |
+2H2O |
. |
(3.10) |
|
2HO-2 → O2 +2OH- |
|||||
|
|
||||
Возможен и другой путь суммарного процесса без образования пероксида водорода
O2 → 2Oадс
Oадс+2H+ +2e- → H2O . |
(3.11) |
Oадс+H2O+2e- → 2OH- |
|
Трудности установления механизма электровосстановления кислорода связаны еще и с тем, что на многих металлах эта реакция протекает с образованием фазовых или адсорбционных оксидных слоев, свойства которых зависят от потенциала, подготовки электрода и других факторов.
Многие активные электрокатализаторы являются наноструктурированными, имеющими периодическую неоднородность на поверхности и в объеме. Наноструктуры лишь в редких случаях равновесны, значительно чаще они метастабильны, но сохраняются в течение длительного времени. Были сделаны неоднократные попытки описать активность малых металлических частиц в рамках аддитивности вкладов базисных граней в идеально равновесном кристалле. Основной причиной различия модельных и экспериментальных зависимостей является неравновесность малых частиц реальных катализаторов и сложность оценки реальных размеров частиц катализатора. Наиболее достоверные результаты получены для гладких углеродных матриц с малыми степенями заполнения катализатором. Но в этих системах до сих пор не удается полно и адекватно описать взаимодействие малых частиц с матрицей, что необходимо для прогнозирования эффективной работы катализаторов.
Перспективной основой для создания композитных электрокатализаторов являются перфторированные сульфокатионообменные мембраны, обладающие механической и термической стабильностью, высокой протонной проводимостью. В тонкопленочных электродах растворенный кислород диффундирует через пленку полимера, которая покрывает каталитическую
40
