
posobie
.pdfповерхность электрода. Пленка Nafion, покрывающая поверхность электрода, не изменяет механизм реакции электровосстановления молекулярного кислорода, однако при увеличении толщины пленки происходит снижение величины предельного тока, то есть электрохимический процесс протекает
вгидрофильных каналах нафионовой мембраны, которая является в данном случае простым диффузионным барьером. Высокая концентрация ионов Н+
вкомпозите нанодисперсная медь (20–200 нм) – мембрана Nafion приводит
к уменьшению перенапряжения восстановления молекулярного кислорода и протеканию реакции с участием ионов Н+. Уменьшение размера частиц металла, введенного в пленку Nafion, может приводить к возрастанию количества образующегося пероксида водорода.
Сорбция. Ионообменные матрицы, модифицированные солями, оксидами или гидроксидами металлов, перспективны в их использовании в процессах обработки природных и сточных вод, жидких радиоактивных отходов и различных растворов. К типичным представителям оксидов с ионообменными свойствами относятся природные неорганические сорбенты – цеолиты. Структурной основой этих соединений являются чередующиеся
слои SiO2, AlO4 или AlO6. Общую формулу таких соединений можно представить в виде Mex/z[(AlO2)x(SiO2)y] · mH2O. Здесь Mez+ – катионы щелочных или щелочно-земельных металлов или протонов, часть которых способна обмениваться с катионами окружающего раствора. Поэтому природные сложные оксиды используют для извлечения из растворов тяжелых элементов (например, цезия, тория, урана). Неорганические сорбенты могут быть и специально синтезированы. Так, в работах Е. Бойчиновой исследована сорбция различных веществ (свинец (II), ионы переходных металлов, пероксид водорода и др.) неорганическими сорбентами на основе циркония (IV) – молибдатами, вольфраматами, ванадатами, фосфатами.
Модификацию сорбентов неорганическими реагентами проводят преимущественно путем сорбции или осаждения гидроксидов металлов, оксидов или солей металлов. Например, композиционные сорбенты, полученные нанесением гидроксидов титана (IV) и циркония (IV) на активированный уголь БАУ, избирательно поглощают фосфат- и фторид-ионы. Платинированные активные угли проявляют высокую поглотительную способность в отношении ионов висмута (III), свинца (II) и олова (IV). Гидратированные оксиды многозарядных металлов (алюминия, титана, циркония, железа) в ионообменниках применяют и для сорбции кислородсодержащих анионов (фосфат-, арсенат-, силикат-ионы). Введением гидратированных оксидов поливалентных металлов в активные ионообменные мембраны синтезируют композитные материалы, которые имеют не только большую механическую прочность, чем исходная мембрана, но и повышенную селективность сорбции. Гидроксид железа (III) нашел широкое применение для концентрирования элементов в аналитической химии и в качестве неорганического ио-
41
нообменника для очистки сточных вод промышленных предприятий от мышьяка, хрома, радиоактивных изотопов, различных катионов металлов (палладия, кобальта, цинка) и вредных веществ. Ионный обмен на гидроксиде железа объясняется диссоциацией этого соединения по реакции
OH- +FeO+ → FeOOH → FeOO- +H+ |
|
|
(кислая среда) |
(щелочная среда) . |
(3.12) |
Последовательным проведением циклов насыщения – осаждения извлекают из растворов и концентрируют в ионообменных матрицах гидроксиды металлов или нульвалентные металлы, получая высокоемкие композиты. Получены медьсодержащие силикагели и алюмогели, гранулированные или иммобилизованные на носителях гидроксиды магния, марганца и др. Использование этих материалов оказалось наиболее целесообразным для сорбционного извлечения ионов металлов из природных и промышленных вод, а также удаления сероводорода и сульфид-ионов, мышьяка и других вредных примесей из промышленных газов и вод.
Примером солесодержащих ионообменников, способных извлекать радиоактивные элементы из вод, являются сорбенты на основе гексацианоферрата (II) калия, нанесенного на цеолит; иодидов олова (IV), цинка (II), алюминия (III), нанесенных на активированный уголь. Для концентрирования ионов тяжелых металлов используют аморфный фосфат кальция в пористом носителе. Нанесение карбоната калия или оксидов металлов на активные угли позволяет эффективно удалять диоксид углерода и другие кислые газы.
Наконец, сорбция может завершаться химическим взаимодействием сорбируемого вещества с функциональными центрами сорбента. С помощью ферроцианидного сорбента извлекают и одновременно восстанавливают до металлического состояния ионы Pd2+ по схеме:
(N |
H ) |
Ni |
FeII (CN) |
+Pd2+ →(N |
H |
) |
0.40 |
Ni |
FeIII (CN) |
6 |
Pdo +N |
2 |
+5H+ . (3.13) |
|
2 |
5 |
1.40 |
1.30 |
6 |
2 |
5 |
|
1.30 |
|
|
|
|||
Здесь процесс сорбции сопровождается окислительно-восстанови- тельной реакцией. Если металл в композите может изменять свою степень окисления, то помимо сорбционной функции, подобные композиты могут проявлять и редокс-функцию. В таком случае они проявляют химическую активность, или реакционную способность.
Особенно высокоактивны нанокомпозиты металл-ионообменник в отношении молекулярного кислорода. Сорбция кислорода пористым полимерным материалом завершатся редокс-реакцией кислорода с нанодисперсным металлом. Например,
4 R-SO3- H+ z Meon +zO2 → 4 (R-SO3- )zMez+ Meon-1 +2zH2O . (3.14)
42
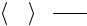
4. ФИЗИКО-ХИМИЧЕСКАЯ ЭВОЛЮЦИЯ НАНОРАЗМЕРНЫХ СИСТЕМ
4.1. Общая картина эволюционного процесса
Параметры состояния вещества. Под частицей вещества подразумевается совокупность достаточно большого количества атомов, связанных друг с другом столь сильно, что они могут длительно перемещаться в пространстве как единое целое с сохранением формы и рельефа поверхности. Полной характеристикой каждой частицы является совокупность параметров состояния всех составляющих ее атомов. Для описания поведения частицы прибегают к допущению, что большинство параметров состояния каждой частицы, усредненных во времени, однозначно связано со средними параметрами состояния атомов частицы.
Параметры состояния Xi каждой частицы целесообразно разделить на внешние X1i и внутренние X2i:
Xi = X1i + X2i , |
(4.1) |
X1i = M, Xi, υsi, ℓi, hi , |
(4.2) |
X2i = συi, σsi, ηei, νυi, νti , |
(4.3) |
где M – масса частицы, Xi – пространственные координаты центра массы частицы, υsi – скорости поступательного и вращательного движения, ℓi и hi – параметры, характеризующие форму (габитус) и рельеф поверхности частицы, συi, σsi, ηei – параметры структуры объема, приповерхностных участков и электронной структуры частиц, νυi, νti – характеристики частот колебательных и трансляционных перемещений атомов.
Рассмотрим частицу с числом атомов j > 103. Измерения показали, что
вприроде нет веществ, в которых все частицы имеют одинаковые свойства.
Вкачестве основной характеристики вещества выступает дифференциальная функция распределения его частиц по состояниям
F(Xi ,t) = |
∂p NF |
, |
(4.4) |
||
∂ X1 |
...∂ X p |
||||
|
|
|
|||
где NF – число частиц, у которых значения параметров состояния в момент t не превышают Xi, p – число параметров, вовлеченных в рассмотрение.
Функция распределения удовлетворяет условию
N |
|
XiM |
|
|
|
|
∫ |
Xi F(Xi ,t )dX1 |
...dX p |
|
|
Xi = 1 |
|
4.5) |
|||
при |
F 0 |
Xi 0 |
|
|
|
|
XiM |
|
|
||
|
|
|
|
||
NF 0 = |
∫ |
F(Xi ,t )dX1 ...dX p , |
(4.6) |
||
Xi 0
43
где ‹Xi› – параметр X1, усредненный по всем частицам системы, число которых равно NF0; Xi0 и Xiм – минимальное и максимальное значения Xi, разрешенные законами сохранения. Полуинтегральная функция распределения
XiM |
|
φ(X1 ,t)= ∫ F(Xi ,t )dX2 ...dX p , |
(4.7) |
Xi 0
X1 – определяющий (интересующий) параметр.
F (Xi, t), φ (X1, t) аккумулируют информацию об эволюции вещества. Причины эволюции системы. На каждой стадии (зарождение, рост)
темп эволюции можно описать суммой скоростей изменения всех параметров состояния частиц, т.е. суммой функционалов:
Gi |
= |
dXi |
= Gi (Xi , yi ) , |
|
|
|
|||
|
|
dt |
|
|
|
|
p |
|
|
GE = ∑Gi (Xi , yi ), |
(4.8) |
|||
i=1
где GE – скорость эволюции, yi = cni, nNi, νM, T, UM – концентрация атомов (молекул) всех видов cni, количество наночастиц nNi разной природы, скорость движения относительно стенок νM, температура T и скорость UM образования продуктов радиолиза под влиянием внешнего облучения.
Более информативными характеристиками темпа эволюции являются
следующие величины: |
∂F |
|
|
|
GF ≡ |
=GF (Xi , yi ,t), |
(4.9) |
||
∂t |
||||
|
|
|
||
Gϕ ≡ |
∂ϕ |
=Gϕ (Xi , yi ,t) . |
4.10) |
|
|
∂t |
|
|
4.2.Основной эволюционный маршрут
Всистемах, где преобладают два вещества – фазообразующий макрокомпонент и растворитель, особую роль в эволюции играет концентрация фазооб-
разующего компонента в среде. Если концентрация макрокомпонента См поднимается выше некоторого рубежного значения Lм, j , то частица начинает укрупняться, изменяя габитус (форму) и рельеф поверхности. Если См <Lм, j , то
частица начинает растворяться, появляются фигуры травления. Простейшее соотношение, характеризующееотклонениетекущейконцентрацииотрубежной,
ξj = |
Cм |
– 1, |
(4.11) |
|
|||
|
Lм, j |
|
|
где См – количество молекул или кластеров, из которых строятся частицы, в единице объема среды; Lм, j – рубежное значение См для данной частицы; ξj –
применительно к растворам и парам называется относительным пересыщением иотражаетпреобладаниеприсоединенияатомовкчастиценадотрывом.
44
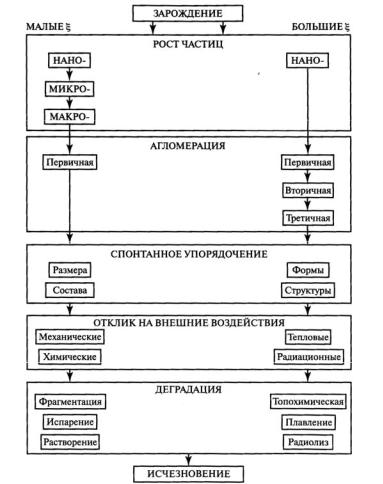
Основной эволюционный маршрут представлен на рис. 4.1. Предвестником появления твердого тела в гомогенной среде является за-
родыш – это молекулярный кластер такого размера, что вероятность его последующего распада незначима. Кластеры укрупняются в основном в результате конкуренции присоединения и отрыва отдельных молекул (атомов). При одном и том же пересыщении среды частота присоединения к каждому кластеру увеличивается, а отрыва уменьшается по мере укрупнения кластера. В пересыщенных средах образуются коллективы частиц разного размера. Вследствие полидисперсности частицы в коллективе растут с разными скоростями, что отража-
етсянафункции ϕ(Хi ,t) распределениячастицпосостояниям.
При росте частиц изменяются все их свойства. Форма растущих кристаллов усложняется, приближаясь к равновесию. Это распространенный маршрут морфологической эволюции. Постепенно среда разрушает неупорядоченные агрегаты и способствует образованию упорядоченных форм.
Рис. 4.1. Схема основного эволюционного маршрута твердого вещества
Почти все, что нас окружает, медленно, но неминуемо растворяется или испаряется. Вещество рассеивается в пространстве, реализуя эволюционный маршрут:
Пересыщенная среда → твердое тело → недонасыщенная среда.
45
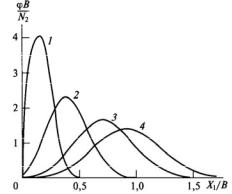
ϕ(X ,t) – функция распределения кластеров по размеру Х:
X м |
|
|
N = ∫ |
ϕ(X ,t)dX . |
(4.12) |
X0 |
|
|
Распределение кристаллов по размеру на разных этапах наращивания затравочных нанокристаллов приведено на рис. 4.2.
Рис. 4.2. Распределение кристаллов по размеру на разных этапах изотермического наращивания затравочных нанокристаллов. Функции рассчитаны для моментов t, при которых в кристаллы перешло 1 % (1), 10 % (2), 50 % (3), 100 % (4) вещества. В – константа
Нанотела укрупняются, снижая пересыщение, что приводит к невозможности образования новых зародышей, и собственные зародыши, которые образовались ранее, начинают растворяться. Так что функция ϕ(X ,t)
растущих НЧ, изначально узкая, постепенно расширяется.
Как видно, чтобы приблизиться к монодисперсному веществу, следует проводить синтез из слабопересыщенных растворов с введением небольшого числа «затравочных» нанотел. Тогда гомогенизация среды будет способствовать снижению флуктуационного размера, особая чистота предотвратит образование неконтролируемых зародышей, малые пересыщения сделают невозможным уширение функции распределения за счет гомогенного зарождения. Это и определяет подход к решению важнейшей проблемы получения веществ, близких к монодисперсным.
4.3. Отклик твердого вещества на внешнее воздействие
Под внешним воздействием происходит изменение свойств вещества. Распределение частиц по одному из параметров состояния изменяется под внешним воздействием в соответствие с уравнением баланса частиц, находящихся в данном состоянии,
− |
∂ϕ |
= |
∂ |
Giϕ − |
∂ |
(Diϕ) + λϕ − B , |
(4.13) |
∂t |
|
∂Xi |
|||||
|
|
∂Xi |
|
|
|||
|
|
|
|
|
46 |
|
|

где Gi и Di – скорость направленного изменения Хi и коэффициент флуктуации скорости в любой момент t после начала воздействия, λ – частота выхода частиц из системы, В – интенсивность их формирования под влиянием внешнего воздействия, ϕ – функция распределения частиц по одному из
параметров состояния.
Вобщемвидеосновноеэволюционноеуравнениеможетбытьзаписанокак
|
∂ϕ |
p |
∂ |
|
|
p |
∂ |
|
|
|
|
− |
|
= ∑ |
|
|
G1iϕ − ∑ |
|
|
(G2 jϕ) |
+ λϕ − B . |
(4.14) |
|
∂t |
∂X |
|
∂X |
|
|||||||
|
i=1 |
i |
j=1 |
j |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Направленное изменение свойств вещества является результатом сложения флуктуаций скорости изменения состояния частиц. Уравнение (4.14) можно рассматривать как условие сохранения числа реализованных состояний частиц системы. Оно отражает представление о том, что каждая частица переходит в данное состояние в результате непрерывного «блуждания» в пространстве свойств, а уходит из данного состояния в результате дискретных переходов в другие состояния. При этом результаты сложения непрерывных блужданий частиц характеризуют величины G1i , а сами блужда-
ния – величины G2 j . Дискретный уход частиц из данного состояния харак-
теризует величина λ , а дискретный уход частиц из других состояний с последующим попаданием в данное состояние – величина В.
Пример. Реакция растворение вещества. При растворении тела молекулы его приповерхностного слоя образуют связи с молекулами растворителя и уходят в раствор. Часть из них возвращается на поверхность, но уходит больше, чем возвращается, так что масса и размер тела уменьшаются. Ско-
рость растворения однородного тела можно выразить формулой |
|
||||||
G |
= dl |
= |
V0 |
(ν |
|
−ω ), |
(4.15) |
4πl2 |
|
||||||
II |
dt |
|
|
i |
i |
|
|
где νi и ωi – частоты ухода и возврата молекулы на поверхность, V0 – объем,
который занимает молекула в приповерхностном монослое, l – размер. Вероятность ухода молекулы в раствор зависит от того, сколько моле-
кул тела находится в непосредственной близости от нее. Чтобы уйти в раствор, она должна в первую очередь разорвать связи с ближайшими молекулами тела. И чем больше молекул ее окружают, тем меньше вероятность ее
ухода. Поэтому частоту ухода следует представить в виде |
|
|||||||||||
|
|
kT |
nA ∑νij |
|
|
|
−(nAjεAj |
|
zAj |
|
|
|
|
|
|
|
|
|
|
||||||
νi |
= |
h |
Ωexp |
+ε0 j ) |
|
|
, |
(4.16) |
||||
|
||||||||||||
|
|
j |
|
|
|
|
|
kT |
|
|
||
здесь nA – число молекул в приповерхностном монослое, νij – частотный па-
раметр, который отражает особенности поведения молекул в одном из состояний в монослое, Ω – усредненная по времени доля молекул, находящихся в состоянии с данным числом nAj молекул тела в ближайшем окру-
47

жении, εAj – энергия связи с одной из ближайших молекул, ε0 j – энергия связи с более удаленными молекулами, zAj – коэффициенты перехода от
энергии связи к энергии активации растворения.
В соответствие с (4.16) при растворении в первую очередь с поверхности тела уходят молекулы, у которых мало ближайших соседей. Однако при уходе каждой молекулы уменьшается число ближайших соседей у молекул, которые были соседями в ее окружении до ухода. Растворение приобретает характер кооперативного процесса, при котором уход каждой молекулы стимулирует уход последующих молекул. Образуются углубления на гранях. Все это отражает функция Ω(τ).
Если тело – агломерат множества кристаллов, то его поверхность неоднородна. Каждый участок имеет свою собственную локальную скорость растворения GII, а тело в целом характеризуется интегральной скоростью
растворения |
|
GI = ∞∫GII z(νi )dνi , |
(4.17) |
0 |
|
где z(vi) – плотность распределения участков по частотам перехода.
На рис. 4.3 приведены данные о функции z(vi) для поликристаллического тела из Кольского месторождения фторапатита [Ca(PO4)3F], который растворяли в водном растворе фосфорной кислоты. Данные получены путем прямого наблюдения за изменением рельефа поверхности тела, что позволило определить локальную скорость растворения на большом числе участков.
Рис. 4.3. Функция распределения участков на поверхности зерна фторапатита из Кольского месторождения по частотам перехода атомов в водный раствор фосфорной кислоты. Условия растворения:
T = 300 К, концентрация кислоты 184.6 моль/м3. ν – среднее значение частот перехода, θν – доля участков, для которых частота < ν
48
4.4. Этап пребывания вещества в наносостоянии
Функция распределения ϕ(l,t) на этапах зарождения, роста и созревания НЧ изменяется в соответствие с уравнением Фоккера–Планка
|
∂ϕ |
|
∂ |
|
∂ |
|
|
|
− |
= |
Giϕ − |
(Diϕ) |
(4.18) |
||||
∂t |
|
∂li |
||||||
при |
|
∂li |
|
|
||||
|
|
|
|
|
|
|
||
|
∂ |
|
|
|
|
Giϕ − |
(Diϕ) |
= J , ϕ(l,0) = 0, ϕ(∞,t) = 0 . |
(4.19) |
||
∂li |
|||||
|
l→l |
|
|
||
|
|
0 |
|
|
Здесь Di – коэффициент флуктуации скорости роста, J – скорость нуклеации, li – эффективный размер частиц.
При этом скорость роста Gi описывается соотношением
Gi |
=V0 |
|
|
c |
n |
|
|
|
|
|
ωi |
|
−νi |
|
, |
(4.20) |
|||||
c∞ |
||||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
где V0 – объем 1 молекулы в частице, ωi – вероятность присоединения отдельной молекулы к частице в единицу времени (в пересчете на единицу поверхности частиц), νi – частота ухода молекул с 1 поверхности частицы в
среду, с – концентрация вещества в среде, с∞ – его растворимость, n – показатель чувствительности скорости роста к пересыщению.
К выходу вещества из наносостояния может приводить пересыщение и агломерация с последующим упорядочением внутренней структуры агломератов. Обычно НЧ длительно сохраняют индивидуальность в объеме агломератов. Однако со временем границы между НЧ в агломератах исчезают, и агломераты перестают быть частицами наносистем. Для упорядочения агломерата требуется время
t = |
X |
2 |
, |
(4.21) |
|
1 |
|||
D |
|
|||
|
|
|
|
|
|
ss |
|
||
Х1 – размерагломерата, Dss – коэффициентдиффузииатомоввегообъеме.
5. ФИЗИКОХИМИЯ ЗАРОЖДЕНИЯ И РОСТА НАНОРАЗМЕРНЫХ ЧАСТИЦ
5.1. Термодинамика зарождения и роста наноразмерных частиц
5.1.1. Связь свободной энергии с размером частиц
Размер частиц является активной термодинамической переменной, определяющей наряду с другими состояние системы. Общее энергосодержание высокодисперсных систем растет за счет увеличения поверхности, так как свободная поверхностная энергия этих систем может на несколько по-
49

рядков превосходить соответствующее значение для фаз средней и низкой дисперсности. С изменением размера частиц изменяется доля вещества, относящаяся к поверхностному слою и внутренним областям фазы. Для бесконечно протяженных фаз энергия, энтропия или объем прямо пропорциональны массе при Р, Т = const. Для дисперсных частиц поверхность S является нелинейной функцией массы
S ≈ n2 / 3 , |
(5.1) |
где n – число молей.
Из-за этого ни одна из термодинамических функций не будет линейной функцией массы. Отличие химических параметров от удельных значений для частиц различного размера имеет существенное значение. Пусть кристалл имеет объем υ и поверхность S, построенную из различных граней с площадями Si и ребрами длиной lk, тогда энергия Гиббса
G = gυυ +∑σi Si +∑τk lk , |
(5.2) |
где gυ – удельное, на единицу объема, значение G, σi – удельное на 1 см2 значение G для i-граней, τk – такая же величина на единицу длины k-х ребер.
Вместо gυ удобнее использовать μ∞ для бесконечно протяженной фазы. n – число молей в кристалле объемом υ.
G = μ∞n +∑σi Si +∑τk lk = μ∞n +GS (r) +Gl (r) , |
(5.3) |
|||||||||
|
i |
k |
|
|
|
|
|
|
|
|
|
∂G |
= μ∞ +∑σi |
∂S |
|
∂υ |
+∑τk |
∂l ∂υ |
, |
(5.4) |
|
μr = |
|
|
i |
|
k |
|
||||
|
∂n T , p |
i |
∂υ ∂n |
k |
∂υ ∂n |
|
|
|||
|
|
υ = fυr3 , Si = fS r2 , lk = fl r |
, |
|
(5.5) |
|||||
|
|
|
|
|
i |
|
k |
|
|
|
где r – линейный радиус кристалла.
Для шара fv = 43 π и
Поскольку ∂υ =υ∂n
fSi = 4π ,
|
∂S |
|
= |
2 |
fS |
i |
1 |
, |
|
∂l |
|
= |
1 |
fl |
1 |
. |
(5.6) |
|||
|
|
i |
|
|
|
|
|
|
k |
|
k |
|
|
|
||||||
|
3 |
f |
|
|
r |
|
3 f r |
2 |
||||||||||||
|
∂υ |
|
v |
|
|
∂υ |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
υ |
|
|
|
|
|
||
– парциальный мольный объем, то для химическо-
го потенциала вещества в дисперсной фазе с объемом частицы υ или линейным размером r получаем
|
|
|
|
∂S |
|
|
|
|
|
|
∂l |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
σi |
fS |
|
|
|
1 |
|
1 |
|
|
|
|
|
fl |
|
|
1 |
|
|||||
μr = μ∞ +∑σi |
i υ +∑τk |
k |
υ |
= μ∞ + |
υ∑ |
i |
|
|
+ |
υ∑τk |
k |
|
. (5.7) |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
3 |
|
fυ r |
3 |
fυ r |
2 |
|||||||||||||||||||||||||||||||||||||
|
i |
|
|
∂υ |
|
|
k |
|
∂υ |
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
k |
|
|
|
||||||||||||||||||||
Заменим fυr3 |
на υ , |
|
fυ |
|
= |
υ |
, получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
r3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
μr |
− μ∞ |
= |
2 |
υ |
∑σi fSi r |
2 |
+ |
1 |
υ |
∑τk flk |
r = |
|
υ |
|
|
2 |
G |
S |
(r) |
+ |
1 |
l |
|
|
, |
|
|
(5.8) |
|||||||||||||||||||
3 |
υ |
|
3 |
υ |
υ |
|
3 |
|
|
3 |
G |
(r) |
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
i |
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
где GS(r) – избыток величины G для граней одного кристалла, размер которого определяется параметрами длины r, Gl(r) – для ребер.
50
