
posobie
.pdfVn = kn[Mn ][A], |
|
|||||||||
V |
= k |
sn |
[M |
n |
A* ][He], |
(6.12) |
||||
sn |
|
|
|
|
|
|
||||
V |
= k |
−n |
[M |
n |
A* ]. |
|
||||
−n |
|
|
|
|
|
|
||||
Квазистационарное состояние
V |
−V |
−V |
= 0, d[Mn A* ] = 0. |
(6.13) |
n |
sn |
−n |
dt |
|
|
|
|
|
Промежуточное вещество не накапливается. Тогда
kn [Men ][A]- ksn Men A* [He]- kn Men A* = 0 ,
|
[Mn A* ] = |
|
kn[Mn ][A] |
, |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
ksn[He] + k−n |
|
|
|
|
|
|
|
|||||||
|
Vsn |
= ksn |
kn[Mn ][A] |
|
[He], |
|
|
|
|
|
||||||||
|
ksn[He] + k−n |
|
|
|
|
|
||||||||||||
V |
= d[Mn A*] |
= − d[Mn ] |
= k |
|
|
ksn[He] |
|
[M |
|
|
][A], |
|||||||
n ksn |
[He] + k−n |
|
|
|||||||||||||||
sn |
dt |
|
dt |
|
|
|
|
n |
|
|||||||||
|
|
−ln [Mn ]t = kn[A] |
|
ksn[He] |
|
|
t, |
|||||||||||
|
|
ksn[He] + k−n |
||||||||||||||||
|
|
[Mn ]0 |
|
|
|
|
|
|
|
|||||||||
Степень завершенности (полнота) реакции |
|
|
|
|
|
|
|
|||||||||||
|
|
α = [Mn ]0 −[Mn ]t , |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
[Mn ]0 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
−ln(1−α) = kn[A] |
|
|
ksn |
[He] |
|
t. |
|
|
|
|
|||||||
|
ksn |
[He] + k−n |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
(6.14)
(6.15)
(6.16)
Отношение правой части отражает соотношение между стабилизацией аддукта за счет перераспределения колебательной энергии в процессе трой-
ных столкновений ( ksn ) и мономолекулярной реакцией Mn A* (k−n ) :
k−n |
|
E − E |
s−1 |
|
||
=ω |
0 |
|
, |
(6.17) |
||
E |
||||||
|
|
|
|
|
||
здесь ω – частотный фактор, обычно 1014 с-1, s – число мод (гармонических осцилляторов) Mn A (s = 3n , если А – двухатомная молекула), E0 – крити-
ческая энергия диссоциации кластера, Е – колебательная энергия Mn A*
( E = 3nkT ). |
|
Если k−n ~ ksn[He], то из (6.16) |
|
−ln(1−α) = kn[A] t. |
(6.18) |
6.3. Макрокинетика химических реакций в нанокомпозитах (НК)
Успехи нанохимии в области синтеза систем металл–полимер с задан-
71
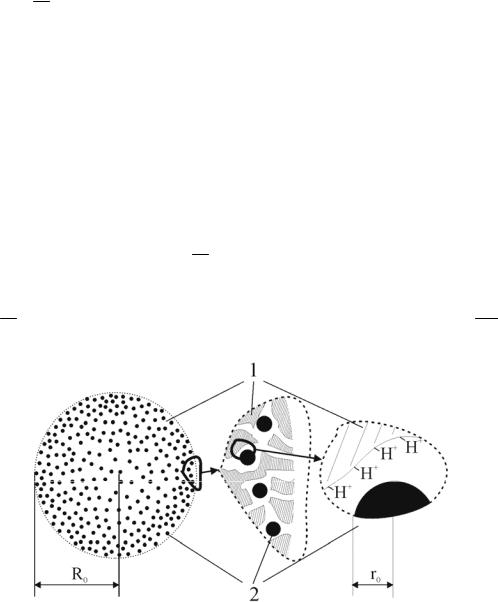
ной дисперсностью позволяют использовать исходный размер частиц в качестве инструмента влияния на реакционную способность композитного материала в целом. Физико-химическая модель макрокинетического процесса, включающего сорбцию реагента и химическую реакцию, основана на следующих допущениях.
1. Сорбент представляет собой пористую среду, по поровому объему которой распределены монодисперсные сферические частицы металла. Внутренняя поверхность пор содержит связанные с материалом основы
противоионы H + (рис. 6. 2). Физическими характеристиками сорбента являются: характерный размер пористой среды (зерна) Х0; отношение свободного объема пор к объему сорбента (порозность) ω; радиус частицы металла r0; относительная плотность распределения металлических частиц f(X) вдоль направления Х, нормального к поверхности сорбента; емкость сорбента по металлу εМе и противоионам водорода εH + на единицу его грануль-
ного объема.
2. При погружении нанокомпозита (НК) металл–ионообменник в водный раствор окислителя, например, молекулярного кислорода, происходит проникновение молекул О2 в поры с последующим окислительновосстановительным взаимодействием с частицами металла по реакции
4 Me+ O + 4H |
+ → |
4 |
|
z+ + 2 H |
O , |
(6.19) |
|
Me |
|||||||
z |
2 |
|
z |
2 |
|
|
|
|
|
|
|
|
|
||
где z – число электронов, участвующих в окислительно-восстановительном
процессе, H + – противоионы водорода в исходном ионообменнике, Mez+ – противоионы, образованные растворяющимися частицами металла.
Рис. 6.2. Модель сорбента в форме сферического зерна; 1 – полимерная матрица, 2 – частицы металла
3. Частица сорбента окружена раствором окислителя с концентрацией со. Предполагается, что гидродинамические условия обеспечивают постоян-
72

ство концентрации окислителя на поверхности, а переход окислителя из раствора в сорбент не сопровождается процессами перераспределения, т.е. приповерхностная концентрация окислителя в порах сорбента в расчете на объем порового раствора равна сo.
4.Суммарный объем металла, диспергированного по ионообменной матрице, значительно меньше порового объема (объем эквивалентного ионообменной емкости количества для большинства металлов составит величину порядка 3 % объема пор наиболее часто используемого в качестве основы сульфокатионообменника КУ-23 15/100, поэтому можно принять, что
доля свободного порового объема определяется характеристиками ионообменной основы и не меняется в ходе окисления (ω ≠ ω(t) ).
5.При взаимодействии частиц металла с окислителем, доставляемым от внешней границы частицы сорбента диффузионным переносом с коэф-
фициентом диффузии D , происходит гомотетичное уменьшение их размера в соответствии с некоторым кинетическим законом. Образующийся про-
дукт окисления металла ( Mez+ ) не влияет на характер диффузионного переноса сорбата и в построении уравнений баланса не учитывается.
Таким образом, характеристиками сорбционной системы являются: концентрация окислителя в растворе со, коэффициент диффузии окислителя в по-
рах D , константа скорости окислительно-восстановительной реакции (6.19) k′. В качестве начального приближения примем, что k′ не зависит от размера частицы металла и сохраняет свое постоянство в течение всего процесса.
За основу примем уравнение баланса для элементарного объема пористой среды (сорбента) Vps:
∂ni + |
∂Ni + div(n ur) = |
|
m,i ( 2 |
n |
+ λ |
2 |
T ) . |
(6.20) |
|
D |
|||||||||
∂t |
∂t |
i |
|
X |
i |
i |
X |
|
|
|
|
|
|
|
|
|
|
||
Здесь ni и Ni – концентрации i-го компонента в растворе и сорбенте в расчете на единицу объема пористой среды, u – линейная скорость протока рас-
твора в пористой среде, D m,i и λi – коэффициенты молекулярной диффузии и термодиффузии i-го компонента соответственно, 2X – оператор Лапласа, Т – температура. Учитывая, что для рассматриваемой системы 2X T = u = 0, i = 1 и
опуская индекс m при коэффициенте диффузии, получим |
|
||||||
∂n |
+ |
∂N |
= |
|
2X n . |
(6.21) |
|
D |
|||||||
∂t |
∂t |
||||||
|
|
|
|
|
|||
Переходя к концентрации окислителя в единице объема порового раствора cO2 на основании равенства n =ωcO2 , вместо первого члена (6.21) бу-
дем иметь ω ∂∂cOt 2 – изменение концентрации окислителя в элементарном объеме пористой среды Vps. Третий член (6.21) перепишем в виде D 2X сO2 .
73

Коэффициент D в неявном виде содержит параметр ω.
Второе слагаемое (6.21) описывает сток сорбируемого вещества на частицах металла из элементарного объема Vps и может быть получено на основании кинетического закона взаимодействия окислителя с дисперсным металлом. Примем, что последнее протекает по реакции (6.19) и описывается соотношением
|
dνO |
′ |
m |
n |
|
|
2 |
|
|||
− |
dt |
= k SMecO2 |
cH + , |
(6.22) |
|
|
|
|
|
|
|
т. е. количество молей кислорода dνO2 , исчезающее в объеме Vps за время dt,
пропорционально площади поверхности металлических частиц SMe, заключенных в Vps, а также концентрациям ионов водорода и молекул кислорода в поровом растворе. Здесь n и m – формальные кинетические порядки по ионам водорода и кислороду соответственно. Преобразуем
∂N |
|
1 |
|
∂νO |
|
|
|
1 |
′ |
m |
n |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||
∂t |
= − |
Vps |
∂t |
|
|
= |
Vps |
k SMecO2 |
cH + , |
(6.23) |
|||
учтем, что SMe = 4πr2Nчастиц = 4πr2f(Х)ρVps, и окончательно получим |
|
||||||||||||
|
∂N |
|
|
′ |
2 |
f |
|
|
n |
m |
|
(6.24) |
|
|
∂t |
= 4πk r |
(X)ρcH + cO2 . |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Здесь ρ – среднее количество частиц металла в единице объема сорбента (м–3). Данная величина легко рассчитывается на основании известного содержания металла в сорбенте, а также объема частицы металла
ρ = |
εMe Vm , |
(6.25) |
|
4πr3 |
|
3 |
o |
|
где Vm – молярный объем металла.
Произведение f(R)ρ при условии, что функция f(X) удовлетворяет условию нормировки
|
1 |
X |
|
|
|
|
∫o |
f (X )S (X )dX =1 , |
(6.26) |
||
V |
|||||
|
sorb |
0 |
|
|
представляет собой количество частиц металла в единице объема слоя (X, X + dX), Vsorb – объем частицы сорбента, S(X) – площадь поверхности в сорбенте, построенной таким образом, что S(X)dX = Vps. Уравнение баланса (6.21) с учетом (6.25) и (6.26) запишется в виде
|
∂cO2 |
|
|
2 |
′ 2 |
m |
n |
|
|
|
|
|
|||||||
ω |
|
= D X cO2 |
− 4πk r |
f (X )ρcO2 |
cH + . |
(6.27) |
|||
∂t |
|||||||||
|
|
|
|
|
|
|
|
||
Выражение для концентрации ионов водорода может быть получено исходя из следующих рассуждений. Пусть α(t) – отношение количества молей прореагировавшего металла к его исходному количеству в единице объема сорбента. Тогда содержание непрореагировавших ионов водорода εH + − zαεMe
в единице объема порового раствора определится соотношением
74
c + (t) =θ |
εH + − zαεMe |
. |
(6.28) |
|
|||
H |
ω |
|
|
|
|
|
|
Данные рассуждения верны при соблюдении двух условий. Во-первых, интенсивность стока H+ на поверхности частиц металла по реакции (1) значительно меньше скорости выравнивающего градиент диффузионного распределения протонов по зерну, т. е. в силу высокой подвижности ионов водорода их концентрация не является функцией координаты X, а только функцией времени. Во-вторых, коэффициент пропорциональности θ, представляющий собой по существу степень диссоциации ионогенных групп,
сохраняет свое значение независимо от количества ионов Mez+ и остается постоянным на всех этапах редокс-сорбционного процесса независимо от степени истощения ионообменной емкости. Для макропористых ионообменников с сильнокислотными ионогенными группами предположение о постоянстве θ представляется оправданным.
Подставив (6.28) в (6.27) получим
|
∂c |
|
|
|
|
|
|
|
|
|
′ |
|
|
|
|
|
|
|
m |
ε |
|
+ − zαε |
Me |
n |
|
||
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
H |
|
|||||||||||
|
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
ω |
∂t |
= D X cO2 |
− 4πk r |
|
f (X )ρ cO2 |
θ |
|
|
ω |
|
. |
(6.29) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Запишем (6.24) для одной частицы металла: |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
dνO |
|
|
|
|
|
|
2 |
|
m |
|
|
n |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
= −k′4πr |
cO2 |
cH + . |
|
|
|
|
(6.30) |
|||||||||
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Переходя к скорости растворения металла, получим |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
z dν |
|
|
|
|
|
|
|
2 |
m |
|
|
n |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
Me |
= −k′4πr |
|
cO2 |
cH + . |
|
|
|
|
(6.31) |
||||||||||
|
|
4 |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Очевидно, что количество молей металла связано с радиусом частицы |
|||||||||||||||||||||||||||
следующим образом |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
dν |
Me |
= dV |
|
/ V = |
πr2dr . |
|
|
(6.32) |
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Me |
m |
|
Vm |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Выражение (6.31) с учетом (6.32) преобразуется к виду |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
dr |
= − |
4 |
′ |
m |
|
|
n |
|
|
|
|
(6.33) |
||||||||
|
|
|
|
|
|
|
|
dt |
z |
Vmk cO2 |
cH + . |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Уравнения (6.29) и (6.33) содержат зависимость r(Х, t). Для перехода к экспериментально фиксируемой характеристике α(t) необходимо воспользоваться соотношением:
X |
f (X ) |
r |
|
3 |
S (X ) |
|
|
α =1 - ∫o |
|
dX , |
(6.34) |
||||
|
|
|
|||||
0 |
ro |
|
Vsorb |
|
|||
которое представляет собой отношение суммарного объема частиц к моменту времени t к исходному объему введенного в ионообменник металла.
Окончательно система уравнений примет вид
75

|
|
∂c |
|
|
|
|
|
|
|
|
− 4πKr2 f (X )ρ cm |
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
ω |
|
O2 |
|
= D 2 |
c |
|
|
||||||||||||||
|
|
|
|||||||||||||||||||
|
|
|
∂t |
|
|
|
X |
|
O |
|
|
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
∂r |
|
|
4 |
|
|
|
|
m ε |
|
|
|
− zαεMe |
n |
|||||||
|
= − |
Vm Kc |
H |
+ |
, |
||||||||||||||||
|
∂t |
z |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
ω |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Xo |
|
|
|
|
|
r |
|
3 |
S ( |
X ) |
|
|
|
|||
|
|
|
|
|
∫ f (X ) |
|
|
|
|
||||||||||||
α =1- |
|
|
|
|
|
|
dX |
|
|||||||||||||
|
|
Vsorb |
|
||||||||||||||||||
|
|
|
|
|
0 |
|
|
|
|
|
ro |
|
|
|
|
|
|||||
εH + − zαεMe n ,ω
(6.35)
Здесь и далее обозначение cO2 заменено на c. Входящий в первые два
уравнения системы (6.35) комплекс K = k′ θn согласно принятым модельным представлениям является константой, характеризующей удельную скорость окисления металла в ионообменной матрице.
Сформулируем условия однозначности для системы (6.35). Примем, что в момент времени t = 0 частица сорбента свободна от кислорода. На внешней ее границе выполняется условие постоянства концентрации, а в центре зерна –
равенства нулю потока кислорода. Таким образом, для c(X,t) получим |
|
|
|||||||||||
с(Xo,0) = cо, c(X,0) = 0, c(Xo,t) = cо; ∂c(X,t) |
|
= 0. |
|
|
(6.36) |
||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
∂X |
|
X=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Условия однозначности для r(X,t) определим следующим образом: |
|||||||||||||
r( X ,0 ) = ro , |
|
|
|
|
|
|
|
t = 0; |
|
|
|||
|
|
t |
4 |
m |
ε |
|
+ − zαεMe n |
|
|
|
|
|
|
|
|
H |
|
|
* |
|
|
||||||
r( Xo |
,t ) = − |
∫0 |
z |
KVmco |
|
|
dt, |
|
0 < t < t |
|
, |
(6.37) |
|
|
|
ω |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
,t ) = 0, |
|
|
|
|
|
|
|
t > t |
* |
|
|
|
r( Xo |
|
|
|
|
|
|
|
|
|
|
|||
т. е. в начальный момент времени частицы металла имеют исходный размер, затем окисляются в соответствии со вторым уравнением системы (17) при концентрации кислорода со до полного исчезновения. Время t* опреде-
ляется условием r( Xo ,t* ) = 0.
Численное решение обратной кинетической задачи. Численное решение системы (6.37) с условиями (6.38), (6.39) может быть проведено конечно разностным методом с использованием неявной двухслойной разностной схемы для первого уравнения системы (6.37). Введем в расчетной области этого уравнения сеточную функцию Сi,j, определенную в узлах равномерной сетки с шагом по координате X (индекс i) и по времени t (индекс j). Для отыскания значений функции Сi,j, на временном слое j + 1 получим систему уравнений
ACm |
+ A C |
+ A C |
+ A C |
= |
ω |
C |
, |
(6.38) |
|
||||||||
1 i , j+1 |
2 i−1, j+1 |
3 i , j+1 |
4 i+1, j+1 |
|
t i , j |
|
|
|
дополненную условиями
76
CI,0 = cо, CI,0 = 0, CI,j = cо ; C0,j = C1,j , |
(6.39) |
где I – номер узла по координате, отвечающий X = Xo. Радиус частиц металла ri,j+1 и степень завершенности сорбционного процесса αj+1 на следующем временном слое определялись на основании соотношения
r |
= r |
+ A Cm |
(6.40) |
i , j+1 |
i , j |
5 i , j+1 |
|
и интегрированием по формуле Симпсона соответственно.
Для анализа полученных соотношений воспользуемся числовыми значениями характеристик сорбционной системы нанокомпозит медь-
ионообменник в форме сферических зерен – водный раствор кислорода:
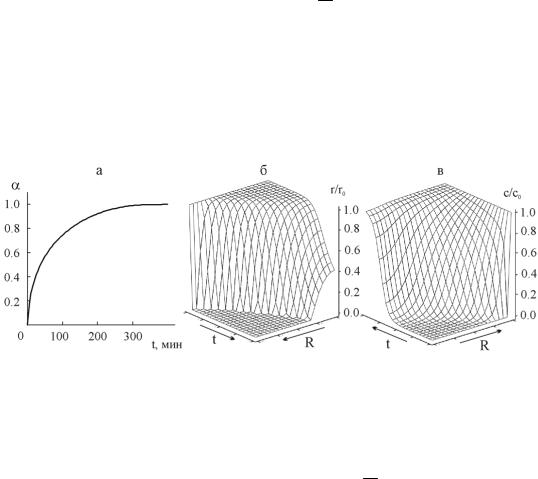
Rо = 0.4 мм, rо = 1 мкм, со = 1.26 моль/м3, εMe = 1.13 · 103 моль/м3, εH + = 2.28 · 103 моль/м3, ω = 0.36, n = 0.5, m = 1, D = 5.29 · 10–10 м2 · с–1, K = 2 × × 106 м2.5 · моль-0.5 · с-1. Полученное решение в виде зависимостей α(t), r/r0(R,t) и c/co(R,t) представлено на рис. 6.3.
Существенным отличием приведенных результатов является учет влияния исходного размера частицы металла на длину реакционного фронта, в рамках которого осуществляется уменьшение ее размера от rо до нуля в результате окисления.
Рис. 6.3. Результаты численного решения задачи (6.35) для сорбента
вформе сферических зерен. Зависимость степени завершенности α от времени t (а), распределение размеров частиц металла (б) и концентрации кислорода (в)
по зерну на различных этапах процесса редокс-сорбции
Рис. 6.4 показывает зависимость формы фронта реакции от радиуса
медного кристаллита при постоянных значениях D и K для степени полноты окисления α = 0.85. С уменьшением исходного размера частицы металла наблюдается снижение длины реакционного фронта, что в предельном случае rо → 0 приводит к образованию подвижной границы, разделяющей отработанную и неотработанную части сорбента.
77

Рис. 6.4. Зависимость формы реакционного фронта от размера частицы металла rо, мкм: 1–0.01, 2–0.1, 3–1, 4–5. Пунктирная линия – предельный переход к модели с движущейся границей (ro → 0)
Форма реакционного фронта непосредственно связана со скоростью его продвижения от периферии к центру зерна и, следовательно, с общей скоростью окисления дисперсного металла. Рост удельной поверхности металла с уменьшением rо вызывает увеличение скорости химической стадии и обусловленное этим общее ускорение сорбционного процесса, о чем свидетельствует связь t0.85 с исходным радиусом частицы металла (рис. 6.5). Независимость скорости окисления металла от размера его частиц, которую иллюстри-
рует постоянство t0.85 при – lgro > 7.5 (rо < 0.32 10–7 м), свидетельствует о полном переходе системы во внутридиффузионную область лимитирования
Рис. 6.5. Зависимость времени достижения α = 0.85 от размера частицы металла ro. 1 – Ag0 · KУ-23 , 2 – Cu0 · КУ-23
Рис. 6.6 иллюстрирует влияние радиального распределения частиц металла по зерну сорбента на общую скорость редокс-сорбции. Переход от равномерного к линейному и параболическому распределению при прочих равных параметрах повышает скорость редокс-сорбции. Учитывая зависи-
мость t0.85 от rо (рис. 6.5), можно сделать вывод, что при взятых для расчета параметрах значимое влияние размера частиц заключенного в полимерный
78

носитель металла на скорость его окисления будет иметь место при –
lgrо < 7.5 (rо > 0.32 10–7 м).
Таким образом, изложенный подход к математическому описанию ре- докс-сорбции позволяет учитывать влияние исходного размера частиц металла на форму и длину реакционного фронта, а также на общую скорость редокс-сорбции. Построенная система уравнений содержит функцию радиального распределения металла по зерну, что допускает ее применение к сорбентам как однородной, так и слоистой структуры.
Рис. 6.6. Зависимость скорости редокс-сорбции композитом металлионообменник от вида функции радиального распределения металла по зерну: 1 – равномерное распределение; 2 – линейное; 3 – параболическое
Большинство параметров модели (εMe , εH , ro, ω, f(X)) допускают непосредственное экспериментальное измерение, решение обратной кинетиче-
ской задачи сводится к отысканию D и K (рис. 6.7 и 6.8).
Рис. 6.7. Кинетические кривые для степени восстановительной сорбции α молекулярного кислорода из воды нанокомпозитами Ag0 · КУ-23 (1) и Cu0 · КУ-23 (2)
вH+-ионной форме. Скорость перемешивания раствора 220 об/мин, концентрация кислорода 1.26 моль/м3, объем композита 1 мл
Точки – экспериментальные значения, кривые – расчетные данные по системе уравнений (6.35)
79

а б
Рис. 6.8. Микрофотографии срезов зерен композитов Cu0 · КУ-23 (a)
иAg0 · КУ-23 (б), окисленных на 40 %
7.НАНОКАТАЛИЗ ХИМИЧЕСКИХ РЕАКЦИЙ
7.1.Кинетика кластерных реакций. Первичный размерный эффект
Вгетерогенном катализе твердые тела катализируют реакции молекул
вгазовых смесях или растворах. Поскольку твердые тела, если они не являются пористыми, обычно непроницаемы для молекул, то каталитические реакции, очевидно, происходят на поверхности. Но для экономии часто очень дорогих материалов (например, платины) катализаторы приготавливают в виде частиц нанометрового размера, осажденных на инертные пористые носители (рис. 7.1).
Рис. 7.1. Катализатор на инертном пористом носителе
Катализаторы представляют собой наноматериалы, а катализ — нанотехнологию. Разработано большое число методов получения малых частиц для гетерогенного катализа, обеспечивающих их высокую устойчивость, при которой они способны выдержать жесткие условия работы в промышленных реакторах.
80
