
3_i_4_gruppy_1
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ХИМИЯ ЭЛЕМЕНТОВ III И IV ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Учебное пособие
Составители: И.Я. Миттова, Е.В. Томина, Б.В. Сладкопевцев
Издательско-полиграфический центр Воронежскогогосударственногоуниверситета
2010
Утверждено научно-методическим советом химического факультета 2 декабря 2009 г., протокол № 3
Рецензент д-р хим. наук, проф. кафедры общей и неорганической химии В.Н. Семенов
Учебное пособие подготовлено на кафедре материаловедения и индустрии наносистем химического факультета Воронежского государственного университета.
Рекомендуется для студентов I курса химического факультета дневного отделения.
Для направлений: 020900 – Химия, физика и механика материалов, 020100 – Химия
2
ПРЕДИСЛОВИЕ
Учебное пособие является продолжением первой части, в которой были рассмотрены Периодический закон как основа неорганической химии и химия элементов первых двух групп Периодической системы (Миттова И.Я. [и др.] «Периодический закон как основа химической ситематики. Химия элементов I и II групп Периодической системы», ИПЦ ВГУ, 2009 г.). Во второй части рассматривается химия элементов III и IV групп Периодической системы химических элементов Д.И. Менделеева.
Основная цель издания данного пособия заключается в необходимости помочь студенту выделить из огромного количества материала, накопленного к настоящему моменту неорганической химией, самые необходимые моменты, которые в первую очередь нужно учесть при изучении соответствующего курса. Кроме того, при написании пособия ставилась цель учесть последние достижения науки в области неорганической химии и вместе с тем сделать изучаемый студентами материал более доступным.
Являясь второй частью цикла пособий по курсу «Неорганическая химия», данное издание в целом сохраняет структуру и последовательность изложения материала, касающегося химии элементов. Описание начинается с общей характеристики группы, рассмотрения электронного строения атомов, возможных степеней окисления, общих закономерностей и особенностей свойств элементов группы. Далее даётся общая характеристика простых веществ, способов их получения и химических свойств, в отдельных подразделах рассматриваются свойства соединений элементов группы (оксидов, гидроксидов, бинарных соединений, солей и комплексных соединений). Особое внимание уделено применению химических элементов и их соединений в качестве разнообразных современных материалов.
Чтобы помочь студентам и сделать изучение материала более наглядным, в пособии приведено большое количество рисунков, схем, структурных формул и таблиц.
В данном пособии в целом отображено состояние современной неорганической химии, при написании использованы современные литературные источники [1, 2], список которых приведён в конце пособия. Иллюстративный материал большей частью взят из учебника «Неорганическая химия» (под ред. Ю.Д. Третьякова, М. : Асаdemia, 2004). Для иллюстрации структур некоторых веществ были использованы Интернет-ресурсы (на-
пример, ресурс www.3dchem.com).
Построенное на основе мультимедийного курса лекций по дисциплине «Неорганическая химия», настоящее издание в первую очередь предназначено для студентов-первокурсников химического факультета, однако оно может быть полезным и для студентов старших курсов.
3
III ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Особенности III группы Периодической системы:
–в этой группе содержится около 1/3 всех элементов Периодической системы (37 элементов, включая лантаниды и актиниды);
–все элементы, кроме бора, являются металлами;
–различие свойств между элементами главной и побочной подгруппы наименьшее;
–типические элементы (В, Al) более закономерно вписываются в ряд с подгруппой скандия (энтальпии образования оксидов, галогенидов и т. д.), чем с подгруппой галлия;
–элементы подгруппы скандия возглавляют d-ряды, а элементы подгруппы галлия следуют за IIB-группой;
–у Sc и т. д. электронная конфигурация ns2(n–1)d1, а у элементов подгруппы Ga – (n–1)d10ns2np1. В степени окисления +3 наблюдается электронная аналогия между типическими элементами и подгруппой скандия. А
уэлементов подгруппы Ga остается d10 сверх оболочки предыдущего благородного газа;
–здесь в наибольшей степени проявляется d-сжатие (по сравнению с последующими А-группами), особенно заметное у Ga. Он менее металли-
чен, чем Al: ОЭО (Al) = 1,5, ОЭО (Ga) = 1,6. Ga(OH)3 – идеальный амфолит,
уAl(OH)3 преобладают основные свойства;
–элементы IIIВ-группы расположены до «вставки» из 14 f-элемен- тов в 6 и 7 периодах, а остальные элементы В-групп – после. Поэтому в ряду Sc – Y – La металлические свойства усиливаются, как в главных под-
группах. Sc(OH)3 амфотерен, La(OH)3 – сильное основание. Соли лантана в водном растворе не гидролизованы по катиону. Только начиная с IVBгруппы, за счет лантанидного сжатия, проявляется вторичная периодичность и сверху вниз растет химическая благородность элементов;
–наиболее характерна степень окисления +3;
–эффект 6s2-электронной пары у Tl – своеобразное проявление лантанидной контракции, для таллия характерна устойчивая степень окисления +1;
–типические элементы III группы являются диагональными анало-
гами: Be и Al, B и Si;
–в этой группе расположены элементы – «укрепители» Периодической системы: «экабор» – Sc и «экаалюминий» – Ga.
4
ГЛАВА 1. IIIA-ГРУППА
1.1. Простые вещества
Электронное строение
В основном состоянии элементы главной подгруппы имеют электронное строение ns2np1. В возбужденном состоянии, в состоянии sp2-гиб- ридизации, участвуют в образовании трёх ковалентных связей.
Остается одна незанятая орбиталь, и число валентных электронов оказывается меньше числа доступных по энергии орбиталей. Поэтому многие соединения (ковалентные) являются кислотами Льюиса, т. е. акцепторами электронной пары. Приобретая её, они повышают к. ч. до 4 и изменяют геометрию своего окружения (из плоской – в тетраэдр, тип гибридизации – sp3).
У бора наблюдается диагональная аналогия с кремнием, кратность связи часто повышена за счет pπ-pπ – связывания. У Al и его аналогов – к. ч. повышается до 6 (и более), есть вакантные d-орбитали. В результате d-сжатия ионные радиусы Al и Ga близки, а атомный радиус Ga даже меньше, чем Al.
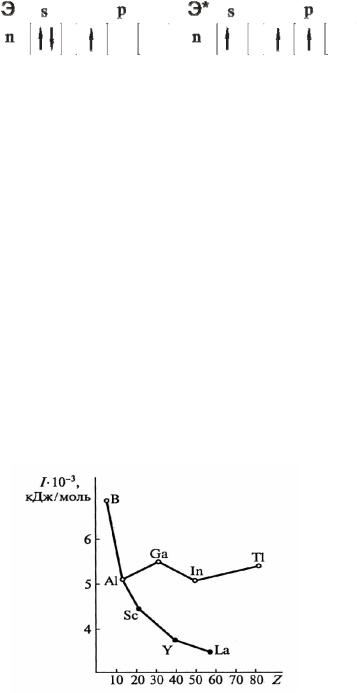
Электронная конфигурация последних уровней элементов подгруппы одинакова, однако строение внутренних уровней существенно различается. Для бора и алюминия оно отвечает электронной оболочке предшествующего благородного газа, для галлия и индия – благородного газа плюс d10, а для таллия – благородного газа плюс 4f145d10. Различия в строении электронных оболочек элементов оказывают существенное влияние на закономерности в изменениях химических свойств в группе, а также отражаются в энергиях ионизации (рис. 1)
Рис. 1. Изменение суммы первых трёх энергий ионизации элементов IIIВ (Sc, Y, La)
и IIIA (B, Al, Ga, In, Tl) групп ПС [2]
5
Из рисунка видно, что ожидаемое уменьшение энергии ионизации при переходе от бора к алюминию не сопровождается дальнейшим уменьшением при переходе к галлию, что является результатом d-сжатия атомов. Подобным образом уменьшение энергии ионизации при переходе от галлия к индию сопровождается её увеличением при переходе к таллию, в чём проявляется влияние лантанидной контракции. Однако подобные нарушения монотонности не наблюдаются в В-группе.
Свойства элементов IIIA-группы
Основные физические свойства элементов IIIA-группы представлены в таблице 1.
Таблица 1
Основные физические свойства элементов IIIA-группы [2]
Свойство |
B |
Al |
Ga |
In |
Tl |
|
|
|
|
|
|
Заряд ядра Z |
5 |
13 |
31 |
49 |
81 |
Электронная кон- |
[He]2s22p1 |
[Ne]3s23p1 |
[Ar]3d104s24p1 |
[Kr]4d105s25p1 |
[Xe] |
фигурация в основ- |
|
|
|
|
4f145d106s26p1 |
ном состоянии |
|
|
|
|
|
Атомный радиус, нм |
0,083 |
0,143 |
0,122 |
0,163 |
0,170 |
Энергия ионизации, |
|
|
|
|
|
кДж/моль: |
|
|
|
|
|
I1 |
801 |
577 |
579 |
558 |
589 |
I2 |
2427 |
1817 |
1979 |
1821 |
1971 |
I3 |
3660 |
2745 |
2963 |
2704 |
2878 |
Ионный радиус М3+, |
(0,027) |
0,054 |
0,061 |
0,080 |
0,089 |
нм |
|
|
|
|
|
Электроотрицатель- |
|
|
|
|
|
ность: |
2,04 |
1,61 |
1,81 |
1,78 |
2,04 |
по Полингу, |
|||||
по Оллреду-Рохову |
2,01 |
1,47 |
1,82 |
1,49 |
1,44 |
|
|
|
|
|
|
Нахождение в природе
Бор: содержание ~ 9 · 10–4 масс. %. В природе находится в виде кислородных соединений, боратов и боросиликатов. Основные природные соединения: борная кислота H3BO3, бура Na2B4O7 · 10H2O. Алюминий: содержание ~ 8,3 масс. % (по распространённости в земной коре занимает 3-е место). Основные природные соединения алюминия: алюмосиликаты, бок-
ситы Al2O3 · 2H2O, корунд α-Al2O3, криолит Na3[AlF6], шпинель Mg[Al2O4].
Из элементов подгруппы галлия самый распространенный галлий (4,6·10–4 масс. %). Индий (2 · 10–6 масс. %) и таллий (8 · 10–7 масс. %) – редкие эле-
6
менты. Галлий сопутствует алюминию в бокситах, а таллий – калию в алюмосиликатах.
Способы получения
Бор
1. Восстановление металлами при высокой температуре:
o
В2О3 + 3Mg →t C 2B + 3MgO (бор Муассана, чистота 95–98 %)
Используют и другие электроположительные элементы (например, Li, Na, K, Be, Ca, Al, Fe), однако продукт обычно получается в аморфном состоянии и загрязнён тугоплавкими примесями (например, боридами металлов). Крупнокристаллический бор (96 %) получают восстановлением BCl3 цинком в проточном реакторе при 900 оС.
2.Электролитическое восстановление расплавленных боратов или тетрафтороборатов, например KBF4, KCl/KF при 800 оС. Метод даёт порошкообразный бор 95 %-ной чистоты.
3.Восстановление летучих соединений водородом на нагретой танталовой проволоке:
o
2BBr3 + 3H2 →1150 C 2B + 6HBr
Используют для получения килограммовых количеств бора. Это наиболее эффективный метод получения бора высокой чистоты (более 99,9 %). Кристалличность улучшается с увеличением температуры.
4) Термическое разложение гидридов и галогенидов бора:
o
2BI3 →500 C 2B + 3I2↑
Алюминий
Боксит Al2O3 · 2H2O растворяют под давлением в горячем растворе NaOH. Из образовавшегося Na[Al(OH)4(H2O)2] получают Al(OH)3, обезвоживают, растворяют в расплавленном криолите Na3AlF6, затем эвтектический расплав подвергают электролизу (способ Байера).
Галлий, индий, таллий
Выделяют электролитически из обогащенных растворов их солей, полученных как побочные продукты при переработке алюминиевых, индиевых и свинцовых руд.
Физические свойства
Структура бора близка к ковалентной атомной, основу которой составляют группировки В12 (икосаэдры), по-разному упакованные в кристалле. α-В12 – икосаэдрические группировки расположены по принципу плотнейшей шаровой упаковки. Для Al характерна кубическая плотная упаковка. Структура Ga – рыхлая, для металлического галлия характерно наличие ассоциатов Ga2, tкип высока, похож на I2. Область жидкого состояния 30 – 2204 °С, при плавлении плотность растет. In и Tl имеют кубические и гексагональные структуры соответственно, плотные упаковки.
7
1.2. Химия бора и его соединений
Кристаллический бор химически инертен, с кислородом взаимодействует при 750 °С с образованием В2О3. Аморфный бор более активен:
В + 3HNO3 = H3BO3 + 3NO2↑
Бор реагирует со щелочами в присутствии окислителя: 4В + 4NaOH + 3O2 = 4NaBO2 + 2H2O
При высоких температурах бор реагирует с большинством простых веществ, кроме Н2, Ge, Te, инертных газов и Hg.
Бораны
Гидриды бора (бораны) представляют собой необычный класс неорганических соединений, по составу они сходны с углеводородами. Известны бораны насыщенного (предельного) ряда BnH2n+2 и ненасыщенного (непредельного) ряда BnH2n. Моноборан BH3 неустойчив, в индивидуальном состоянии не выделен. Диборан B2H6 получают по схеме:
2BF3(г) + 6NaH(тв) = B2H6(г)↑ + 6NaF(тв)
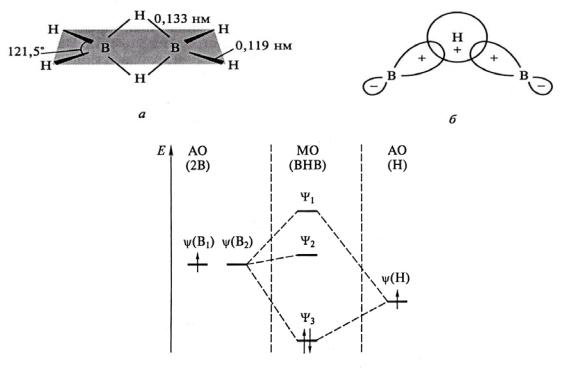
Бораны – электронодефицитные соединения. Здесь реализуется трёхцентровая двухэлектронная связь В – Н – В (рис. 2):
Рис. 2. Строение молекулы B2H6 (а) и образование (б, в) трехцентровой двухэлектронной связывающей молекулярной орбитали ψ3 из гибридных орбиталей
ψ(B1)+ ψ(B2) двух атомов B1 и B2 [2]
Проявлением электронодефицитности боранов является их склонность к реакциям присоединения, примером может служить синтез боргид-
ридных комплексов (или тетрагидридоборатов) – боргидридов натрия
Na[BH4], алюминия Al[BH4]3 и других элементов-металлов.
8
Бориды
Образуются при взаимодействии с металлами. Синтез боридов металлов можно осуществить по схеме:
V2O5 + B2O3 + 8C = 2VB + 8CO↑
Борид B4C приближается по твердости к алмазу. В боридах бор формально проявляет отрицательные степени окисления. В боридах с повы-
шенным содержанием металла Mе4B, Me3B (Me = Co, Ni, Pd), Me7B3 (Me = Tc, Re, Ru), Me2B (Me = Na, Mo, W) атомы бора изолированы и расположены преимущественно в центрах тригональных призм из атомов металлов. В боридах Cr5B3 и Me3B2 (Me = V, Nb, Ta) присутствуют изолированные пары
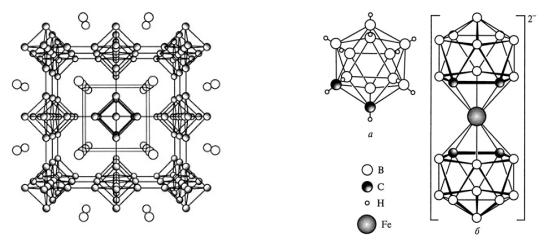
B – B. Бориды MeB (Me = Ti, Hf, V, Cr, Mo, Mn, Fe, Ni) образованы цепями из атомов бора. В структурах Me3B4 (Me = V, Nb, Cr, Mn) присутствуют двойные цепи из атомов бора. MeB2 (Me = Mg, Al) и Me2B5 (Me = Ni, Mo, W) образованы двумерными слоями, а бориды типа LaB6 – трехмерными каркасами из атомов бора (рис. 3).
В структурах боридов с высоким содержанием бора (MeB4, MeB12) сохраняются трехмерные фрагменты икосаэдров, в пустотах которых размещаются атомы металла.
Рис. 3. Строение LaB6 (октаэдры из атомов |
Рис. 4. Строение молекул: |
бора соединены в трехмерный каркас) [2] |
а – карборана С2В10H12; б – металлокар- |
|
борана [Fe(C2B9H11)2], [2] |
Карбораны
Карбораны (карбобораны, рис. 4) – это класс соединений со структурами, родственными изоэлектронным им боранам. Их образование можно представить как процесс последовательного замещения атомов бора в боране на атомы углерода.
Галогениды бора
Известно 4 высших галогенида бора. Галогениды ВХ3 представляют собой правильный треугольник, в центре которого находится атом в со-
9
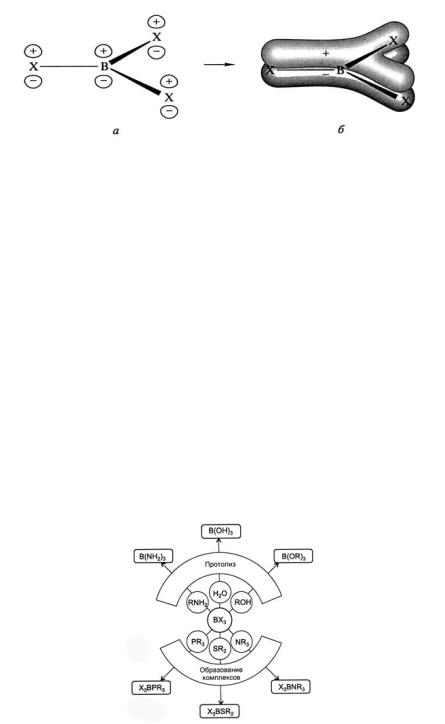
стоянии sp2-гибридизации. Галогениды мономерны, т. к. повышена кратность связи В – Х. Это сильные кислоты Льюиса:
BF3 + NH3 = F3B:NH3
С увеличением размера атомов галогенов перекрывание p-орбиталей уменьшается, степень π-связывания постепенно ослабевает, поэтому прочность связи В – Х и устойчивость молекул ВХ3 падают, а льюисова кислотность возрастает (рис. 5).
Рис. 5. Схема образования рπ – рπ связей в тригалогенидах бора: а – взаимодействие четырёх р-орбиталей; б – образование делокализованной молекулярной орбитали [2]
При переходе от фторида к иодиду межмолекулярные взаимодействия усиливаются, растут температуры плавления и кипения. Основные способы получения:
6CaF2 + Na2B4O7 + 8H2SO4(конц) = 4BF3↑ + 2NaHSO4 + 6CaSO4↓ + 7H2O B2O3 + 6NaBF4 + 3H2SO4(конц) = 8BF3↑ + 3Na2SO4 + 3H2O
BCl3 и BBr3 можно получить прямым синтезом, а также:
o
B2O3 + C + 3Cl2(Br2) →700 C 3CO + 2BCl3(BBr3) LiBH4 + 4I2 = BI3 + 4HI + LiI
На рис. 6 приведена схема, иллюстрирующая химические свойства галогенидов бора. Особо следует отметить склонность к гидролизу:
BX3 + 3H2O = H3BO3 + 3HX (X = Cl, Br, I)
4BF3 + 3H2O = H3BO3 + 3HBF4
тетрафтороборная
кислота
Рис. 6. Химические свойства галогенидов бора [5]
10
