
3_i_4_gruppy_1
.pdf
Соединения с азотом
Нитрид бора BN – уникальное по химической стабильности и механическим свойствам соединение [3, 4]. Существует в виде двух модификаций: α-BN (гексагональный нитрид бора) и β-BN (боразон) – рис. 7.
Рис. 7. Структура α-BN и β-BN
α-BN – вещество белого цвета со слоистой структурой, подобной структуре графита. Получают, обрабатывая бор или B2O3 аммиаком в присутствии углерода или Mg как катализатора:
B2O3 + 2NH3 = 2BN + 3H2O
β-BN – имеет алмазоподобную кубическую структуру. Кристаллы обладают настолько высокой твёрдостью, что царапают алмаз. Температура плавления – 3200 оС. Синтез проводят при высокой температуре – взаимодействие B и NH3 при температуре белого каления.
Боразол B3N3H6 (неорганический бензол) – аналогично бензолу в молекуле боразола атомы азота и бора находятся в состоянии sp2- гибридизации, связаны друг с другом σ- и делокализованными π-связями, образуя шестичленный цикл (рис. 8).
Рис. 8. Структура баразола B3N3H6 [www.3dchem.com]
11
Кислородные соединения бора
Оксид бора B2O3 – получают или окислением бора, или обезвоживанием по схеме:
B2O3(тв) + H2O(г) →>800 o C 2HBO2(г)
o
2H3BO3 →250 C B2O3 + 3H2O
B2O3(крист) состоит из плоских треугольников ВO3, соединенных общими вершинами в 3-мерную структуру (подобно SiO2), склонен к стеклообразованию (диагональная аналогия).
Борная кислота H3BO3 – конечный продукт гидролиза растворимых соединений бора. Является слабой кислотой:
B(OH)3 + H – OH ←→ [B(OH)4]– + H+
Проявляет кислотные свойства, взаимодействие со спиртами приводит к образованию эфиров:
В(OH)3 + 3CH3OH →H2SO4 конц. (CH3O)3B + 3H2O (HBO2)n – метаборные кислоты (H3B3O6).
H2B4O7 – тетраборная кислота, образуется в результате поликонденсации:
2B(OH)3 + 2[B(OH)4]– ←→ [B4O5(OH)4]2– + 5H2О
Состав водных растворов боратов зависит от pH, концентрации и температуры:
OH− |
OH− |
– |
→ |
– → |
|
B(OH)3 ←+ |
[B2O6(OH)4] ←+ |
[B2O3(OH)4] + |
H |
H |
|
−
+ [B O (OH) ]2– →OH [B(OH) ]–
4 5 4 ←+ 4
H
В сильнощелочных растворах – [B(OH)4]–, в кислой среде – H3BO3.
4H[B(OH)4] + 2NaOH → Na2B4O7 + 11H2O
Na2B4O7 + H2SO4 + 9H2O → Na2SO4 + 4H[B(OH)4]
o
2Na2B4O7 + 2Co(NO3)2 →t C 2Co(BO2)2 + 4NaBO2 + 4NO2↑ + O2↑
В комплексах [B(OH)4]–, [BHal4]–, [BH4]– ковалентные связи, ион B+ отсутствует.
1.3. Химия Al, Ga, In, Tl
Особенности
–резко отличаются от неметалла бора как более высокой химической активностью при умеренной температуре, так и ярко выраженной склонностью к образованию катионов в водных растворах;
–отсутствуют летучие гидриды и кластерные соединения типа боранов и карборанов;
–взаимодействуют с O2, N2, S, Hal2 и т. д., образуя оксиды Me2O3, нитриды MeN, сульфиды Me2S3, галогениды MeHal3;
12
–в избытке металла могут быть получены низшие сульфиды: GaS, InS, галогениды InBr, In[ЭВr4];
–Tl в этих условиях образует соединения со степенью окисления +1.
Химические свойства
У алюминия наблюдается высокое сродство к кислороду, при взаимодействии выделяется большое количество теплоты. Его часто используют в качестве восстановителя для получения Cr, Mn, V и многих других металлов. Данный процесс называется алюмотермией:
2Al + Fe2O3 = Al2O3 + 2Fe
Тонкий порошок алюминия взрывается при контакте с жидким кислородом, но обычные образцы металла покрыты тонкой защитной оксидной плёнкой. Al, Ga, In и Tl в ряду напряжений находятся левее водорода:
2Al + 6H+ + 12H2O = 2[Al(H2O)6]3+ + 3H2↑
Окисление водой и кислотами-неокислителями термодинамически возможно. C водой в обычных условиях алюминий не взаимодействует изза оксидной пленки, устойчив также к действию концентрированных HNO3 и Н2SO4. Если оксидная плёнка удалена (амальгамированием ртутью или при контакте с солями определённых электроположительных металлов), реакция идёт по схеме:
2Al + 6H2O = 2Al(OH)3↓ + 3H2↑ (Al(OH)3 = Al2O3·хН2О)
In и Tl растворяются в кислотах, с кислотами-неокислителями Tl образует соли Tl(I). Соли Tl(III) образуются при действии царской водки. В ряду Al – Ga – In – Tl – основные свойства возрастают, кислотные убывают. Алюминий и галлий взаимодействуют со щелочами с выделением водорода:
2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2↑
Индий и таллий в щелочах не растворяются.
Гидриды
Гидриды – твердые нелетучие вещества, нерастворимые в полярных растворителях. Прочность ковалентных связей M – H гидридов элементов IIIА-группы убывает из-за увеличения их атомных радиусов и уменьшения степени перекрывания атомных орбиталей Me и водорода. Кристаллический (AlH3)n построен из октаэдров AlH6, объединенных шестью трехцентровыми двухэлектронными связями Al – H – Al в бесконечный каркас.
Получение (в безводном диэтиловом эфире): 3nLi[AlH4] + nAlCl3 = 4(AlH3)n + 3nLiCl
(AlH3)n разлагается выше 150 ºС, гидриды остальных элементов IIIАгруппы – уже при комнатной температуре, высокореакциоонноспособны:
Ga2H6 + 6HCl −90 o C→ Ga2Cl6 + 6H2↑
Важны комплексные гидриды, например, Li[AlH4] – аланат лития: LiH + AlCl3 = Li[AlH4] + 3LiCl
13
Это ковалентное соединение, построенное из группировок [AlH4]–, соединенных мостиковыми атомами Li [5]. Li[AlH4] является сильнейшим восстановителем, восстанавливает R2СO в R2CHOH, RNO2 в RNH2. Li[AlH4] используют при синтезе гидридов Si, S, P, C:
Li[AlH4] + SiCl4 →эфир SiH4↑ + AlCl3 + LiCl
Галогениды МХ3, MX2 и MX
Фториды – кислоты Льюиса, например Na3AlF6. Они состоят из октаэдров MeF6, соединенных общими вершинами. Хлориды, бромиды и иодиды имеют молекулярную или слоистую структуру. Синтез AlCl3:
o
Al2O3 + 3Cl2 + 3C →800 C 2AlCl3↓ + 3CO↑
Хлорид алюминия используется для получения других галогенидов: AlCl3 + 3LiX = AlX3↓ + 3LiCl
Галогениды образуют разнообразные комплексы: Al(NH3)3Cl3, InCl3(H2O)3. В водных растворах [InCl6]3–, [InCl5(H2O)]2– и т. д. Тригалоге-
ниды таллия менее стабильны:
o
2TlCl3 →80 C Tl[TlCl4] + Cl2
o
Tl[TlCl4] →180 C TlCl + Cl2
Для галлия такая диссоциация наблюдается при 1030 °С. Таллий, в отличие от остальных элементов группы, образует устойчивые комплексы с хлорид-ионами (к.ч. = 4 и 6):
TlCl3 + HCl(конц) + 3H2O = HTlCl4 · 3H2O
Также известны K3TlCl6, K4Tl2Cl10. Устойчивость галогенидов MeX возрастает вниз по группе, распад протекает по схеме:
3AlX = 2Al + AlX3
TlX похожи на галогениды серебра. Выделены MeI[MeIIIX4], они неустойчивы. Трихлорид и трибромид Tl – сильные окислители. Безводный TlI3 не получен ни в твёрдом виде, ни в водных растворах. При йодировании соединений TlI в органических растворителях, при упаривании эквимольных количеств монойодида таллия и йода в концентрированном растворе йодоводородной кислоты или при добавлении йодида калия к водному раствору солей TlIII образуются кристаллы полийодида таллия (I) Tl[I·I2] чёрного цвета. Однако в присутствии избытка йодид-ионов TlIII стабилизируется за счёт образования комплексного иона [TlIIII4]–.
14

Оксиды и гидроксиды
Сведения о структурных типах оксидов и гидроксидов алюминия представлены в таблице 2.
Таблица 2
Структурные типы оксидов и гидроксидов алюминия [6]
Формула |
Название минерала |
Идеализированная структура |
α-Al2O3 |
Корунд |
ГПУ из ионов О, ионы Al занимают ⅔ октаэдри- |
|
|
ческих позиций |
α-AlO(OH) |
Диаспор |
ГПУ из ионов О и ОН с цепочками октаэдров, |
|
|
образующими слои, которые объединены водо- |
|
|
родными связями, атомы Al в определённых по- |
|
|
зициях |
α-Al(OH)3 |
Байерит |
ГПУ из ионов ОН, ионы Al занимают ⅔ октаэд- |
|
|
рических позиций |
γ-Al2O3 |
– |
КПУ из ионов О (дефектная шпинель), ионы Al в |
|
|
23 ⅓ из 16 октаэдрических и 8 тетраэдрических |
|
|
позиций |
γ-AlO(OH) |
Бемит |
КПУ из ионов О и ОН в пределах слоёв, детали |
|
|
не ясны |
γ-Al(OH)3 |
Гиббсит |
КПУ из ионов ОН в пределах слоёв из Al(OH)6, |
|
(гидраргиллит) |
объединённых рёбрами; октаэдры образуют вер- |
|
|
тикальные стопки посредством водородных свя- |
|
|
зей |
Корунд Al2O3 характеризуется двухслойной плотнейшей шаровой упаковкой из ионов кислорода, в октаэдрических пустотах находятся ионы Al (рис. 9). Корунд по твердости близок к алмазу, химически инертен. Он не растворяется в растворах кислот и щелочей, может быть растворен только в расплавленной щелочи.
Рис. 9. Кристаллическая структура корунда (показаны октаэдры AlO6, в вершинах которых находятся атомы O) [2]
15
γ-модификацияAl2O3 более активна, чем корунд:
γ-Al2O3 + 7H2O + 2NaOH = 2Na[Al(OH)4(H2O) 2]
γ-Al2O3 + 9H2O + 3H2SO4 = [Al(H2O)6]2(SO4)3
Ga2O3 по структуре и свойствам похож на Al2O3, In2O3 имеет кубическую структуру. Если температура плавления корунда Al2O3 равна 2045 °С, то tпл Tl2O3 намного ниже – 716 °С. Оксид таллия можно получить следующим образом:
2TlNO3 + 6KOH + 2Cl2 = Tl2O3↓ + 2KNO3 + 4KCl + 3H2O
Гидроксиды Al, Ga, In можно получить следующим образом:
Al2(SO4)3 + 6NH3 + (x+3)H2O = Al2O3 xH2O↓ + 3(NH4)2SO4
Они практически нерастворимы в воде. Гидроксиды Al и Ga легко растворяются в щелочах. Гидроксид индия выделен в свободном состоянии, выше 300 °С частично теряет воду и переходит в InO(OH), который при дальнейшем нагревании переходит в оксид. Гидроксоиндаты образуются при pH >13. Tl2O3 растворим только в кислотах. Термическая стабильность оксидов и гидроксидов уменьшается вниз по группе, окислительные свойства увеличиваются:
o
Tl2O3(тв) 100 C→ Tl2O(тв) + О2
Tl2O3 + 6HCl = TlCl↓ + 3H2O + 2Cl2
Отличие таллия от других элементов данной подгруппы проявляется и в оксидах, и в гидроксидах – для него характерна степень окисления +1. Tl2O образуется в виде чёрных пластинчатых кристаллов при нагревании Tl2СO3 в N2 при 700 °С. Tl2O гигроскопичен, реагирует с H2O c образованием гидроксида. TlOH хорошо растворим и является сильным основанием.
В особых условиях могут быть получены Ga2O, Al2O, In2O.
Соли и комплексные соединения
Амфотерные Al, Ga, In образуют 2 ряда солей – катионные и анионные. Для Tl анионные формы малохарактерны.
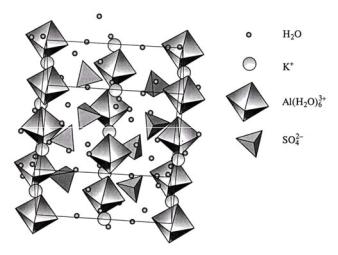
Рис. 10. Строение алюмокалиевых квасцов. Октаэдры [Al(H2O) 6]3+ и [K(H2O) 6]+ чередуются с тетраэдрами SO42- [2]
16
MeIMeIII(SO4)2 · 12H2O, где MeI = K, Rb, Cs, NH4+; MeIII = Al, Ga, In, Tl,
Ti, V, Cr, Fe и т. д. – это квасцы (рис. 10). Октаэдрические катионы [MeIII(H2O) 6]3+ и [MeI(H2O) 6]+ связаны с сульфат-анионами за счет водород-
ных связей.
Соли алюминия и галлия co слабыми кислотами не могут быть выделены из растворов, т. к. подвергаются полному необратимому гидролизу. Сверху вниз склонность к гидролизу ослабевает. Так, сульфид индия уже можно осадить сероводородом из слабокислого раствора сульфата индия:
In2(SO4)3 + 3H2S + 3CH3COONa = In2S3↓ + 3NaHSO4 + 3CH3COOH
В растворе присутствуют разные катионные формы Al, Ga, In: [Me(H2O)6]3+ ←→ H+ + [M(H2O)5OH]2+
С повышением pH равновесие сдвигается ещё дальше вправо, затем происходит полимеризация этих комплексов в многоядерные.
Соли Tl(I) напоминают по свойствам соединения Ag и K (подобно калию образует хромовые квасцы, подобно серебру – галогениды на свету разлагаются, сильными кислотами не гидролизуются).
Анионные формы: [Al(OH)4(H2O) 2]–, [Ga(OH)4(H2O)2]–, MeIII2O3 + Me2CO3 2MeIMeIIIO2 + CO2↑
Аналогичным образом получают шпинели MeIIMeIII2O4 (где MeII = Mg, Ca,…).
Применение
Бор применяют как полупроводниковый материал, компонент коррозионностойких и жаропрочных покрытий, материалов для регулирующих устройств ядерных реакторов. α-BN – сухая смазка подшипников, огнеупор, термостойкое волокно. β-BN – сверхтвердый абразив. Борогидридные комплексы широко применяются в органическом и неорганическом синтезе как восстановители и катализаторы процессов полимеризации.
Алюминий и его сплавы – конструкционные материалы. Наиболее используемые сплавы: дюралюминий (медь – 4 %, марганец – 0,5 %, магний – 1,5 %, кремний и железо – доли процента); силумин – (16 % кремния); алюминиевая бронза (89 % меди); сплавы с титаном. Алюминий используется для получения металлов (алюмотермия), в электротехнике, для упаковки (алюминиевая фольга). Корунд – абразивный материал. Кристаллические разновидности корунда являются драгоценными камнями. Синтетические рубины применяют для изготовления твердотельных лазеров. Квасцы KAl(SO4)2 ·12H2O – протрава в текстильной промышленности, используется для дубления кож. Сульфат алюминия используется при очистке воды.
Бинарные соединения типа AIIIBV находят широкое применение в полупроводниковой технике. Соединение MgGa2O4, активированное примесями типа Mn2+, используется в активируемых в УФ свете порошках как ярко-
17
зелёный люминофор. Галлий в меньшей степени используется в высокотемпературных жидких затворах, в виде манометрической жидкости и теплоносителя, а также в низкотемпературных припоях. Галинстан – сплав 68,5 % галлия, 21,5 % индия и 10 % олова с температурой плавления –19 оС – заменитель ртути в термометрах.
Индий используется в низкоплавких сплавах и в электронных устройствах. В плавких защитных устройствах, регуляторах нагрева применяются сплавы In с Bi, Cd, Pb и Sn (Tпл 50 – 100 оС), которые также используются для пайки полупроводниковых стержней при низкой температуре. InAs и InSb используются в низкотемпературных транзисторах, термисторах и оптических устройствах (фотопроводниках), а InP – в высокотемпературных транзисторах.
Специальные области применения таллия – в инфракрасной технологии, так как TlBr и TlI прозрачны для длинноволнового излучения, возможно их использование в фоточувствительных диодах и ИК-детекторах. Водные растворы формиата и малоната таллия используются для разделения небольших количеств минералов и определения их плотности, т. к. насыщенные растворы, содержащие примерно равные массы этих солей (жидкость Клеричи), имеют плотность 4,324 г/см–3 при 20 оС. Меньшие плотности можно получить при разбавлении.
ГЛАВА 2. IIIВ-ГРУППА
2.1.Подгруппа скандия. Простые вещества
ВIIIВ-группу (побочную подгруппу III группы) входят: скандий – Sc (№ 21), иттрий – Y (№ 39), лантан – La и лантаниды (№ 58–71), актиний – Ac (№ 57) и актиниды (№ 90–103) – радиоактивные. Здесь наблюдается наименьшее различие в свойствах между элементами главной и побочной подгрупп, и только здесь свойства типических элементов (B, Al) более закономерно укладываются в ряд с элементами IIIВ-группы, чем с остальными элементами IIIА-группы [3, 4].
Закономерность изменения свойств в IIIВ-группе
Элементы IIIВ-группы в Периодической системе располагаются в начале блока переходных элементов, поэтому они обладают переходными свойствами: каждый элемент более электроотрицателен, чем его предшественник из 2-й группы, но менее электроотрицателен, чем последующие переходные элементы. На рис. 11 приведены относительные электроотрицательности элементов 3-й группы, из рисунка видно, что по данному свойству элементы В-группы более близки к типическим элементам 3-й группы.
18
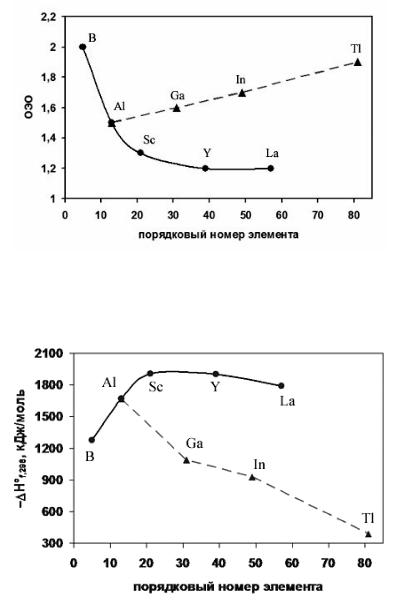
Рис. 11. Относительная электроотрицательность элементов III группы [6]
Подобные зависимости в изменения свойств наблюдаются и в рядах однотипных соединений, например при рассмотрении энтальпий образования соответствующих оксидов элементов (рис. 12).
Рис. 12. Энтальпии образования оксидов Э2O3 [6]
Оксиды элементов подгруппы скандия характеризуются наибольшими (по абсолютной величине) энтальпиями образования. Это одни из самых прочных (термодинамически) оксидов.
Электронная конфигурация
Электронная конфигурация элементов подгруппы скандия [R](n-1)d1ns2, где R – конфигурация предыдущего благородного газа; n – номер главного квантового числа, совпадающий с номером периода. В степени окисления +3 эти элементы имеют электронную конфигурацию предыдущего благородного газа и являются полными электронными аналогами типических элементов (B и Al). Поскольку они возглавляют соответствующие d-ряды, на них не сказывается ни d-, ни f-cжатие. Поэтому их свойства
19
меняются так же, как в IА- и IIА-группах. Этим и объясняется монотонность изменения свойств в ряду B – Al – Sc – Y – La, в котором характерно нарастание «металличности». Химия скандия как кайносимметричного элемента несколько отличается от иттрия, лантана и лантанидов, которые со-
вместно называется редкоземельными элементами (РЗЭ). Поэтому IIIB-
группу обычно называют «подгруппа скандия и РЗЭ».
Открытие элементов
Иттрий открыт в 1734 г. шведским химиком Гадолином, выделен в свободном состоянии в 1828 г. (Велер – восстановлением YCl3 натрием). Лантан открыт в 1939 г. Люзандером. Скандий – один из трех «элементовукрепителей» Периодической системы. Предсказан Д.И. Менделеевым в 1871 г. (экабор). Открыт в 1879 г. (через 8 лет) шведским химиком Нильсоном.
Нахождение в природе
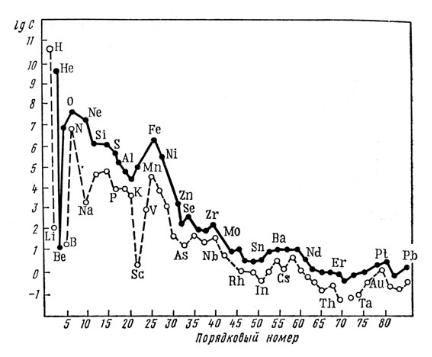
Содержание скандия и каждого из РЗЭ на Земле оценивается величиной порядка 10–3 – 10–4 масс. %, что существенно больше, чем, например, бора, кадмия, ртути, селена и др. Строго говоря, РЗЭ – далеко не редкие элементы. Общая закономерность, согласно которой четные элементы распространены на Земле (и в Солнечной системе) больше, чем нечетные, наглядно проявляется в семействе лантанидов (рис. 13 и 14).
Рис. 13. Относительная распространенность элементов в Солнечной системе:
• – четные элементы, ○ – нечетные элементы
Скандий встречается в природе отдельно от РЗЭ и образует собственные минералы: фосфат ScPO4 · 2H2O – стереттит, силикат Sc2Si2O7 – тортвейтит. Он также содержится как примесь в касситерите (SnO2), вольфра-
20
