
3_i_4_gruppy_1
.pdf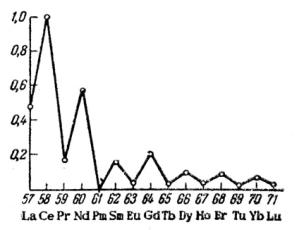
мите (Mn,Fe)WO4 и др. Всего известно более 100 минералов, в которых обнаружен скандий.
Рис. 14. Относительное содержание лантанидов в земной коре. Содержание Ce (4,5·10–3 масс. %) принято за 1
Y и La встречается исключительно вместе с лантанидами. При этом лантаниды (Ce – Sm) ближе к лантану и образуют «цериевую группу». Остальные лантаниды (Eu – Lu) ближе к иттрию и образуют «иттриевую группу». Образуемые минералы: монацит – фосфат металлов цериевой группы (La, Ce, Nd, …)PO4, ксенотим – фосфат металлов иттриевой группы (Y, Eu, Gd, …)PO4, прометий (№ 61) – единственный из лантанидов, не встречающийся в природе. Этот радиоактивный элемент был впервые синтезирован искусственно в 1947 г.
Получение металлов
Общий способ получения – магнийили кальцийтермическое восстановление из фторидов, в которые предварительно переводятся природные концентраты:
o
2MeF3 + 3Ca →t C 3CaF2 + 2Me
Так без проблем получают металлический скандий. РЗЭ требуется сначала разделить, что представляет трудную технологическую задачу вследствие ярко выраженной близости химических свойств, но современные методы хроматографии и экстракции позволяют решить эту задачу. После разделения проводят кальцийили магнийтермию фторидов или электролиз расплавов хлоридов.
Простые вещества
Sc, Y, La – серебристо-белые металлы, тускнеют во влажном воздухе. Кристаллическая решетка ГПУ (типа Mg). Скандий диморфен:
o
ГПУ →1334 C ОЦК
21
Плотность закономерно возрастает: Sc (3,0 г/см3) → Y (4,7 г/см3) → La (6,2 г/см3). Для сравнения: d(Al) = 2,7 г/см3; d(Fe) = 7,8 г/см3. Температуры плавления понижаются: Sc (1539 ºC) → Y (1509 ºC) → La (920 ºC).
Для сравнения tпл(Fe) = 1536 ºC, а tпл(Al) = 660 ºC. Все эти металлы механически весьма пластичны и ковки.
Химические свойства Sc, Y, La
Sc, Y, La принадлежат к химически активным металлам. Их стандартные электродные потенциалы равны: Eº(Sc3+/Sc) = – 2,08 B; Eº(Y3+/Y) = – 2,37 B; Eº(La3+/La) = – 2,52 B. Для сравнения: Eº(Be2+/Be) = – 1,85 B; Eº(Mg2+/Mg) = – 2,36 B; Eº(Сa2+/Ca) = – 2,87 B. Таким образом, иттрий по величине Eº соответствует магнию, а лантан еще более активен. Даже скандий превосходит бериллий. Эти металлы энергично взаимодействуют с растворами неокисляющих кислот с выделением водорода:
2Э + 6HCl→ 2ЭCl3 + 3H2↑
Y и La подобным же образом разлагают воду по схеме:
2Э + 6H2O → 2Э(OH)3 + 3H2↑
Sc не взаимодействует с водой вследствие наличия пассивирующей пленки оксида (подобно Al). Металлический Sc (опять же подобно Al) проявляет признаки амфотерности – медленно растворяется в концентрированных щелочах с выделением водорода:
2Sc + 6NaOH + 6H2O → 2Na3[Sc(OH)6] + 3H2
гексагидроксоскандат
натрия
Таким образом, в ряду Sc – Y – La, и в целом, в ряду B – Al – Sc – Y – La усиливается металлический характер элементов (как в IA- и IIAгруппах). По химическому поведению La уже напоминает Mg и Ca. Актиний еще более металличен. Во всех своих соединениях Sc, Y, La проявляют степень окисления +3.
2.2. Соеднинения элементов IIIB-группы
Характеристические соединения
Оксиды являются самыми прочными кислородными соединениями:
Оксид |
Sc2O3 |
Y2O3 |
La2O3 |
∆Hºf,298 кДж/моль |
–1908 |
–1904 |
–1795 |
Для сравнения: ∆Hºf,298(Al2O3) = – 1676 кДж/моль. Оксиды Sc2O3, Y2O3, La2O3 труднорастворимы в воде, но энергично с ней взаимодействуют
с образованием гидроксидов (подобно MgO и СaO):
Э2O3 + 3H2O → 2Э(OH)3 + Q (процесс экзотермичен)
В чистом виде оксиды получают прокаливаем гидроксидов, нитратов, карбонатов:
o
2Э(NO3)3 →t C Э2О3 + 6NO2 + 3/2O2
22
|
|
|
t oC |
+ 3СО2 |
||
|
|
Э2(СO3)3 → Э2О3 |
||||
Гидроксиды Э(OH)3 труднорастворимы в воде. От Sc к La произведе- |
||||||
ние растворимости несколько возрастает: |
|
|
||||
|
Гидроксид |
Sc(OН)3 |
Y(OН)3 |
La(OН)3 |
|
|
|
ПР |
|
1 · 10–28 |
2 · 10–23 |
1 · 10–19 |
|
Их можно получить осаждением из растворов солей водным раствором аммиака или щелочей. От Sc(OH)3 к La(OH)3 усиливается основной ха-
рактер гидроксидов (Кb – константа диссоциации по основному типу):
Kb (Sc(OH)3) = 5 · 10–13; Kb (La(OH)3) = 5 · 10–4. Для сравнения: Kb (Ba(OH)2) = 2 · 10–1; Kb (Mg(OH)2) = 5 · 10–4; Kb (NH3 · H2O) = 1,8 · 10–5. У Sc(OH)3 ки-
слотный характер выражен слабо. Y(OH)3 незначительно растворим в концентрированных растворах NaOH, но выделить соответствующие соединения не удается. La(OH)3 cо щелочами вообще не взаимодействует (еще более основный характер у Ac(OH)3. Sc(OH)3 амфотерен:
[Sc(H2O)6]3+ ←→ [Sc(H2O)5OH]2+ + H+, Ка = 1 · 10–5,
где Ka – константа диссоциации по кислотному типу. Sc(OH)3 растворим в горячем концентрированном растворе NaOH:
Sc(OH)3 + 3NaOH → Na3[Sc(OH)6]
Можно выделить кристаллогидрат, который при нагревании постепенно обезвоживается:
120 o C |
300 o C |
Na3[Sc(OH)6]·2H2O → Na[Sc(OH)4] + 2NaOH + 2H2O → |
|
300 o C |
+ H2O |
→ NaScO2 |
|
Na3[Sc(OH)6] · 2H2O – гексагидроксоскандат натрия дигидрат, Na[Sc(OH)4] – тетрагидроксоскандат натрия, NaScO2 – метаскандат натрия. Сухим путем (не в растворах) получены метаскандаты MeIScO2 (MeI = Li, Na, K, Rb) и MeII(ScO2)2 (MeII = Ca, Sr). В водных растворах эти соединения полностью гидролизованы по аниону.
Соединения с неметаллами
Галогениды ЭHal3 тугоплавки и труднолетучи. От фторидов к иодидам температуры плавления уменьшаются, оставаясь высокими. Следовательно, реализуется преимущественно ионная связь и галогениды имеют солеобразный характер, о чём свидетельствуют данные таблицы 3.
Таблица 3
Температуры плавления галогенидов скандия и лантана
Соединение |
ScF3 |
ScCl3 |
ScBr3 |
ScI3 |
tпл, ºC |
1530 |
939 |
960 |
945 |
Соединение |
LaF3 |
LaCl3 |
LaBr3 |
LaI3 |
tпл, ºC |
1430 |
855 |
786 |
761 |
23
Sc, Y, La энергично взаимодействуют с галогенами (в хлоре и парах брома – горят). Фториды ЭF3 труднорастворимы в воде. Хлориды, бромиды, иодиды хорошо растворимы, выделяются из растворов в виде кристаллогидратов, например:
ЭCl3 · 6H2O (Э = Sc, Y) или LaCl3 · 7H2O
При нагревании галогенидов на воздухе одновременно с обезвоживанием происходит частичное или полное замещение галогена на кислород
o
ScHal3 →t C Sc2O3
o
YHal3 →t C YOHal
o
LaHal3 →t C LaOHal
Поэтому безводные галогениды часто получают нагреванием оксидов с углем в атмосфере галогена. Например:
La2O3 + 3C + 3Cl2 → 3CO↑ + 2LaCl3
Скандий склонен к образованию комплексных фторидов в растворах MeI[ScF4], MeI2[ScF5], MeI3[ScF6]. Осадок ScF3 может быть растворен действием NH4F:
3NH4F + ScF3 → (NH4)3[ScF6]
Сплавлением безводных солей получены: K3[YF6] (tпл = 996 ºС),
Rb3[YF6] (tпл = 1064 ºС), Cs3[YF6] (tпл = 1075 ºС), Cs3[LaF6] (tпл = 795 ºС). C
фторидами других щелочных металлов подобные соединения Y и La не образуют. Известен единственный комплексный хлорид скандия: K3[ScCl6] (tпл = 818 ºС), также получаемый сплавлением безводных солей.
Халькогениды
Халькогениды (главным образом, сульфиды) состава Э2Х3 могут быть получены непосредственным синтезом из элементов или накаливанием оксидов, хлоридов в атмосфере H2S или парах сероуглерода CS2, например:
o
2Э2O3 + 3CS2 →t C 2Э2S3 + 3CO2
Помимо желтых Sc2S3, Y2S3 и La2S3 известны: фиолетовый Sc2Se3, серый Y2Se3, черный Sc2Te3, красный La2Se3. Это полупроводники с n-типом проводимости. Для иттрия и лантана известны и довольно характерны полисульфидные производные типа Э2S4, а также оксохалькогениды: белый Y2O2S, желтый La2O2S. Э2O2Se – оксоселениды. Оксосульфиды (используемые в качестве люминофоров) синтезируют спеканием порошкообразных оксидов и сульфидов:
o
2Э2О3 + Э2S3 →t C 3Э2О2S
Все халькогениды легко гидролизуются даже во влажном воздухе. Известны халькогениды ЭХ, формально отвечающие степени окисления +2: красный YS, желтые LaS, LaSe, LaTe. Они обладают высокой электропро-
водностью, т. е. в них существуют Э+3 и свободные электроны:
Э+3Х–2(ē).
24

Пниктогениды
Нитриды Sc, Y, La отвечают составу ЭN, подчиняются правилу формальной валентности и кристаллизуются в структурном типе NaCl. Лантан при накаливании в атмосфере газообразного N2 непосредственно взаимодействует с ним, образуя LaN (подобно Li и Mg). Однако при накаливании на воздухе он (в отличие от Li и Mg) образует только оксид La2O3 (очень высокое сродство к кислороду). Обычно нитриды получают взаимодействием оксидов с углеродом. При высокой температуре в атмосфере N2 (подобно галогенидам в атмосфере Hal):
o
Э2О3 + 3С + N2 →t C 2ЭN + 3CO
Нитриды устойчивы к нагреванию (ScN плавится при 2650 ºС без разложения). Для лантана прямым синтезом получены: LaP (фосфид), LaAs (арсенид), LaSb (антимонид) и даже LaBi (висмутид) (структурный тип NaCl). Следует отметить, что элементы IIIА-группы (Al, Ga, In) висмутидов не образуют.
Гидриды
Для Sc, Y, La известны серо-черные гидриды ЭH2. Для Y и La, кроме того, существуют ЭH3 – металлоподобные фазы внедрения (односторонние фазы переменного состава). В составе интерметаллического соединения LaNi5 (рис. 15) лантан поглощает значительное количество водорода (сам никель мало растворяет водород). При этом объем элементарной ячейки возрастает на 25 %.
Рис. 15. Металлид LaNi5 (a) и продукт его гидрирования LaNi5H7 (б) [2]
Карбиды
Лантан образует карбиды LaC2 и La2C3 (рис. 16), это ацетилениды, содержащие «ионы» С22– (подобно CaC2). Их получают нагреванием смеси оксида с углем, например:
o
La2O3 + 3C →1000 C 2LaC2 + 3CO
25
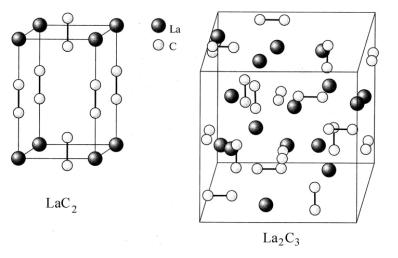
Рис. 16. Карбиды лантана. LaC2 изоструктурен CaC2 [2]
В отличие от CaC2 карбид LaC2 обладает высокой электропроводностью. Поэтому полагают, что здесь (как и в халькогенидах ЭХ) присутствуют La+3 и свободные электроны La+3C2–2(ē). Карбиды полностью разлагаются водой с выделением смеси углеводородов (С2H2, CH4, C2H4, …), например:
2LaC2 + 6H2O → 2La(OH)3 + C2H2 + C2H4
Соли кислородсодержащих кислот и комплексные соединения
Поскольку Sc, Y, La – достаточно активные металлы, то соли кислородсодержащих кислот для них весьма характерны и разнообразны. По комплексообразовательной способности они уступают d-элементам, но часто характеризуются высокими координационными числами (7, 8, 9 и более). Нитраты Sc(NO3)3, Y(NO3)3, La(NO3)3 легко растворимы в воде. При кристаллизации образуют кристаллогидраты: Sc(NO3)3 4H2O, Y(NO3)3 6H2O, La(NO3)3 6H2O (аквакомплексы с к.ч. 4 и 6).
Сульфаты Э2(SO4)3 растворимы, но с ростом температуры растворимость уменьшается. При выделении из растворов образуют кристаллогид-
раты: Sc2(SO4)3 6H2O, Y2(SO4)3 8H2O, La2(SO4)3 9H2O.
Ссульфатами щелочных металлов образуют комплексы: MeI[Э(SO4)2]
иMeI3[Э(SO4)3]. При электролизе раствора Sc2(SO4)3 часть скандия передвигается к аноду, то есть раствор сульфата скандия – автокомплекс Sc[Sc(SO4)2]3, который диссоциирует по схеме:
Sc[Sc(SO4)2]3 ←→ Sc3+ + 3[Sc(SO4)2]–
26
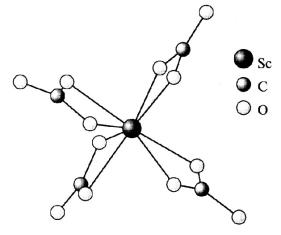
Рис. 17. Строение аниона в кристаллической структуре Na5[Sc(CO3)4] 2H2O [2]
Карбонаты Э2(СО3)3 труднорастворимы в воде, легко образуют основные соли Э(OH)CO3 (гидролиз) и могут быть получены только в избытке СО2. При этом образуются комплексы с карбонат-ионами в качестве лиган-
дов: K[Sc(CO3)2], Na[La(CO3)2], Na5[Sc(CO3)4] 2H2O (рис. 17) и т. д.
Фосфаты ЭPO4 почти нерастворимы в воде и труднорастворимы в кислотах (ПР(LaPO4) = 4 10–23). Для скандия характерен пирофосфат ScHP2O73H2O. Существует YPO4, который встречается в природе (минерал ксенотим).
2.3.Элементы f-блока
Особенности
В6-м периоде впервые появляются элементы, у которых заполняется пропущенный ранее глубоко лежащий (3-й снаружи) 4f-подуровень, вмещающий 14 электронов. Его заселение мало влияет на свойства элементов
№58–71 (Ce–Lu). Для них характерна степень окисления +3, они очень близки по свойствам, во многих отношениях подобны лантану, вместе с ним располагаются в одной клетке в IIIB-группе и называются – лантаниды. Близость химических свойств, связанная с ней трудность разделения и выделения в свободном виде – причина многих сложностей и ошибок в истории открытия лантанидов.
Названия элементов и распространение в природе
Заметную роль в открытии лантанидов (и вообще элементов III В-группы) сыграли шведские ученые. Поэтому название многих элементов имеют «скандинавское» происхождение (8 из 17): Скандий Sc – Скандинавия; Иттрий Y, Эрбий Er, Тербий Tb, Иттербий Yb – селение Иттербю (Itterby) в Швеции, где существует залежи монацитового песка; Гадолиний Gd – минерал гадолиней (в честь шведского химика Гадолина); Гольмий
27
Ho – Стокгольм (лат. Holmia); Тулий Tm (Tu) – Thule (старое название северных стран).
По распространенности (~ 10–3 – 10–4 масс. %) эти элементы не самые редкие. Самый малораспространенный среди них – тулий (8 · 10–5 масс. %) – превосходит содержание хорошо известного иода (4 · 10–5 масс. %).
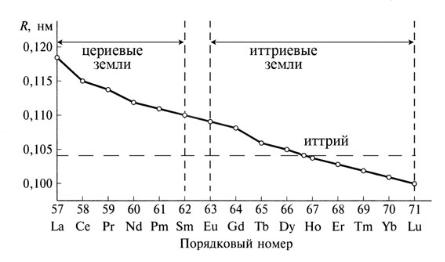
Лантанидное сжатие
Этот эффект объясняет ряд закономерностей в изменении свойств соединений лантанидов, а также оказывает влияние на свойства последующих элементов 6 периода (контракционная аналогия). Иттрий по величине ионного радиуса оказывается примерно между диспрозием и гольмием. Этим и обусловлено геохимическое разделение лантанидов на иттриевые земли (Eu…Lu) и цериевые земли (Ce…Sm). Первые встречаются в минерале ксенотиме (Y, Eu, Gd…)PO4, а вторые – в минерале монаците (Ce, La,…)PO4.
Ионный радиус Sc (0,083 нм) заметно меньше, чем даже у последнего лантанида – Lu (0,099 нм). Поэтому его химия несколько отличается от химии лантанидов, в которую, в целом, вписываются Y и La. Именно по этой причине IIIВ-группа называется «подгруппа скандия и РЗЭ» (актиний и актиниды как радиоактивные элементы принято рассматривать отдельно).
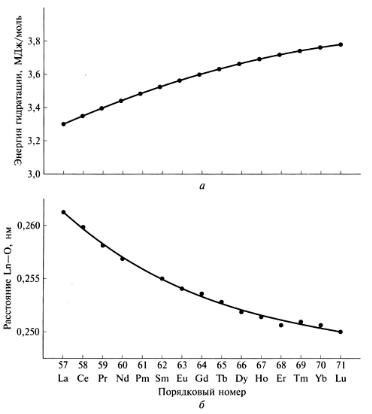
Монотонное уменьшение радиуса (рис. 18) приводит к монотонному уменьшению длин связей в однотипных соединениях, например, связи Ln – О (здесь и далее символом Ln будут обозначаться элементы-лантаниды) в аквакомплексах [Ln(H2O)n]3+, а следовательно, к монотонному увеличению энергии гидратации (рис. 19), т. е. прочности аквакомплексов.
Рис. 18. Изменение ионных радиусов лантанидов [2]
При уменьшении ионного радиуса Ln3+ возрастает поляризующее действие катиона, уменьшается ионный вклад в химическую связь в однотипных соединениях, например, монотонно уменьшается растворимость гидроксидов в воде и ослабляется их основный характер:
28
-lgПР(Ln(OH)3) |
Nd |
Pm |
Sm |
Eu |
Gd |
||
La |
Ce |
Pr |
|||||
18,9 |
20,1 |
21,1 |
21,5 |
21,8 |
22,1 |
22,5 |
22,7 |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
22,9 |
23,1 |
23,2 |
23,3 |
23,5 |
23,6 |
23,7 |
|
Рис. 19. Изменение энергии гидратации ионов Ln3+ (а) и расстояния Ln-О(H2O) (б) в комплексе [Ln(H2O)9](C2H5-O-SO3)3 в ряду 4f-элементов [2]
При этом гидроксиды последних лантанидов «заскакивают» за Y(OH)3, но «не дотягивают» до Sc(OH)3 – явных признаков амфотерности в растворах не обнаружено. Здесь заметна и более тонкая закономерность – pПР для гидроксидов элементов 2-й семерки меняется менее значительно, чем для элементов 1-й семерки. В этом проявляются горизонтальная аналогия (неравноценность первой и второй семерок), которая, в свою очередь, является следствием внутренней периодичности, обусловленной особенностями заполнения 4f-уровня. Внутренняя периодичность – важная закономерность в изменении свойств элементов и их соединений. Она обусловлена тем, что вырожденные орбитали (p-, d-, f-, …) заселяются в соответствии
справилом Гунда так, чтобы суммарное спиновое число было максимально.
Всемействе лантанидов существуют некоторые особенности заселе-
ния f-уровня, обусловленные особой стабильностью полностью вакантных, наполовину завершенных (f 7) и полностью завершенных (f 14) конфигураций (рис. 20).
29
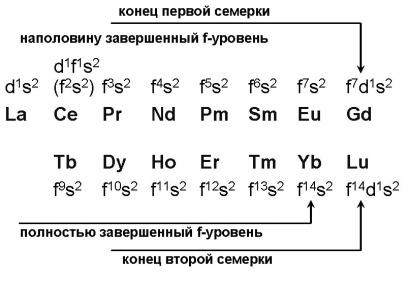
Рис. 20. Строение электронных оболочек лантанидов
Принципиально важно, что впервые стабильные конфигурации f 7 и f 14 достигаются не у последних элементов в семерках, а у предпоследних (Eu и Yb). У последних элементов (Gd, Lu) при сохранении стабильных f 7, f14-конфигураций очередной электрон заселяет 5d-уровень. Валентная конфигурация Gd и Lu оказывается аналогичной конфигурации La, для них характерна единственная степень окисления +3.
Для всех лантанидов характерна степень окисления +3, но в связи с особенностями заполнения 4f-уровня у предпоследних элементов в семерках (Eu, Yb), кроме того, реализуется степень окисления +2, что обусловлено повышенной стабильностью f 7 и f 14-оболочек. Эта степень окисления также наблюдается у их непосредственных предшественников (Sm, Tm), хотя для Sm и не столь ярко выражена, а для тулия – очень слабо.
У первых элементов семерок (Ce – f 2s2 и Tb – f 9s2 = f 7+ f 2 + s2) на f-уровне лишь 2 электрона сверхустойчивой конфигурации f 0(f 7). Поэтому кроме степени окисления +3 у них реализуется повышенная степень окисления +4, которая также наблюдается у ближайшего соседа церия – празеодима, хотя и не столь характерна. У соседа тербия – диспрозия этот эффект не наблюдается (большая близость свойств элементов второй семерки). В целом характерные степени окисления лантанидов в сравнении с их предшественником Ba и последующим элементом Hf представлены на рис. 21.
30
