
3_i_4_gruppy_1
.pdfSnO2 имеет структуру типа рутила, амфотерен с преобладанием основных свойств, нерастворим в воде и разбавленных растворах кислот и щелочей.
o
SnO2 + 2NaOH(расплав) →t C Na2SnO3 + H2O
При обработке водой станната натрия образуется Na2[Sn(OH)6]. Диоксиды GeO2 и SnO2 обладают слабыми окислительными свойствами:
o
ЭO2 + 2C →t C Э + 2CO↑
PbO2 получается при электролизе или окислении растворимых солей Pb(II) сильными окислителями:
Pb(CH3COO)2 + CaOCl2 + H2O = PbO2↓ + 2CH3COOH + CaCl2
В воде, разбавленных кислотах HCl, HNO3, H2SO4 и щелочах не растворяется. При взаимодействии с концентрированными кислотами проявляет себя как сильный окислитель:
PbO2 + 4HCl = PbCl2↓ + Сl2↑ + 2H2O
PbO2 способен окислять воду до кислорода. С концентрированными растворами щелочей может образовывать [Pb(OH)6]2– – гексагидроксоп- люмбат-ионы.
Также известны смешанные оксиды Sn3O4, Pb3O4
3PbO2 →300−500 o C Pb3O4 + O2
В Pb3O4 присутствуют Pb+2 и Pb+4, это можно доказать следующим образом:
Pb3O4 + 8CH3COOH(ледяная) = Pb(CH3COO)4 + 4H2O + 2Pb(CH3COO)2
Состав высших гидроксидов не соответствует H2ЭO3 или Э(OH)4. В действительности это ЭО2 · xH2O. Свойства определяются количеством
присоединенной H2O. Для Ge и Sn амфотерны, образуют анионные: Me2+1Э+4O3, Me2+1[Э+4(OH)6] и катионные Э+4(SO4)2, Э+4(CH3COO)4 формы.
Анионные формы: Na2GeO3, K4GeO4 – германаты, Na2SnO3, Ca2PbO4 – cтаннаты и плюмбаты. Катионные формы: Sn(SO4)2, Sn(NO3)4, Pb(CH3COO)4. Их получают сплавлением:
Na2CO3 + GeO2 = Na2GeO3 + CO2↑
2CaO + PbO2 = Ca2PbO4
Ca2PbO4 + 4HNO3 = PbO2↓ + 2Ca(NO3)2 + 2H2O
При гидролизе SnCl4 в присутствии NH3 образуется гидрат SnO2·nH2O. Свежеполученный осадок (α-оловянная кислота) растворяется в кислотах и щелочах. После стояния или слабого нагрева образуется β-оло- вянная кислота, растворимая только в расплавленных щелочах. Пониженная реакционная способность β-кислоты объясняется процессами поликонденсации, уменьшением числа активных OH-групп и образованием прочных связей Sn – O – Sn.
51
Соединения Э(II)
Все элементы в степени окисления +2 обладают неподеленной электронной парой, которая обуславливает их стереохимию и донорные свойства. Э(II) являются восстановителями, от Si к Pb восстановительная способность убывает. Растет термическая устойчивость и основные свойства.
GeO2 + Ge = 2GeO
GeO склонен к диспропорционированию, на воздухе медленно окисляется до GeO2. Оксиды Sn(II) и Pb(II) получаются при термическом разложении солей или гидратированных оксидов (II) без доступа воздуха:
o
Pb(NO3)2 →t C PbO + 2NO2 + O2
o
SnC2H4 →t C SnO + CO + CO2
При сильном нагреве SnO диспропорционирует:
o
2SnO →t C SnO2 + Sn
SnO имеет несколько кристаллических модификаций. Это типичное амфотерное соединение. В кислотах образуются соли и комплексы Sn(II), в
щелочах – [Sn(OH)3]–.
Гидроксостаннаты (II) диспропорционируют по схеме:
o
2Na[Sn(OH)3] →t C Sn + Na2[Sn(OH)6]
поэтому при растворении металла горячей щелочью образуются производ-
ные (IV):
Sn + 2NaOH + 4H2O = Na2[Sn(OH)6] + 2H2
Для PbO существуют кристаллические формы: красная тетрагональная (глет) и желтая ромбическая (массикот).
PbO + 2HNO3 = Pb(NO3)2 + 2H2O
PbO проявляет основные свойства, однако в концентрированных растворах щелочей растворяется – [Pb(OH)6]4–.
Водные растворы солей Pb более устойчивы к гидролизу и окислению, чем растворы аналогичных солей Sn(II). Восстановительные свойства соединений слабеют в рядах Ge(II) – Sn(II) – Pb(II). Ge(II) и Sn(II) в раство-
рах – сильные восстановители.
3Na[Sn(OH)3] + 2Bi(NO3)3 + 9NaOH = 2Bi + 3Na2[Sn(OH)6] + 6NaNO3
Соединения Pb(II) только в присутствии сильных окислителей проявляют восстановительные свойства:
2Pb(CH3COO)2 + Ca(OCl)2 + 4NaOH = 2PbO2↓ + 2CaCl2 + + 4CH3COONa + 2H2O
Галогениды
Соединения типа СHal4 существуют для всех галогенов, неполярные соединения, тетраэдрические молекулы. ССl4 не смешивается с водой и не реагирует с ней при обычных условиях – это говорит о валентной и координационной насыщенности.
52
CS2 + 3Cl2 = CCl4 + S2Cl2
o
Al2O3 + 3CCl4 →t C 2AlCl3 + 3COCl2 Si + 2Hal2 = SiHal4
Галогениды SiHal4 – координационно-ненасыщенные, поэтому гидролизируются (кроме SiF4) с выделением SiO2 · nH2O, а частично реагируют с выделением HF:
SiF4 + (n+2)H2O = H2SiF6 + SiO2 · nH2O↓ + 2HF,
При действии сухого хлороводорода на кремний образуется трихлорсилан:
o
Si + 3HCl →350 C SiHCl3 + H2O
В результате гидролиза образуется диоксид кремния: SiHCl3 + 2H2O = SiO2 + 3HCl + H2↑
SiHCl3 – сильный восстановитель.
При взаимодействии с галогенами остальных элементов подгруппы образуются GeHal4, SnHal4, но свинец образует PbHal2. ЭHal2 – для Ge и Sn. PbHal2 (кроме PbBr4 и PbI4).
PbO2 + 4HCl = PbCl4 + 2H2O
PbCl4 = PbCl2 + Cl2
Дигалогениды диспропорционируют по схеме: 2GеHal2 ←→ Ge + GeHal4
Хлорид олова SnCl2 не диспропорционирует, но является сильным восстановителем:
2BiCl3 + 3SnCl2 = 2Bi + 3SnCl4
Дигалогениды свинца – типичные соли.
Если проследить изменение стабильности 2 степеней окисления, то можно отметить следующее: у Si – диспропорционируют и SiO, и SiHal2. У Ge – GeO не диспропорционирует, а GeHal2 диспропорционирует. Sn – SnO
иSnHal2 не диспропорционируют, но являются восстановителями. Pb – PbO
иPbHal2 устойчивы. У Э+4 – основные свойства выражены слабо, ЭHal4 склонны к глубокому гидролизу:
ЭHal4 + 6H2O = 4HF + H2[Э(OH)6]
Их только формально можно рассматривать как соли слабого основания и сильной кислоты, а вообще, они являются координационно ненасыщенными соединениями, льюисовыми кислотами, склонными к комплексообразованию.
2НHal + ЭHal2 = H2[ЭHal6]
Для Ge известны фторокомплексы, Sn и Pb образуют комплексы со всеми галогенами, в том числе и H2[PbI6].
Соединения с другими неметаллами
Сероуглерод CS2
53
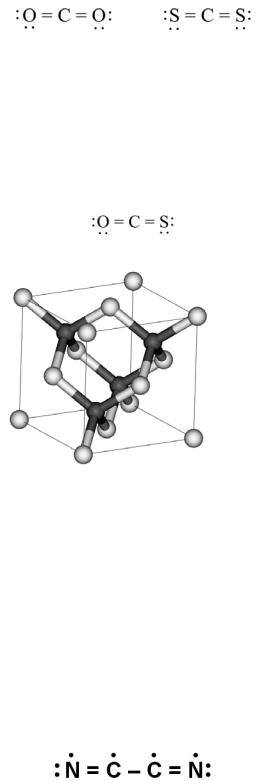
Сероуглерод имеет тот же стехиометрический состав, что и углекислый газ, но менее летуч, чем CO2. Молекула CS2 – линейная, как и CO2, содержит две двойные связи:
Сероуглерод горит в кислороде:
CS2 + 3O2 = CO2 + 2SO2
CS2 проявляет кислотные свойства:
СaO + CO2 = CaCO3 |
H2O + CO2 ←→ H2CO3 |
CaS + CS2 = CaCS3 |
H2S + CS2 = H2CS3 |
|
тиоугольная |
|
кислота |
Тиооксид углерода COS представляет собой полярную молекулу:
Карбид углерода, карборунд SiC
Рис. 36. Структура SiC
Карборунд относится к классу ковалентных карбидов наряду с карбидами бора. Имеет структуру алмаза (рис. 36) и, таким образом, может рассматриваться как продукт замещения части атомов углерода в структуре алмаза на атомы кремния, или, наоборот, – части атомов кремния в алмазоподобной структуре кремния на углерод.
Соединения с азотом
Под действием электрической дуги образуется (CN)2 – дициан. В молекуле дициана содержится нечетное число валентных электронов. Мономер:  . В линейной молекуле дициана имеются делокализованные π- связи между атомами:
. В линейной молекуле дициана имеются делокализованные π- связи между атомами:
По химическим свойствам дициан напоминает галогены (Hal2): Hal2 + Н2О ←→ НF + HOHal
54
(СN)2 + H2O ←→ HCN + HOCN
циановоциановая дородная
Существуют смешанные галогенцианы:
ClCN + 2NaOH ←→ NaCl + NaCNO + H2O
В растворе:
Таутомерия (динамическое равновесие между всеми изомерами):
Ион CN– изоэлектронен N2 (прочность, донорная активность). Способы получения синильной кислоты:
2CH4 + 2NH3 + 3O2 →Pt 2HCN + 6H2O
CO + NH3 → H2O + HCN
Формальная степень окисления углерода в данном случае +2, поэтому цианиды легко окисляются:
2КСN + O2 = 2KCNO
KCN + S = KCNS
циановая |
изоциановая |
гремучая |
кислота |
кислота |
кислота |
Третья форма содержит четырёхковалентный азот и трёхковалентный углерод. Ни в одной из форм водород не связан с углеродом! Соли гремучей кислоты – фульминаты. Это вещества, взрывающиеся от удара (используются как детонаторы):
Нg(ONC)2 = Hg(г) + 2СО + N2
Роданиды
Общая формула – MeICNS, они являются производными тиоциановой (родановой) кислоты HCNS.
KCNS + KHSO4 = HCNS + K2SO4
(в воздухе или Н2, без О2 и Н2О)
Ни в одной из форм водород не связан с углеродом. Водный раствор – родановодородная кислота – является сильной кислотой:
55
2КСNS + I2 = 2KI + (CNS)2
тиоциан или родан
Применение
Углерод: алмаз – драгоценный камень. Сажа – наполнитель резины и пластмасс, в типографских красках, копировальных средствах. Графит имеет важное значение в электротехнической (материал для изготовления электродов, трущихся частей динамо-машин), химической и атомной промышленности (материал для изготовления тиглей, замедлитель нейтронов и т. д.). Активированный уголь – замечательный адсорбент. CO2 используют для получения различных карбонатов, в первую очередь соды, для создания инертной атмосферы и кислой среды в неорганическом синтезе, при переработке бокситов. Его также используют при тушении пожаров. СО – высококалорийное топливо («водяной», «генераторный газ»), а также реагент в органическом синтезе (получение спиртов, углеводородов, альдегидов, карбоновых кислот). В неорганическом синтезе и в металлургии его используют как восстановитель, а также при синтезе карбонилов элементовметаллов. (NH2)2CO – мочевина – азотсодержащее удобрение. HCN применяется для синтеза нитрилов адипиновой и акриловой кислот при производстве нейлона.
Кремний – основа производства полупроводниковых приборов; его используют в радиоэлектронике, телемеханике, телеуправлении, в электронных счётно-решающих устройствах, фотоэлементах, служащих для преобразования световой энергии в электрическую, в выпрямителях переменного тока и т. д. Кварц – важнейший строительный материал и сырье в многотоннажных производствах стекла, цемента. Силикагель применяется для высушивания различных газов и очистки некоторых жидкостей (активно сорбирует пары воды и многих органических веществ). Также используется как сорбент при хроматографическом разделении и анализе смесей веществ различной химической природы как носитель каталитически активных веществ, при разделении смесей радиоактивных изотопов, для очистки промышленных сточных вод от ионов различных элементов-металлов. SiO – пигмент масляных красок и полирующее вещество, промежуточное соединение в процессе глубокой очистки при синтезе кремния полупроводниковой чистоты. Растворимое стекло (силикаты натрия и калия) используется для укрепления грунтов при строительных работах, изготовления замазок и склеивающих веществ, компонентов клея и дешёвых стиральных порошков. SiC – абразивный материал, компонент огнеупоров, служит стержнями сопротивления (силит) в электронагревательных приборах. Силициды используют для изготовления жаростойких и кислотоупорных сплавов, в качестве высокотемпературных
56
полупроводниковых материалов (CrSi2, CaSi2, ReSi2). Si3N4 – химически стойкий и огнеупорный материал, компонент коррозионностойких и тугоплавких сплавов и в качестве полупроводника. CS2 – неполярный растворитель неполярных веществ – жиров, масел, серы, фосфора и др.
Германий применяется в качестве полупроводника в электронике и радиотехнике (транзисторы). Тонкие плёнки германия, нанесённые на стекло, используются в качестве сопротивлений в радарных установках. Из монокристаллов германия изготавливают линзы для приборов ИК-оптики. Обладающие полупроводниковыми свойствами сплавы германия с рядом металлов применяются для изготовления кристаллических детекторов. GeO2 – промежуточный продукт при синтезе германия, при изготовлении люминофоров и специальных стекол с очень высоким коэффициентом преломления и большой плотностью. Из германиевого стекла изготавливают стекловолокно. Германаты – активаторы люминофоров.
Олово используют для лужения – для предохранения железа от ржавления. Широко используются сплавы олова: бронза (Sn + Cu), баббиты (Sn + Sb и Cu), типографские сплавы (Sn + Sb + Pb), припои (30 – 70 % Sn; 70 – 30 % Pb). α-Sn и CdSnAs2, SnTe – полупроводники.
SnO2 применяется для получения металлического олова, как компонент белых красок, эмалей, глазурей; в качестве катализатора органических реакций замещения и гидролиза; как полировочное средство; в полупроводниковой технике в виде тонких плёнок. SnO – чёрный пигмент при производстве рубинового стекла, как исходное соединение при синтезе различных солей SnII. Галогениды олова – протрава при крашении тканей. SnCl4 используется для получения дымовых завес и в качестве катализатора при хлорировании.
Области применения свинца: производство аккумуляторов, изготовление реакционных сосудов и камер в химической промышленности (из-за коррозионной стойкости), оболочек для электрических кабелей. Широко применяются сплавы свинца – припои, баббиты, типографские и подшипниковые сплавы. Металлический свинец и свинцовые стёкла (~80 % Pb) используют для защиты от гамма- и рентгеновских лучей. Тетраэтилсвинец Pb(C2H5)4 – антидетонатор, добавляемый к моторному топливу. Азид свинца – инициирующее взрывчатое вещество. PbO2 – окислитель в лабораторной практике и промышленности. Халькогениды свинца – полупроводники, используются в качестве выпрямителей, транзисторов, фотосопротивлений, термоэлектрических устройств. Материалы для ИК-оптики применяются при производстве экранов дисплеев.
57
ГЛАВА 4. IVB-группа
4.1. Простые вещества
Общая характеристика
Фактически эта группа открывает химию переходных d-элементов, т. к. элементы IIIВ-группы, открывающие d-ряды, практически ни в одном соединении не содержат d-электронов [1, 3]. В состав этой группы входят Ti, Zr, Hf и Rf – резерфордий. Rf – 1-й элемент, следующий за актинидами, его электронная конфигурация 5f145d27s2 аналогична конфигурации Hf 4f145d26s2. Он был получен в США на циклотроне, а обнаружен советскими учеными в продуктах спонтанного деления ядер. В основном состоянии атомы элементов IVB-группы имеют конфигурацию (n–1)d2ns2.
Суммарная энергия ионизации при переходе от Ti к Zr снижается, что обусловлено уменьшением энергии связи ns-электронов с ядрами; затем существенно не меняется. Из всех элементов группы лишь Ti проявляет высокую химическую активность. Атомный радиус заметно растет при переходе от Ti к Zr (увеличение числа электронных слоев), а затем к Hf – практически нет (лантанидное сжатие).
Для этих элементов наиболее характерна степень окисления +4, однако подавляющее большинство соединений, за исключением фторидов и оксидов ковалентные, в них отсутствуют ионы Мe4+. С ростом атомного радиуса степень ионности соединений аналогичного состава несколько увеличивается, возрастает Тпл и Ткип, повышается устойчивость к гидролизу. В ряду Ti – Zr – Hf устойчивость соединения с высшей степенью окисления возрастает. Так, для Ti устойчивы оксиды TiO, Ti2O3, TiO2 и фториды TiF2, TiF3, TiF4, а для Zr и Hf – только ZrO2, HfO2 и ZrF4, HfF4. Склонность к про-
явлению низких степеней окисления +2, +3 у титана выше, чем у его тяжелых аналогов. Так, в кислых водных растворах существуют акваанионы Ti(III), а аналогичные соединения Zr и Hf – нет, т. к. они легко окисляются водой. Характерные координационные числа: у Ti – 6, реже – 4, у Zr и Hf – часто 7 и 8.
Нахождение в природе и получение
Содержание элементов в земной коре: Ti – 0,6 %; Zr ~ 10–2 %, Hf ~ 3 · 10–4 %. Образуемые минералы: TiO2 (рутил, брукит, анатаз), FeTiO3 и CaTiO3 – ильменит и перовскит. Цирконий образует ZrO2 — бадделеит и ZrSiO4 — циркон. Гафний присутствует как примесь в циркониевых минералах.
Способы получения. Титановые руды «вскрывают» путём хлорирования (в присутствии углерода) при температуре красного каления:
o
2FeTiO3 + 6C + 7Cl2 →t C 2TiCl4↑ + 2FeCl3↑ + 6CO TiCl4 и FeCl3 разделяют методом фракционного испарения. Затем:
58
o
TiCl4 + Мg →900 C Ti + 2MgCl2
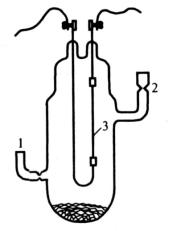
Титан «отмывают» от оставшегося MgCl2 водой, а от неизрасходованного Mg разбавленной HCl. Полученные металлы очищают с помощью метода иодидного рафинирования (рис. 37):
2I2 + Э ←→ ЭI4 (транспортная реакция)
Рис. 37. Сосуд для очистки методом йодидного рафинирования металлов IV группы: 1 – место загрузки металла и йода; 2 – место отпайки от вакуумной системы; 3 – вольфрамовая нить для наращивания очищенного металла [1]
Для отделения циркония от гафния используется дробная кристаллизация. Растворимость комплексов K2[ZrF6] и K2[HfF6] составляет 0,07 и 0,10 моль/л соответственно, таким образом, более растворимый комплексный фторид гафния переходит в раствор, а менее растовримый комплекс циркония сосредоточивается в кристаллах. Другой метод – экстракция органическими растворителями: цирконий в виде трибутилфосфатного комплекса нитрата цирконила [ZrO(NO3)2 · 2ТБФ] переходит в органическую фазу, а гафний остается в растворе.
Свойства простых веществ
Важнейшие свойства простых веществ представлены в таблице 5.
Таблица 5
Важнейшие свойства простых веществ, образованных элементами группы титана [1]
Э |
Тпл, оС |
Ткип, оС |
Плотность, |
Кристаллическая структура |
Е0(ЭО2+/Э0), В |
|
|
|
г/см3 |
|
|
Ti |
1800 |
3330 |
4,505 |
ГПУ до 882 оС, выше – ОЦК |
–0,88 |
Zr |
1857 |
~ 4340 |
6,50 |
ГПУ до 863 оС, выше – ОЦК |
–1,57 |
Hf |
2227 |
~ 4620 |
13,09 |
ГПУ до 1740 оС, выше – ОЦК |
–1,70 |
59
Ti – Zr – Hf образуют ряд непрерывных твердых растворов для обеих модификаций. Металлы подгруппы титана на воздухе коррозионноустойчивы из-за пленки оксида. Агрессивные окислители уплотняют оксидную пленку (H2SO4, конц. HNO3), а источники активных лигандов растворяют эту пленку:
ЭO2 + 6HF → H2[ЭF6] + 2H2O
ЭO2 + 3H2C2O4 → H2[Э(C2O4)3] + 2H2O
к. ч. = 6
Взаимодействие с неметаллами при повышенной температуре приводит к получению бинарных соединений (гидридов, галогенидов, оксидов, сульфидов, нитридов, карбидов, силицидов). Реакция с галогенами начинается при слабом нагревании, образуются галогениды ЭHal4, выделяется большое количество теплоты. С иодом взаимодействие протекает при 200 ºС. С азотом и водородом – при высоких температурах (~ 1000 ºС), образуются нитриды ЭN и гидриды ЭНх (где х = 1 – 4).
Взаимодействие с другими металлами дает твердые растворы замещения (с V и Cr) или интерметаллиды (с Fe, Co, Ni, Cu, Zn).
Металлы легко реагируют с кислотами, способны вытеснять водород даже из воды:
Э + 2Н2О = ЭО2 + 2Н2 (выше 800 ºС)
Также возможно протекание реакции с образованием фтор- и хлоркомплексов:
8Ti + 4HNO3 + 18HF → 3H2[TiF6] + 4NO↑ + 8H2O
Реакция с HCl идет гораздо энергичнее, чем с H2SO4 из-за образования хлоридных комплексов:
2Ti + 6HCl = 2TiCl3 + 3H2↑ (в отличие от Zr и Hf)
Титан растворяется в концентрированной HF:
2Ti + 6HF = [TiF6]2– + Ti2+ + 3H2↑
зеленая окраска
На воздухе раствор становится краснобурым (образование Ti(III)), а затем обесцвечивается (переход в Ti(IV)):
Ti + 6HF + O2 = H2[TiF6] + 2H2O
Титан медленно растворяется в разбавленных и концентрированных HNO3 и царской водке, взаимодействует с олеумом:
Ti + 4H2S2O7 = Ti(SO4)2 + 2SO2↑ + 4H2SO4
Zr и Hf более устойчивы к окислению кислотами, не реагируют ни с одной из разбавленных, кроме HF:
3Э + 4HNO3 + 21HX = 3H3[ЭX7] + 4NO↑ + 8H2O (где Э = Zr, Hf)
Э+ 7HF = H3[ЭF7] + 2H2↑
Э+ 5H2SO4 = H2[Э(SO4)3] + 2SO2↑ + 4H2O
Мелкодисперсный титан взаимодействует с концентрированными
растворами щелочей:
Ti + 2NaOH + H2O = Na2TiO3 + 2H2↑
60
