
3_i_4_gruppy_1
.pdf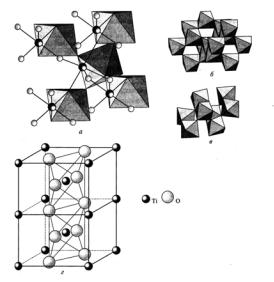
Zr и Hf, в отличие от Ti, со щелочами не реагируют. Коррозия Hf не наблюдается даже в кипящем растворе NaOH в присутствии Na2O2. В растворах щелочей устойчивы, но реагируют на воздухе с расплавами:
Э+ 2NaOH + O2 →расплав Na2ЭO3 + H2O
Э+ 2NaCl + 3/2O2 →расплав Na2ЭO3 + Cl2
(в случае Zr образуются ортоформы Na4ЭО4)
4.2. Соединения элементов IVB-группы
Оксиды
Металлы сгорают в кислороде с образованием оксидов общей формулы ЭО2. Свойства диоксидов представлены в таблице 6.
|
|
|
Таблица 6 |
|
Свойства диоксидов элементов подгруппы титана [1] |
||
Оксид |
Тпл, |
Ткип, |
Кристаллическая структура |
оС |
оС |
||
TiO2 |
1870 |
~3000 |
Типы рутила, анатаза, брукита |
ZrO2 |
2680 |
? |
Моноклинная, выше 1150 оС – тетрагональная, выше 2350 оС – |
|
|
|
кубическая, стабилизируемая при обычных условиях Y2O3 |
HfO2 |
2812 |
~5400 |
Моноклинная, выше 1150 оС – тип флюорита |
Для оксида титана TiO2 известны три устойчивые при атмосферном давлении кристаллические модификации: рутил, анатаз, брукит (рис. 38). Структура рутила состоит из цепей несколько искажённых октаэдров TiO6, причём каждый октаэдр связан с соседним по двум противоположным рёбрам. Для титана также известны оксиды Ti2O3 и TiO:
2TiO2 + Н2 → Ti2O3 + H2O
TiO2 + Ti → 2TiO
TiO0,63–1,33 – бертоллид в широком смысле. Титан с кислородом также образует металлидные фазы: Ti6O, Ti3O.
Рис. 38. Строение рутила (а), анатаза (б), брукита (в) (показаны октаэдры [TiO6]); кристаллическая решётка рутила (г) [2]
61

Строение оксида циркония представлено на рис. 39.
Рис. 39. Строение оксида ZrO2: а – моноклинный (бадделеит); б – кубический[2]
Безводные ЭО2 получают прокаливанием кислородсодержащих солей и гидроксидов. Ионная составляющая связи, энергия кристаллической решетки, Тпл возрастает вниз по группе, а энтальпия образования убывает. Диоксиды благодаря большой энергии кристаллической решетки обладают высокой инертностью; не растворяются не только в воде, но и в растворах кислот (кроме HF) и щелочей. Лишь при длительном нагревании медленно взаимодействуют с концентрированными кислотами:
o
ZrO2 + 2H2SO4(конц) + (NH4)2SO4 →300 C (NH4)2Zr(SO4)3 + 2H2O
Перевод диоксидов в растворимое состояние можно осуществить сплавлением с пиросульфатами, кислыми фторидами, щелочами, а также хлорированием в присутствии углерода:
ZrO2 + 4KHF2 = K3[ZrF7] + 2H2O + KF
o
ZrO2 + 2NaOH →t C Na2ZrO3 + H2O
o
ZrO2 + 2C + 2Cl2 →t C ZrCl4 + 2CO
Оксиды с низкими степенями наиболее устойчивы для титана:
o
3TiO2 + Ti →1500 C 2Ti2O3
o
Ti2O3 →1800 C TiO2 + TiO
Ti2O3 + Ti →> 1500 o C 3TiO
Взаимодействие ЭО2 при прокаливании с оксидами других элементовметаллов приводит к образованию смешанных оксидов (FeTiO3, CaTiO3). Только в ортотитанате бария Ba2TiO4 есть изолированный оксоанион TiO44–.
TiO2 + K2CO3 = K2TiO3 + CO2↑
При обработке водой они подвергаются полному гидролизу, при этом образуется золь титановой кислоты.:
K2TiO3 + (n+1)H2O = TiO2·nH2O↓ + 2КОН
62
Цирконаты и гафнаты состава (ЩЗЭ)ЭО3, (ЩЗЭ)2ЭО4, (ЩЭ)2ЭО3, (ЩЭ)4ЭО4 также представляют собой смешанные оксиды. Титанат бария BaTiO3 обладает свойствами сегнето- и пьезоэлектрика.
У Ti2+ восстановительные свойства выражены сильнее, TiO вытесняет Н2 из кислот:
2TiO + 3H2SO4 → Ti2(SO4)3 + H2 + 2H2O
Гидроксиды
Гидроксиды невозможно получить взаимодействием оксидов с водой, поэтому используют косвенные методы:
ЭCl4 + 4NaOH → Э(OH)4↓ + 4NaCl
Гидроксиды амфотерны, фактически имеют состав ЭО2 · хН2О. Гидроксиды содержат (–ОН) и (–О–) группы, а также адсорбированные моле-
кулы Н2О.
Для синтеза ЭО2 · nH2O используют гидролиз различных растворимых соединений этих элементов. Они не проявляют свойств оснований Э(ОН)4 или кислот Н4ЭО4. Переход осадка ЭО2 · nH2O в раствор под действием кислот и (в слабой степени) щелочей обусловлен пептизацией (превращением геля в золь). Получаемые при этом коллоидные растворы содержат относительно крупные частицы – гидратированные оксополимеры. Титан из титановой кислоты TiO2 · nH2O при действии соляной кислоты можно перевести в истинный раствор в форме комплексной кислоты H2[TiCl6]. Действие концентрированных щелочей на TiO2 · nH2O связано с образованием гидроксокомплексов, например (ЩЭ)2[Ti(OH)6]. Ортотитановая кислота TiO2 · 2H2O – α-форма титановой кислоты, метатитановая кислота TiO2 · H2O – β-форма титановой кислоты.
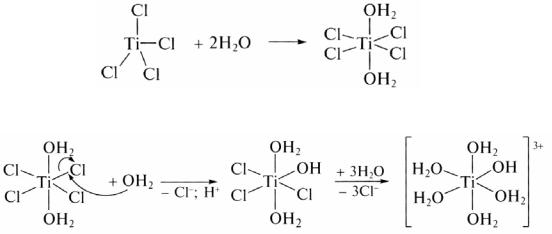
Рассмотрим формирование структуры гидроксидов на примере гидроксида титана, который образуется при гидролизе TiCl4 в водном растворе NH3. При попадании в воду молекула TiCl4 подвергается атаке молекул воды, которые сначала повышают к. ч. Ti до 6:
а затем вызывают разрыв связей Ti – Cl с образованием частиц
[Ti(H2O)5(OH)]3+:
63
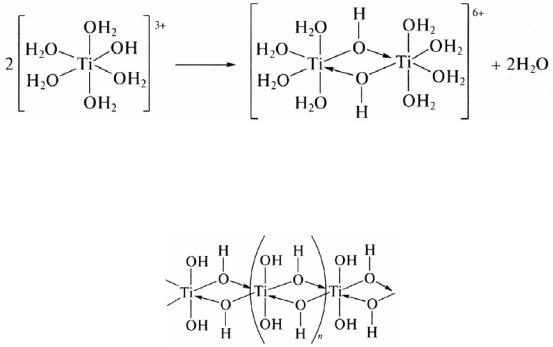
на следующей стадии гидролиза происходит поликонденсация ионов [Ti(H2O)5OH)]3+ с образованием олигомерных гидроксо- и оксопроизводных:
Если гидролиз проводить, прибавляя по каплям TiCl4 к раствору NH3 в ледяной воде, образуется студенистый осадок (гель), содержащих значительное количество мостиковых OH-групп (оловых мостиков), обусловливающих высокую реакционную способность. Это свежеосажденное вещество – α-титановая кислота:
Свойства гидроксидов:
Zr(OH)4 + 4HNO3 → Zr(NO3)4 + 4H2O
Ti(OH)4 + 2H2SO4 → Ti(SO4)2 + 4H2O
(Свежеосажденные гидроксиды)
Гидроксиды Э(ОН)4 с растворами щелочей не взаимодействует, титанаты и цирконаты образуются при сплавлении со щелочами:
Ti(ОН)4 + 4КОН →сплавление К4TiO4 + 4H2O Ti(OH)4 + Na2CO3 →сплавление Na2TiO3 + 2H2O + CO2
Гидроксид Ti(OH)3 имеет основный характер: 2Ti(OH)3 + 3H2SO4 → Ti2(SO4)3 + 6H2O
[Ti(H2O)6]3+ – аквакомплекс, в водных растворах имеет фиолетовую окраску. Ион Ti+3 – сильный восстановитель:
2Ti(OH)3 + O2 + 2H2O → 2Ti(OH)4 + H2O2
Галогениды
Наиболее типичны галогениды общей формулы ЭHal4. Только TiCl4 является жидкостью, остальные галогениды – твердые вещества. Фториды являются полимерами, в основе которых лежат октаэдры, сшитые ребрами. Их Tпл (под давлением) растут от хлоридов к иодидам. Газообразные ЭHal4 прочны за счет образования делокализованных πp-d связей по донорноакцепторному механизму. В результате гидролиза TiCl4 образуются устойчивые аэрозоли (туманы), состоящие из мельчайших капель двух кислот: соляной и титановой (используется в военном деле для создания дымовых завес):
64
TiCl4 + (2+n)H2О = TiO2 · nH2O+ 4HCl
Если TiCl4 попадает в водный раствор HCl, то с ростом концентрации
HCl образуется гексахлоротитановая кислота H2[TiCl6].
В промышленности безводные тетрагалогениды получают по реак-
ции:
o
ЭО2 + 2С + 2Сl2 →t C ЭСl4↑ + 2CO↑
o
ЭCl4 + 4HF →t C ЭF4 + 4HCl
Трихлорид титана можно получить восстановлением галогенидов ти-
тана (IV):
o
TICl4 + H2 →650 C TiСl3 + 2HCl 2H2[TiCl6] + Zn = 2TiСl3 + ZnCl2 + 4HCl
Существует [TI(ОН2)6]Cl3 фиолетового цвета и [TI(ОН2)4Cl2]Cl·2H2О – зелёного цвета – проявление гидратной изомерии.
При нагревании тригалогениды диспропорционируют на ди- и тетрагалогениды:
2ЭХ3 = ЭХ2 + ЭХ4
При сплавлении TiCl2 c хлоридами Rb и Cs образуются комплексные соли состава (ЩЭ)[TIСl3] и (ЩЭ)2[TIСl4]. ЭHal4 гигроскопичны и гидролизуются, степень гидролиза при переходе от Ti к Hf падает.
TiO2+, ZrO2+, HfО2+ – оксокатионы. Их можно рассматривать как продукт гидролиза по катиону производных Э+4 с отщеплением молекулы Н2О:
ЭCl4 + H2O ←→ Э(ОН)Cl3 + HCl Э(ОН)Cl3 + H2O ←→ Э(ОН)2Cl2 + HCl
Э(ОН)2Cl2 – Н2О → ЭОСl2
HfO2+ – менее характерны. Галогенпроизводные солеобразны и существуют в твердом состоянии TiOCl2 и т. д. Существуют TiHal3 и TiHal2
(кроме TiF2).
2TiHal4 + Н2 → 2TiHal3 + 2НHal TiHal4 + Ti ←→ TiHal2
Низшие галогениды титана – сильные восстановители, склонны к диспропорционированию (иодидный метод):
3ЭHal4 + Al → 3ЭHal3 + AlHal3
Для Zr и Hf такая реакция протекает сложнее: 2ЭHal3 ←→ ЭHal2 + ЭHal4
2H2[TiCl6] + Zn = 2TiCl3 + ZnCl2 + 4HCl
красно-фиолетовый
Чрезвычайно сильный восстановитель:
TiHal4 + ZrHal2 → TiHal2 + ZrHal4
65
Соединения с другими неметаллами
Гидриды Ti, Zr, Hf – хрупкие металлоподобные порошки переменного состава (в пределе ЭН2), имеют структурный тип СaF2. Синтезируют ЭН2 взаимодействием металлов с водородом.
Сульфиды ЭS2 синтезируют взаимодействием простых веществ при нагревании. TiS2 обладает металлической проводимостью, ZrS2 – полупроводник, HfS2 – диэлектрик.
Кристаллические карбиды и нитриды (структурный тип NaCl) – очень твердые и тугоплавкие вещества (Тпл нитридов 3200–2630 оС, карбидов 3250–3890 оС). Нитриды ЭN химически инертны.
Титан образует фосфиды TiP, TiP2, ZrP, ZrP2.
Соли кислородсодержащих кислот
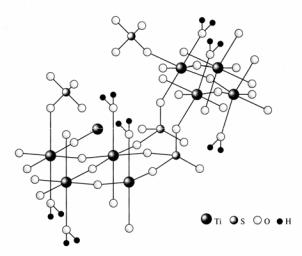
В силу амфотерности свежеосажденные гидроксиды ЭО2 · хН2О растворяются в кислотах и расплавленных щелочах с образованием солей. Взаимодействие с кислотами приводит к образованию гидролизованных катионных форм. Вследствие высокого заряда и малого радиуса ионы Ti4+ не способны существовать в водном растворе даже в среде конц. H2SO4. Поэтому при взаимодействии ЭО2 · хН2О с кислотами образуются оксо- и гидроксопроизводные: ЭОX2 (X = Cl–, Br–, I–, NO3–, H2PO4–), ЭOSO4 или их кристаллогидраты. Так, при нагревании TiO2 с концентрированной H2SO4 образуется не средний сульфат Ti(SO4)2, а гидролизованная форма –сульфат титанила TiOSO4. В гидрате TiOSO4 · H2O (рис. 41) к. ч. титана равно 6, титан находится в октаэдрическом окружении мостиковых атомов кислорода, анионов SO42– и молекул воды, причем 3 атома Ti связаны с одним и тем же сульфат-ионом.
Рис. 40. Строение гидрата TiOSO4·H2O [2]
При растворении его в воде происходит разрыв связи Ti – O – Ti с образованием циклических три- и тетрамеров:
66
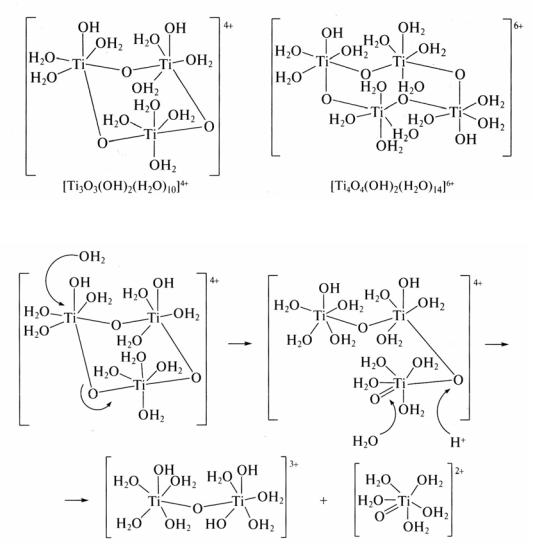
а также некоторого числа димеров и ионов титанила TiO2+, возникающих при их диссоциации:
Негидролизованный безводный сульфат титана (IV) можно получить только в отсутствие воды:
TiCl4 + 6SО3 = Ti(SO4)2 + 2S2O5Cl2
TiO2 + 2K2S2О7 = 2K2SO4 + Ti(SO4)2
o
TiО2 + 2K2S2O7 →t C, сплавление K2[Ti(SO4)3] + K2SO4
Устойчивость [Ti(SO4)3]2– повышена за счет комплексообразования. Ti(SO4)3 получают катодным восстановлением. Образует двойные соли типа квасцов, например Rb2SO4 · Ti2(SO4)3 · 24H2O.
Сульфат циркония Zr(SO4)2 · 4H2O. На аноде:
Zr(SO4)2 · 4H2O → H2+[ZrO(SO4)2]2– · 3H2O
Негидролизованные кристаллогидраты сульфатов Э(SO4)2 · 4H2O можно выделить только из сильнокислых водных растворов (более чем 6 н. Н2SO4). При растворении в воде они превращаются в соли цирконила и гафнила – основные соли ЭOSO4 · mH2O или Э(OН)2SO4 · (m-1)H2O.
Перхлораты и фосфаты элементов 4-й группы, так же как и сульфаты и нитраты, гидролизуются сильнее всего в случае титана (IV). Для Zr и Hf
67
характерны пирофосфаты ЭР2О7 от Н4Р2О7 и силикаты: ZrSiO4 от Н4SiO4. Титанаты, цирконаты и гафнаты получают сплавлением:
o
2KOH + 2ZrO2 →1050 C K2Zr2O5 + H2O
В концентрированных растворах щелочей существуют K2[Ti(OH)6], K2[Hf(OH)6].
Применение
Ввиду необыкновенной коррозионной стойкости титан и его сплавы используются в производстве газотурбинных двигателей, в самолетостроении (как для двигателей, так и для корпусов летательных аппаратов). Кроме того, титан используется для производства морского оборудования. Цирконий также отличает высокая коррозионная стойкость, он используется для легирования сталей. При добавлении к ниобию цирконий образует сверхпроводящий сплав, сохраняющий сверхпроводимость в сильных магнитных полях. Металлический цирконий используется в качестве плакировки топливных стержней из UO2 в водоохлаждаемых ядерных реакторах. Легирование оловом (около 1,5 %) повышает коррозионную стойкость и устойчивость к облучению (сохраняет механическую прочность). Всё это, а также незначительное поглощение «тепловых» нейтронов, делает цирконий идеальным материалом для данной цели. Гафний напротив является мощным поглотителем тепловых нейтронов, поэтому используется в качестве управляющих стержней в реакторах на атомных подводных лодках.
TiO2 явлется отличным красителем (титановые белила). ZrO2 – керамика для изготовления тиглей, огнеупоров. Монокристаллы диоксида циркония используются в качестве источника лазерного излучения, имитатора бриллиантов (фианиты). Титанат бария – сегнето- и пьезоэлектрик. Гидрид титана – эффективный катализатор реакций гидрирования некоторых органических соединений. Нитриды и карбиды ЭС и ЭN используются в качестве шлифовального материала и для изготовления термостойких конструкций. TiN образует окрытия, заменяющие золото. Сплав 20 % HfC и 80 % TaC является одним из самых тугоплавких.
68
ЗАКЛЮЧЕНИЕ
Данное издание ни в коем случае не претендует на полноту изложения накопленного к настоящему времени современной неорганической химией материала, т. к. современная химия элементов включает огромный объём знаний. В пособии, построенном на основе мультимедийного курса лекций по дисциплине «Неорганическая химия», отражены основные аспекты, касающиеся химии элементов III и IV групп Периодической системы. И оно, несомненно, окажет помощь студентам-первокурсникам при изучении химии элементов, при подготовке к семинарским занятиям и экзаменам.
69
Литература
1.Неорганическая химия. Химия элементов : учеб. в 2 т. / Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. – 2-е изд., перераб. и
доп. – М. : Изд-во МГУ; Академкнига, 2007. – Т. 1. – 538 с. ; Т. 2. – 670 с.
2.Неорганическая химия : в 3 т. : учебник для студ. вузов, обуч. по направлению 510500 – «Химия» и специальности 011000 – «Химия» / под ред.
Ю.Д. Третьякова. — М. : Academia, 2004. – Т. 2. – 365 с.; Т. 3., кн. 1. – 348 с.; Т. 3., кн. 2. – 399 с.
3.Угай Я.А. Неорганическая химия : учеб. для хим. спец. вузов / Я.А.
Угай. – М. : Высш. шк., 1989. – 463 с.
4.Угай Я.А. Общая и неорганическая химия : учеб. для студ. вузов, обуч. по направлению и специальности «Химия» / Я.А. Угай. – Изд. 5-е,
стер. – М. : Высш. шк., 2007. – 526 с.
5.Шрайвер Д. Неорганическая химия : в 2 т. / Д. Шрайвер, П. Эткинс. – М. : Мир, 2004. – (Лучший зарубежный учебник). – Т. 1. – 679 с.; Т. 2. – 486 с.
6.Гринвуд Н. Химия элементов : в 2 т. : [учеб. для вузов] / Н. Гринвуд, А. Эрншо. – М. : БИНОМ. Лаб. знаний, 2008. – (Лучший зарубежный учеб-
ник). – Т. 1. – 607 с.; Т. 2. – 670 с.
7.Льюис М. Химия в диаграммах / М. Льюис; пер. с англ. С.П. Торшина. – М. : АСТ; Астрель, 2004 – 159 с. – (Оксфордские учебные пособия).
8.Лидин Р.А. Химические свойства неорганических веществ : учеб. пособие для вузов. / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева ; под ред. Р.А. Лидина. – 4-е изд., стер. – М. : КолосС, 2003. – 480 с.
70
