
3_i_4_gruppy_1
.pdf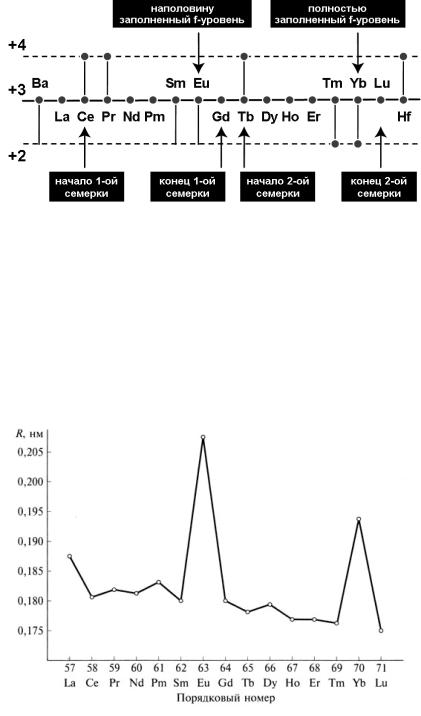
Рис. 21. Сравнение степеней окисления бария, лантанидов и гафния
Повышенная стабильность двухзарядного состояния Eu и Yb отмечается и в простых веществах (металлических кристаллах). Магнитные измерения показывают, что решетки Eu и Yb (как и бария) состоят из ионов Э2+. Поэтому металлические радиусы Eu2+ и Yb2+ заметно больше, чем у Ln3+.
Увеличенные металлические радиусы Eu и Yb (рис. 22) обусловливают заниженные значения плотности d (г/см3), а следовательно, завышенные значения мольных объемов металлов Vm = M/d, см3/моль.
Рис. 22. Изменение металлического радиуса (R) в ряду 4f-элементов [2]
Eu и Yb по мольным объемам закономерно являются аналогами бария (рис. 23, пунктир в верхней части рисунка). Если бы все решетки металлических лантанидов состояли из Э3+ (как La), то мольные объемы менялись бы монотонно (пунктир в нижней части рисунка). Но помимо Eu и Yb повышенные значения Vm у Sm, хотя и не столь значительные. В то же время для Ce и Tb (и в меньшей степени для Pr) отмечаются отрицательные от-
31

клонения от монотонной зависимости, обусловленные частичной реализацией четырехзарядного состояния.
При увеличении металлического радиуса Eu и Yb расстояние между атомами в кристалле простого вещества возрастает, энергия связи уменьшается, что приводит к понижению Tпл (рис. 24).
Рис. 23. Изменение атомного объёма в ряду 4f-элементов
Рис. 24. Изменение температур плавления в ряду 4f-элементов
32
Окраска ионов [Ln(H2O)n]3+
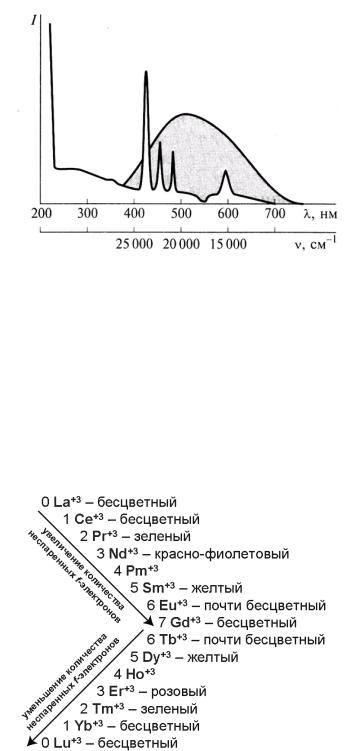
По мере заполнения 4f-уровня количество неспаренных электронов у атомов сначала возрастает, а затем (при повторном заселении) начинает уменьшаться. Оптические f-f-переходы обусловливают окраску соединений. Энергия расщепления f-орбиталей незначительна, поэтому окраска соединений менее интенсивна, чем у комплексов d-элементов
Рис. 25. Электронный спектр водного раствора перхлората празеодима. Для сравнения приведен типичный электронный спектр иона 3d-элемента – иона
[Ti(H2O)6]3+ (показан темным) [2]
Полосы поглощения в спектрах очень узкие, поглощение избирательное, окраска по сравнению с соединениями d-элементов сложная, смешанная (рис. 25). От церия к гадолинию полосы поглощения сдвигаются от красной области к фиолетовой, а от гадолиния к тулию – в обратном направлении. По окраске ионы Ln3+ симметрично группируются относительно гадолиния (с одинаковым количеством неспаренных электронов, рис. 26).
Рис. 26. Изменение окраски ионов Ln3+
33
Поскольку лантаниды принадлежат к активным металлам, и связь в большинстве их соединений носит преимущественно ионный характер, то подобная окраска характерна и для других соединений, в частности – оксидов.
Физические свойства
Лантаниды – металлы серебристо-белого цвета, ковкие и пластичные. От Ce к Lu твердость несколько возрастает. Плотность резко возрастает (лантанидное сжатие) – 6,7–9,8 г/см3, исключения: Eu (5,3), Yb (7,0) (объяснение см. выше). Важнейшие свойства простых веществ, образованных РЗЭ, и способы их получения представлены в таблице 4.
Все лантаниды – парамагнетики, но Eu, Gd, Dy, Er – даже ферромагнетики (сплавы с их участием иногда используют для изготовления сильных постоянных магнитов).
Химические свойства
По химической активности РЗЭ сравнимы с щелочно-земельными металлами. Относительная электроотрицательность 1,2 1,3. Стандартные электродные потенциалы: Е° (Э3+/Э): от – 2,48 В (Се) до – 2,26 В (Lu).
Таблица 4
Важнейшие свойства простых веществ, образованных РЗЭ, и способы их получения [1]
РЗЭ |
Tпл, |
Tкип, |
Плот- |
Кристаллическая |
Способ получения |
Е0 (Э3+/Э0), |
|
оС |
оС |
ность |
структура |
металла |
В |
|
|
|
г/см3 |
|
|
|
Sc |
1539 |
2700 |
3,02 |
ГПУ до 1336 оС, |
Са-термия ScF3 |
-1,88 |
|
|
|
|
выше – ОЦК |
|
|
Y |
1525 |
3025 |
4,47 |
ГПУ до 1480 оС, |
Са-термия YF3 |
-2,37 |
|
|
|
|
выше – ОЦК |
|
|
La |
920 |
3470 |
6,12 |
ГПУ до 260 оС, |
Са-термия LaF3, |
-2,25 |
|
|
|
|
КПУ до 880 оС |
электролиз LaCl3 |
|
|
|
|
|
выше – ОЦК |
|
|
Ce |
804 |
3470 |
6,77 |
ГПУ до -10 оС, |
Са-термия СeF4 |
-2,48 |
|
|
|
|
КПУ до 762 оС |
|
|
|
|
|
|
выше – ОЦК |
|
|
Pr |
935 |
3017 |
6,77 |
ГПУ до 796 оС, |
Электролиз PrCl3 |
-2,47 |
|
|
|
|
выше – КПУ |
|
|
Nd |
1024 |
3210 |
7,01 |
ГПУ до 885 оС, |
Са-термия NdF3, |
-2,44 |
|
|
|
|
выше – ОЦК |
NdCl3, электролиз |
|
Pm |
|
|
|
|
NdCl3 |
|
1080 |
– |
– |
ГПУ |
Са-термия PmF3 |
-2,42 |
|
Sm |
1072 |
1670 |
7,54 |
Ромбоэдрическая до |
Lа-термия SmF3 |
-2,41 |
Eu |
|
|
|
917 оС, выше - ОЦК |
|
|
826 |
1430 |
5,24 |
ОЦК |
Lа-термия Eu2O3 |
-2,41 |
34
Gd |
1312 |
2840 |
7,89 |
ГПУ до 1260 оС |
Са-термия GdF3 |
-2,40 |
|
|
|
|
выше – ОЦК |
|
|
Tb |
1368 |
2480 |
8,25 |
ГПУ до 1287 оС |
Са-термия TbF3 |
-2,39 |
|
|
|
|
выше – ОЦК |
|
|
Dy |
1380 |
2330 |
8,56 |
ГПУ до 1384 оС |
Са-термия DyF3 |
-2,35 |
|
|
|
|
выше – ОЦК |
|
|
Ho |
1500 |
2380 |
8,78 |
ГПУ до 1428 оС |
Са-термия HoF3 |
-2,32 |
|
|
|
|
выше – ОЦК |
|
|
Er |
1525 |
2390 |
9,06 |
ГПУ до 1367 оС |
Са-термия ErF3 |
-2,30 |
Tm |
|
|
|
выше – ОЦК |
|
-2,28 |
1600 |
1720 |
9,32 |
ГПУ |
Lа-термия Tm2O3 |
||
Yb |
824 |
1320 |
6,95 |
KПУ до 796 оС |
Lа-термия Yb2O3 |
-2,27 |
Lu |
|
|
|
выше – ОЦК |
электролиз YbCl3 |
-2,25 |
1675 |
2680 |
9,85 |
ГПУ |
Са-термия LuF3 |
Растворяются в неокисляющих минеральных кислотах, кроме HF и H3PO4 (образование по поверхности нерастворимых фторидов и фосфатов). Не взаимодействуют со щелочами. Энергично разлагают воду при нагревании:
o
2Ln + 6H2O →t C 2Ln(OH)3 + 3H2
Активно взаимодействуют с большинством неметаллов. В отличие от остальных лантанидов, Eu и Yb (подобно барию) растворяются в жидком аммиаке, образуя синие растворы, содержащие сольватированные электроны:
Eu + (6+y)NH3 → [Eu(NH3)6]2+ + 2[ē(NH3)y]
2.4. Соединения лантанидов
Характеристические соединения
В степени окисления +3 химия лантанидов аналогична химии иттрия (2-я семерка) и лантана (1-я семерка). Оксиды Ln2O3 – тугоплавкие порошки, нерастворимые в воде, но энергично взаимодействуют с ней с образованием гидроксидов:
Ln2O3 + 3H2O → 2Ln(OH)3
Плотность оксидов закономерно нарастает от Ce2O3 к Lu2O3. Связь в них существенно ионная. Гидроксиды Ln(OH)3 труднорастворимы в воде. От Ce(OH)3 к Lu(OH)3 растворимость закономерно уменьшается. В этом же направлении облегчается обезвоживание при нагревании. Гидроксиды Ce – Gd напоминают La(OH)3, а гидроксиды Tb – Lu ближе к Y(OH)3. Все гидроксиды Ln(OH)3 имеют основный характер. Хотя сухим путем (при спекании оксидов) получены производные типа MeILnO2 (для «тяжелых» лантанидов), формально отвечающие кислотной функции Ln(OH)3, говорить о ка- кой-то «амфотерности» гидроксидов не следует. Все эти производные нацело гидролизуются.
35
Бинарные соединения лантанидов (халькогениды, галогениды, пниктогениды, гидриды, карбиды и т. д.) аналогичны таковым для La и Y.
Соли и комплексные соединения
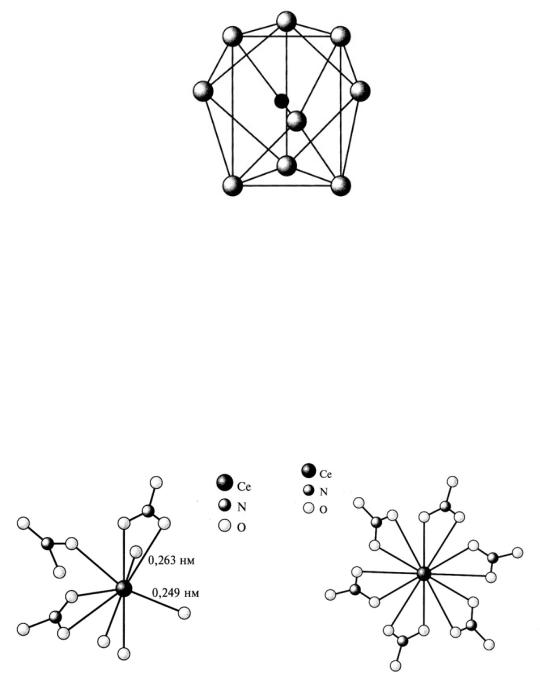
В степени окисления +3 также аналогичны соответствующим соединениям La и Y. Галогениды носят ярко выраженный солеобразный характер. Фториды в воде нерастворимы, хлориды, бромиды, гидриды хорошо растворимы в воде, при кристаллизации из раствора образуют кристаллогидраты (аквакомплексы) ЭHal3 H2O, например NdCl3 9H2O (рис. 27).
Рис. 27. Трехшапочная тригональная призма [Nd(H2O)9]3+ в кристаллической структуре бромата неодима [2]
Фториды LnF3 c фторидами щелочных металлов в расплаве образуют комплексы типа MeI3[LnF6], устойчивость которых возрастает по мере уменьшения радиуса Э3+ и увеличения радиуса Me+. Некоторые хлориды и бромиды также способны образовывать комплексы: K3[GdCl6], K3[DyCl6], Li3[CeBr6]. Среди многочисленных солей оксокислот сульфаты и нитраты хорошо растворимы, карбонаты и фосфаты – труднорастворимы (подобно солям La и Y). Из водных растворов выделяются кристаллогидраты, напри-
мер Ce(NO3)3 4H2O или [Ce(NO3)3(H2O)4] – к. ч. = 7 (рис. 28).
Рис. 28. Строение нитрата Ce(NO3)3(H2O)4 и нитратного комплекса [Ce(NO3)6]3– [2]
36
Для сульфатов и нитратов лантанидов характерно образование двойных солей MeI2(SO4) Ln(SO4)3 nH2O типа квасцов. В состав некоторых двойных нитратов входят анионные комплексы: [Ln(NO3)6]3–, например [Mg(H2O)6]3 · [Ce(NO3)6]2 6H2O. Растворимость нитратов уменьшается в ря-
ду Ce(NO3)3 – Gd(NO3)3 и вновь возрастает от Gd(NO3)3 к Lu(NO3)3. Карбо-
наты, хотя и труднорастворимы, их относительная растворимость подчиняется той же закономерности. Карбонаты Ln2(CO3)3 образуют комплексы с карбонатами щелочных металлов MeI[Ln(CO3)2] nH2O (растворение осадков при пропускании избытка CO2). Вследствие лантанидного сжатия и некоторого ослабления основных свойств в ряду Ln(OH)3 слева направо усиливается гидролиз солей по катиону. Соли Lu+3 в растворах заметно гидролизованы.
Соединения в степени окисления +4
Степень окисления +4 наблюдается у элементов, возглавляющих семерки лантанидов – Ce, Pr, Tb. Наиболее характерна она для церия. Церий – единственный из лантанидов, который, сгорая на воздухе или в кислороде, дает диоксид:
Ce + O2 → CeO2
CeO2 кристаллизуется в структурном типе флюорита (CaF2), что свидетельствует о высокой ионности связи. При нагревании восстанавливается водородом:
o
2CeO2 + H2 →t C Ce2O3 + H2O
CeO2 – сильный окислитель, например, подобно MnO2, способен окислить соляную кислоту до хлора:
2CeO2 + 8HCl → 2CeCl3 + Cl2 + 4H2O
В щелочной среде, напротив, Ce+3 является восстановителем: Ce(NO3)3 + AgNO3 →NaOH Ce(NO3)4 + Ag↓
Легко окисляется, например, бромом в щелочной среде: 2Ce(OH)3 + Br2 + 2NaOH → 2Ce(OH)4 + 2NaBr
Для Pr и Tb степень окисления +4 менее стабильна. При сгорании на воздухе они не образуют ЭО2, а лишь «смешанные» оксиды: Tb4O7
(Tb2O3 2TbO2), Pr7O12 (2Pr2O3 3PrO2). Следовательно, Pr+4 и Tb+4 – еще более сильные окислители, чем Ce+4. Они способны окислять воду:
4Э+4 + 2H2O → 4Э+3 + 4H+ + O2↑
PrO2 можно получить, выдерживая Pr2O3 при 500 °С под давлением кислорода в 100 атм. TbO2 получают окислением Tb2O3 атомарным кислородом при 450 °С. PrO2 способен окислить Mn+2 до MnO4– в кислой среде:
2MnSO4 + 10PrO2 + 13H2SO4 → 2HMnO4 + 5Pr2(SO4)3 + 12H2O
СeO2 и Ce(OH)4 проявляют признаки амфотерности. При спекании CeO2 с BaO или SrO образуются цераты ЭСeO3. С СаО это не происходит.
Из галогенидов Ce+4 известен только CeF4:
37
o
CeF3 + 1/2F2 →400 C CeF4
Чистые TbF4 и PrF4 не получены, но в комплексах типа MeI[PrF5], MeI2[PrF6], MeI3[PrF7] или Сs3[TbF7] степень окисления +4 стабилизируются. Нитрат Ce+4 известен только в виде основной соли Ce(OH)(NO3)3 3H2O (cклонность к гидролизу!). Ce+4 образует комплексные нитраты c KNO3, NaNO3, NH4NO3, например MeI2[Ce(NO3)6]. В отличие от основного нитрата известны средние соли – перхлорат Ce(ClO4)4 и ацетат Ce(CH3COO)4. Безводный сульфат Ce(SO4)2 выделяется в виде желтого порошка при взаимодействии CeO2 с горячей концентрированной H2SO4:
o
CeO2 + 2H2SO4(конц) →t C Ce(SO4)2 + 2H2O
Существует оранжевый кристаллогидрат Ce(SO4)2 4H2O. Сульфат церия (IV) образует двойные соли с сульфатами щелочных металлов и ам-
мония, например K4[Ce(SO4)4] 2H2O (2K2SO4 Ce(SO4)2 2H2O),
(NH4)6[Ce(SO4)5] 2H2O (3(NH4)2SO4 Ce(SO4)2 2H2O).
Ce(OH)3 окисляется кислородом воздуха до Ce(OH)4. Но при действии на Ce(OH)3 пероксида водорода H2O2 образуются гидропероксиды от
Ce(OH)3ООН до Ce(OOH)4.
Соединения в степени окисления +2
Степень окисления +2 наблюдается у предпоследних элементов в семерках (Eu, Yb) и в некоторой степени – у их непосредственных предшественников (Sm, Tm). В наибольшей степени это состояние характерно для европия. Монооксиды ЭО, получаемые восстановлением Э2О3 графитом при высокой температуре, кристаллизуются в структурном типе NaCl.
Водородным восстановлением EuF3 получают EuF2 (структурный тип CaF2). Известны все ЭHal2 для Sm, Eu, Tm, Yb. Их устойчивость уменьшается как в этом ряду (для однотипных галогенидов), так и от хлоридов к иодидам.
Сульфаты EuSO4 (белый), YbSO4 (светло-зеленый), SmSO4 (красный) получают катодным восстановлением при электролизе сульфатов Э2(SO4)3. Сложность получения говорит о том, что производные Э+2 – сильные восстановители. Например, подобно активным металлам, они вытесняют водород из кислот:
2YbSO4 + H2SO4 → Yb(SO4)3 + H2↑
Вообще, химия Eu+2 во многом схожа с химией щелочно-земельных металлов (кроме активных восстановительных свойств).
Применение
Иттрий является основой фосфоров́ , используемых в производстве телевизионных экранов для получения красного цвета. В виде гранатов
38

Y3Fe5O12 – в микроволновых фильтрах радаров. Иттрий перспективен как замедлитель в ядерных реакторах. La2-xSrxCuO4 и YBa2Cu3O7-x – высокотемпературные сверхпроводники.
«Мишметалл» (неразделённая смесь лантанидов, содержащая 25 % лантана) и ферросилиций используются в производстве лёгких кремней и для легирования сталей.
Многие сплавы РЗЭ обладают ценными техническими характеристиками и применяются в промышленности. Используются как легирующие добавки, повышающие прочность, термостойкость магниевых и алюминиевых сплавов. Самариевые сплавы – в 5–6 раз более сильные магниты, чем постоянные магниты на основе железа. Интерметаллиды на основе РЗМ – аккумуляторы водорода. La2O3 используется для изготовления оптических стекол с большим углом преломления. Этот оксид был предложен в качестве многофункционального катализатора. Y2O3 и Eu2O3 – производство кинескопов телевизоров. Pr6O11 – для изготовления неорганических красителей. Оксид неодима – в производстве лазерной оптики и керамических конденсаторов. Оксиды РЗЭ входят в состав керамических композитов, проявляющих свойства сверхпроводников. Такие оксиды применяют в производстве волоконной оптики и для изготовления люминофоров.
IV ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
ГЛАВА 3. IVA-группа
3.1. Простые вещества
Углерод
Восновном состоянии все атомы элементов группы IVA имеют конфигурацию ns2np2. В Периодической системе есть два элемента, у которых число валентных орбиталей совпадают с числом валентных электронов, это углерод и водород. Именно они и образуют больше всего соединений.
Внормальном и возбуждённом состояниях углерод имеет конфигура-
ции:
Углерод может находиться в 3 гибридных состояниях sp3, sp2, sp. Характерна высокая энергия гомоатомных связей. Связи С – С составляют основу органической химии. Как простое вещество углерод существует в нескольких формах [1-4].
Алмаз – имеет тетраэдрическую структуру к. ч. = 4, тип гибридизации
– sp3. Графит – двумерные сетки из шестичленных колец, между ними – «межслоевые силы» силы Ван-дер-Ваальса (рис. 29). Тип гибридизации – sp2.
39
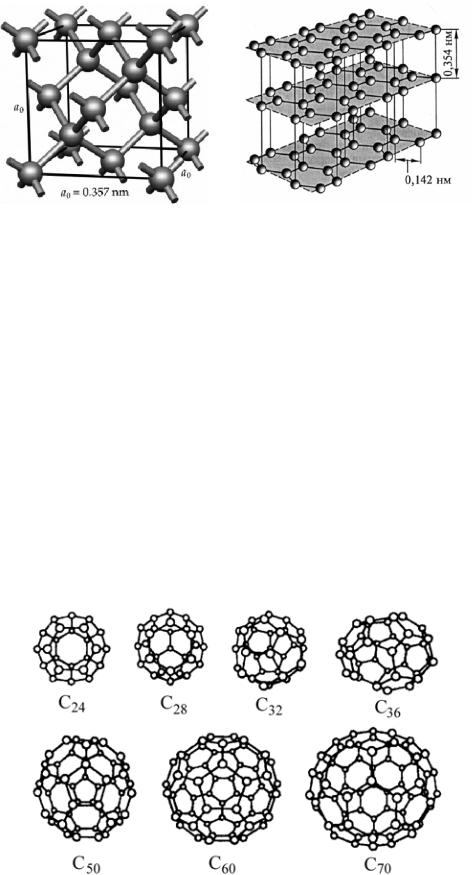
Рис. 29. Структуры алмаза и графита [2]
Карбин – С = С – С = С, sp-гибридизация, среднее расстояние углерод – углерод ещё короче, чем в слоях графита. Карбин образуется при гидрировании ацетилена с последующим прокаливанием в условиях окислительного процесса до 1000 оС. Поликумулен имеет строение = С = С = С = С =. При высоком давлении и температуре около 900 оС графит превращается в так называемый лонсдейлит – гексагональную модификацию алмаза с кристаллической структурой типа вюрцита. Плотность у него такая же, как и у алмаза.
Фуллерены – одна из форм простого вещества углерода, обнаруженная в последние десятилетия XX в. Это шарообразные (С60) или дынеобразные (С70) полые молекулы, поверхность которых состоит из пяти- и шестиугольников, образованных атомами углерода (рис. 30). Структурный мотив фуллеренов – ряд полиэдрических кластеров Сn, каждый с 12 пятиугольниками и (n/2 – 10) шестиугольниками. Тип гибридизации – sp2. Взаимодействием С60 с щелочными металлами получают фуллериды, например, К3С60, обладающие свойствами сверхпроводников.
Рис. 30. Структуры фуллеренов
40
