
Metodicheskoe_posobie_Immunodefitsity
.pdfГосударственное бюджетное образовательное учреждение высшего профессионального образования «КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
Министерства здравоохранения Российской Федерации
Кафедра патофизиологии
ПАТОФИЗИОЛОГИЯ ИММУННОЙ СИСТЕМЫ
Учебно-методическое пособие для студентов
Казань, 2013
ББК 54.1/57.3 – 25я73 УДК 612.017.1- 092 (075.8)
Печатается по решению Центрального координационнометодического совета Казанского государственного медицинского университета
Составители:
д.м.н., профессор, заведующий кафедрой патофизиологии С.В. Бойчук,
к.м.н., ассистент кафедры патофизиологии П.Д. Дунаев
Рецензенты:
д.м.н., профессор, заведующий кафедрой биохимии И.Г. Мустафин,
д.м.н., профессор, заведующий кафедрой аллергологии и иммунологии ГБОУ ДПО КГМА Минздравсоцразвития России Р.С. Фассахов
Патофизиология иммунной системы. Учебно-методическое пособие для студентов / С.В. Бойчук, П.Д. Дунаев – Казань: КГМУ, 2013. – 73 с.
Учебно-методическое пособие предназначено для подготовки студентов к практическому занятию по теме «Иммунодефициты». В пособии отражены общие принципы организации иммунного ответа, описаны наиболее распространённые первичные и вторичные иммунодефицитные состояния. Для лучшего усвоения материала в конце пособия представлены тестовые вопросы и ситуационные задачи.
© Казанский государственный медицинский университет, 2013
|
ОГЛАВЛЕНИЕ |
|
Раздел 1. |
Общие представления об иммунитете…………….…....4 |
|
Раздел 2. |
Иммунодефициты…………………………………........20 |
|
Раздел 3. |
Тестовые вопросы………………………...…… |
............46 |
Раздел 4. |
Ситуационные задачи……………………...………......58 |
|
Контрольные вопросы………………………………………...…..58 |
||
Список принятых сокращений……………………………………60 |
||
Литература……………………………..…………............... |
………60 |
|
4
РАЗДЕЛ 1. ОБЩИЕ ПРЕДСТАВЛЕНИЯ ОБ ИММУНИТЕТЕ
Иммунитет (от лат. immunitas – освобождение, избавление от чего-либо) – состояние повышенной устойчивости к биологической агрессии.
В большинстве случаев агрессивными агентами являются
патогенные микроорганизмы (внешняя агрессия), а также генетически изменённые и вышедшие из-под контроля организма опухолевые клетки (внутренняя агрессия).
Иммунитет обеспечивается взаимодействием неспецифи-
ческих (врождённых) и специфических (приобретённых, адаптивных) защитных механизмов (табл. 1).
Таблица 1 Неспецифические (врождённые) и специфические
(приобретённые, адаптивные) механизмы иммунитета
|
Неспецифические |
Специфические |
Признак |
(врождённые) |
(приобретённые, |
|
механизмы иммунитета |
адаптивные) механизмы |
|
|
иммунитета |
Клеточный |
1. Миелоидные клетки: |
1. Лимфоидные клетки: |
компонент |
нейтрофилы, эозино- |
Т- и В-лимфоциты |
|
филы, моноциты/ма- |
|
|
крофаги |
|
|
2. Лимфоидные клетки: |
2. Миелоидные клетки: |
|
естественные киллеры |
макрофаги |
Гумораль- |
Система комплемента |
Иммуноглобулины |
ный |
α- и β-интерфероны |
(антитела) |
компонент |
С-реактивный белок |
|
Неспецифические (врождённые) механизмы иммунитета
Клетки, обеспечивающие врождённый иммунитет,
образуются в красном костном мозге: а) в процессе миелопоэза
(миелоидные клетки) – нейтрофилы, эозинофилы, моноциты/макрофаги; б) в процессе лимфоцитопоэза – естественные киллеры

5
(NK-клетки – Natural Killers).
Миелоидные клетки (рис. 1) выявляют наличие чужеродных агентов с помощью специальных поверхностных TLR-рецепторов (Toll-Like Receptors – рецепторы, подобные Tol-рецепторам, обнаруженным у мухи дрозофилы). Данные рецепторы распознают не индивидуальные макромолекулы (антигены), а определённые группы молекул («паттерны»), имеющиеся у различных патогенных организмов: например, бактериальные липополисахариды, мурамилпептиды бактериальной стенки, молекулы РНК и ДНК и т.д.
.
Рис. 1. Разновидности поверхностных ТLR-рецепторов миелоидных клеток.
После распознавания чужеродных агентов миелоидные клетки активируются и осуществляют их ликвидацию. Макрофаги и нейтрофилы фагоцитируют патогенные микроорганизмы
(внутриклеточное уничтожение). Этот процесс облегчается
опсонизацией – покрытием патогенных агентов специальными молекулами-опсонинами (C3b компонент комплемента, С-
6
реактивный белок, IgG-антитела), к которым на поверхности фагоцитов имеются специфические рецепторы.
Возможно внеклеточное уничтожение патогенных микроорганизмов посредством выброса фагоцитами в окружающее пространство бактерицидных белков и других токсических агентов (в большей степени характерно для эозинофилов, которые осуществляют защиту организма от крупных патогенов – гельминтов).
NK-клетки обеспечивают, в отличие от фагоцитов, контактное уничтожение клеток-мишеней (опухолевых, вирусинфицированных). NK-клетка после распознавания клеткимишени секретирует в межклеточное пространство белки перфорины. Они встраиваются в цитоплазматическую мембрану клетки-мишени и, агрегируясь, образуют в ней канал. Через него NK-клетка секретирует протеазы – гранзимы, запускающие апоптоз (программированную гибель) клетки-мишени.
Уничтожению патогенных агентов могут способствовать
гуморальные факторы:
А) система комплемента – группа белков плазмы крови, активируемых по каскадному принципу (синтезируются в печени и относятся к «белкам острой фазы»). Запуск активационного каскада вызывают различные агенты: а) комплексы антигенантитело (IgG, IgM) – классический путь активации; б) липополисахариды клеточной стенки грамотрицательных бактерий,
эндотоксины – альтернативный путь активации.
При активации системы комплемента образуются:
-мембрано-атакующий комплекс (С5b6789), который встраивается в мембрану клетки-мишени и нарушает её целостность; через образовавшийся канал в клетку устремляются вода и электролиты, что приводит к ее гибели;
-анафилотоксины (C3a и C5a), которые обеспечивают хемотаксис лейкоцитов, дегрануляцию тучных клеток и базофилов, расширение микрососудов и повышение их проницаемости;
-опсонины (C3b и C4b), облегчающие фагоцитоз клетки-
7
мишени.
Б) α- и β-интерфероны – цитокины, оказывающие противовирусное и противоопухолевое действие. α-интерферон образуют моноциты/макрофаги, нейтрофилы и В-лимфоциты, а β- интерферон – фибробласты.
В) С-реактивный белок (синтезируется в печени и относится к «белкам острой фазы») – белок плазмы крови, способен связывать и нейтрализовать бактериальные эндотоксины и иммунные комплексы (антиген-антитело), является опсонином.
Врождённые механизмы иммунитета представляют собой
первую линию защиты от биологической агрессии. Их преимуществом является быстрая скорость включения в «работу».
Они не обладают строгой специфичностью, так как не происходит распознавания индивидуальных макромолекул (антигенов) чужеродного агента, а распознаются только группы веществ (паттерны). Кроме того, данные механизмы не меняют своей эффективности после ознакомления с антигенами, т.е. не обладают свойством памяти.
Специфические (приобретённые, адаптивные) механизмы иммунитета
Комплекс процессов, обеспечивающих проявление адаптивного иммунитета, называется иммунным ответом. Клетки,
обеспечивающие адаптивный иммунитет, – Т- и В-лимфоциты. В-
лимфоциты развиваются из клеток-предшественников в красном костном мозге (у плода – первоначально в желточном мешке, печени и селезёнке). Развитие Т-лимфоцитов происходит в тимусе (вилочковой железе) из предшественников (претимоцитов), поступающих в него из красного костного мозга. Поэтому красный костный мозг и тимус называются центральными органами иммунной системы (центральными лимфоидными органами).
К периферическим лимфоидным органам относятся лимфатические узлы, селезёнка, а также лимфоидные образования, ассоциированные со слизистыми оболочками желудочно-
8
кишечного, дыхательного, мочеполового трактов и кожи (миндалины, собственно лимфатические фолликулы и Пейеровы бляшки). В этих органах лимфоциты выполняют свою функцию, осуществляя иммунный ответ.
Существует рециркуляция лимфоцитов – их миграция из крови в органы иммунной системы, периферические ткани и обратно в кровь. Цель рециркуляции – постоянное патрулирование тканей («иммунный надзор»), эффективное обнаружение чужеродных и изменённых собственных антигенов, снабжение органов лимфоцитопоэза информацией об антигенах в различных тканях.
Распознавание антигена
Лимфоциты распознают антигены с помощью специальных
антигенраспознающих рецепторов. У В-лимфоцитов эти
рецепторы (ВКР) представляют собой белки – иммуноглобулины (в основном IgM). Они способны распознавать и связывать как антигены, растворённые в биологических жидкостях, так и антигены, находящиеся в составе клеточной мембраны.
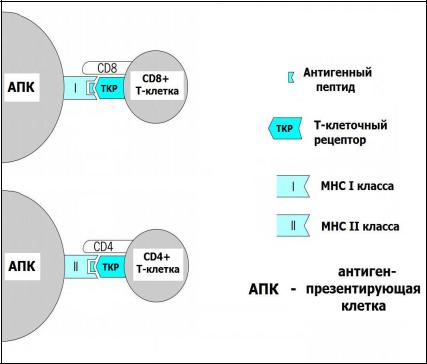
У Т-лимфоцитов специальные Т-клеточные рецепторы (ТКР) другого типа (рис. 2). Они распознают не свободный антиген, а его пептидные фрагменты (детерминанты), находящиеся в ассоциации с молекулами главного комплекса гистосовместимости – МНС (от англ. Major Histocompatibility Complex). Молекулы МНС I класса
содержатся на поверхности всех клеток, содержащих ядро. Молекулы МНС II класса – только на клетках, специализированных для презентации (т.е. представления) антигенов Т-лимфоцитам.
Эти клетки называются антиген-презентирующими (АПК), к ним относятся: дендритные клетки, макрофаги, В-лимфоциты и некоторые другие.
9
Рис. 2. Распознавание антигена Т-клетками.
В распознавании антигенных детерминант участвуют также
корецепторы CD4 и CD8. Корецептор CD8 участвует в распознавании антигенных пептидов ассоциированных с молекулами МНС I класса, а корецептор CD4 – антигенных пептидов, ассоциированных с молекулами МНС II класса. Т- клетки, экспрессирующие на своей поверхности молекулы CD8 (CD8+T-лимфоциты), являются цитотоксическими Т-
лимфоцитами (киллерами), а CD4+T-лимфоциты являются клетками-помощниками (хелперами).
Этапы иммунного ответа 1. Поглощение антигена антиген-презентирующей клеткой.
Презентация антигена Th0-клетке
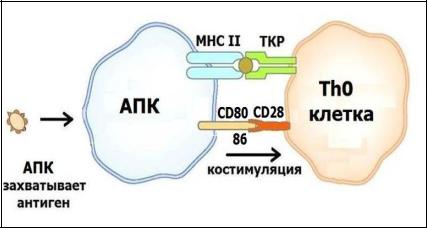
Впервые попадающий в организм антиген (обычно через слизистую оболочку или кожу) поглощается АПК. Эта клетка
10
перерабатывает антиген (процессинг антигена) и подвергает экзоцитозу. В результате антиген оказывается на наружной поверхности мембраны АПК в комплексе с молекулами МНС II класса (рис. 3).
Рис. 3. АПК представляет антиген Th0-клетке.
В таком виде АПК «представляет» антиген CD4+T-
лимфоциту хелперу (Th0-клетке). Его Т-клеточный рецептор соединяется со специфическим антигеном, а мембранная молекула CD4 с молекулами МНС II класса. Для активации Т- хелпера требуется также действие дополнительных сигналов – костимуляция. Она достигается благодаря взаимодействию костимулирующих молекул CD80, CD86, находящихся на поверхности АПК, и молекулы CD28, которая экспрессируется Т- хелпером.
Если распознавание антигена происходит без костимуляции, то вместо активации Т-хелпера возникнет его анергия, т.е. полное отсутствие активности.
2. Активация Тh0-клетки и её дифференцировка
Распознавание антигена Тh0-клеткой приводит к ее активации. Тh0-клетка начинает секретировать различные цитокины, прежде всего факторы роста. Это способствует
