
ПАВ
.docI. Поверхностные явления
Для коллоидных систем характерна большая раздробленность. Общая поверхность частиц дисперсной фазы достигает значительной величины. Поэтому и удельная поверхность — суммарная поверхность частиц в единице объема или в единице веса вещества — в диспергированном состоянии представляет величину порядка сотен и даже тысяч квадратных метров.
Для расчета удельной поверхности (Sуд) системы с шарообразными частицами достаточно знать величину среднего радиуса частицы:
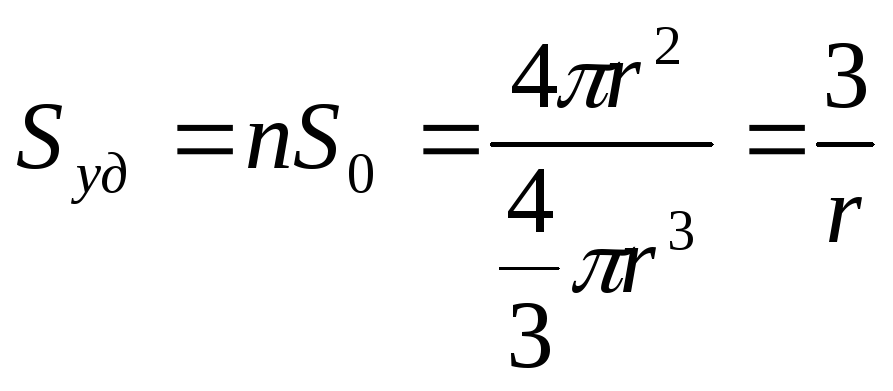 (м-1),
(м-1),
где n
—
число частиц в 1м3,
равное
![]() ,
а
S0
— поверхность
каждой
частицы.
,
а
S0
— поверхность
каждой
частицы.
Или
Sуд
=
n1S0
=
![]() (м2/кг),
(м2/кг),
где
n1
—
число частиц в 1кг,
равное
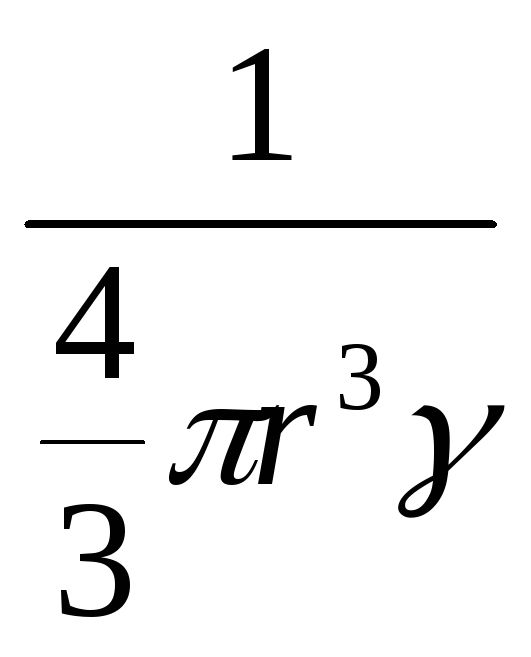 ,
γ
—плотность
вещества.
,
γ
—плотность
вещества.
Изучение поверхностных свойств является одной из важных проблем коллоидной химии.
Запас свободной поверхностной энергии А определяется суммарной поверхностью частиц S и коэффициентом поверхностного натяжения σ:
А = σS (дж/м2)
При отсутствии стабилизатора свободная поверхностная энергия коллоидной системы падает за счет уменьшения величины поверхности S(происходит коагуляция). Чтобы предотвратить агрегирование частиц, добавляют стабилизатор, который при неизменной величине поверхности снижает свободную поверхностную энергию, уменьшая поверхностное натяжение σ.
Величина поверхностного натяжения σ численно равна работе, которую необходимо затратить на образование 1м2 новой поверхности в изотермических условиях. Её размерность дж/м2 или н/м. Известно несколько методов определения поверхностного натяжения.
При использовании метода поднятия жидкости в капилляре применяют следующее уравнение:
![]() ,
,
Где σ — поверхностное натяжение жидкости (н/м), r —радиус капилляра (м), γ — плотность (кг/м3), g — ускорение силы тяжести (м/сек2).
Другой метод определения поверхностного натяжения — метод Траубе. С помощью сталагмометра подсчитывается, какое число капель стандартной жидкости n0 и исследуемой жидкости nх содержится в определенном объеме этих жидкостей:
![]() ,
,
Где γ0 и γх — плотности стандартной и исследуемой жидкостей, σ0 — поверхностное натяжение стандартной жидкости.
Для измерения поверхностного натяжения растворов можно применить также метод «отрыва кольца». Кольцо металлической проволоки опускается на поверхность жидкости и уравновешивается рычагом весов. Затем определяется усилие, которое нужно приложить, чтобы преодолеть силу сцепления кольца с жидкостью и оторвать кольцо от поверхности. Величина приложенной силы F, выраженная в килограммах, пропорциональна поверхностному натяжению жидкости σ (н/м):
F = kσ,
Где k — обобщенная константа, зависящая от диаметра проволоки, размеров кольца и краевого угла смачивания. Величину k определяют по стандартной жидкости, поверхностное натяжение которой известно, — обычно по воде.
Широко распространенным методом определения поверхностного натяжения является метод наибольшего давления пузырька, предложенный П. А. Ребиндером. К поверхности жидкости подводится вакуумная пробирка с капилляром, на конце которого под действием вакуума образуется воздушный пузырек. Давление, при котором пузырек проскакивает через поверхностную пленку жидкости и прорывает ее, определяется величиной поверхностного натяжения жидкости:
![]() ,
,
Где σ0 — поверхностное натяжение стандартной жидкости (н/м), рх и р0 — давления, необходимые для проскока пузырька через поверхность исследуемой и стандартной жидкости (н/м2).
Поверхностно-активными называются вещества, добавки которых уменьшают поверхностное натяжение растворителя. По отношению к воде — это органические кислоты, спирты, белки, мыла и другие дифильные (т.е. состоящие из полярной и неполярной частей) вещества.
Изменение поверхностного натяжения раствора при введении поверхностно-активных веществ определяют с помощью уравнения Шишковского:
![]() ,
,
где σ0 — поверхностное натяжение растворителя (н/м), σ — поверхностное натяжение раствора, а и b — эмпирические константы, причем величина а мало меняется от вещества к веществу, a b зависит от поверхностной активности вещества, с — концентрация раствора (кмоль/м3).
Мерой
поверхностной активности
вещества является
константа
b
в
уравнении Шишковского, а также
производная![]() ,
которая может быть определена графически,
если
известна зависимость поверхностного
натяжения от концентрации; при этом
берут величину производной при c→0.
Адсорбцией
называется
увеличение концентрации вещества
на поверхности раздела фаз. Для определения
количества адсорбирующегося вещества
могут применяться следующие
уравнения:
,
которая может быть определена графически,
если
известна зависимость поверхностного
натяжения от концентрации; при этом
берут величину производной при c→0.
Адсорбцией
называется
увеличение концентрации вещества
на поверхности раздела фаз. Для определения
количества адсорбирующегося вещества
могут применяться следующие
уравнения:
-
уравнение Гиббса, устанавливающее соотношение между величиной адсорбции Г (кмоль/м2), концентрацией раствора с (кмоль/м3) и мерой поверхностной активности
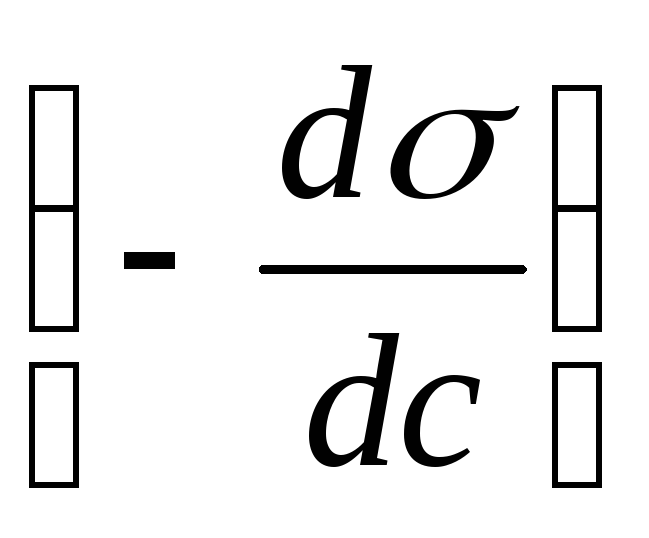 :
:
Г
= −![]() ,
,
где R — газовая постоянная, Т — температура (°К);
-
уравнение монослойной адсорбции Ленгмюра:
![]()
где Г— величина адсорбции (кмоль/м2); Г∞—предельное количество адсорбирующегося вещества (кмоль/м2), b —константа, характеризующая поверхностную активность вещества (ее значение то же, что и в уравнении Шишковского), с — равновесная концентрация растворенного вещества(кмоль/м3).
Константы Г∞ и b можно найти графически, преобразовав уравнение Ленгмюра в уравнение прямой:
![]()
Используя уравнение Шишковского, можно перейти от уравнения Гиббса к уравнению Ленгмюра. Для этого достаточно продифференцировать уравнение Шишковского:
−![]()
![]()
подставить выражение производной в уравнение Гиббса
![]()
![]() или
или
![]() ,
,
Очевидно,
![]() ,
и тогда
,
и тогда
![]()
3) при адсорбции газа или растворенного вещества на твердом адсорбенте используют эмпирическое уравнение Фрейндлиха:
Г = βcα (для растворов) или Г = βpα (для газов).
Уравнение Фрейндлиха хорошо согласуется с экспериментальными данными адсорбции в области средних концентраций. Чтобы вычислить константы β и α, достаточно прологарифмировать уравнение и построить прямую в координатах lg Г = f(lgc);
4) уравнение для расчета полислойной адсорбции разработано М. М. Дубининым. Изотерма адсорбции на адсорбентах с мелкими порами (средний радиус порядка 10-9 м) — они получили название адсорбентов I структурного типа — имеет вид:
![]()
а для крупнопористых адсорбентов II структурного типа (средний радиус порядка10-7—10-6 м):
![]()
где Г — величина адсорбции (кмоль/кг), ω — общая пористость (м3/кг), V — молярный объем адсорбируемого вещества в жидком состоянии (м3/кмоль), Т —температура (°K), k1 и k2 — константы, p — равновесное давление пара при данной температуре (н/м2), ps — давление насыщенного пара (по справочнику) (н/м2).
При
логарифмировании уравнение
переходит
в
линейную
форму, откуда графически легко определяется
пористость сорбентов. Для построения
кривых распределения
пор
сорбентов по радиусам применяют метод
капиллярной конденсации, заключающийся
в следующем. Экспериментально
определяют величину адсорбции в
зависимости от увеличения равновесного
давления, а затем определяют величину
десорбции при снижении равновесного
давления. На графике в координатах
![]() кривые
адсорбции и десорбции не совпадают —
образуется петля гистерезиса. Истинному
ходу процесса сорбции отвечает ветвь
десорбции; ее и используют для
расчета пористости ω
(м3/кг):
кривые
адсорбции и десорбции не совпадают —
образуется петля гистерезиса. Истинному
ходу процесса сорбции отвечает ветвь
десорбции; ее и используют для
расчета пористости ω
(м3/кг):
ω = Г∙V,
где Г — экспериментально определенная величина сорбции (кмоль/кг), V — молярный объем вещества (по справочнику) (м3/кмоль).
Для определения радиусов пор применяют уравнение Томсона
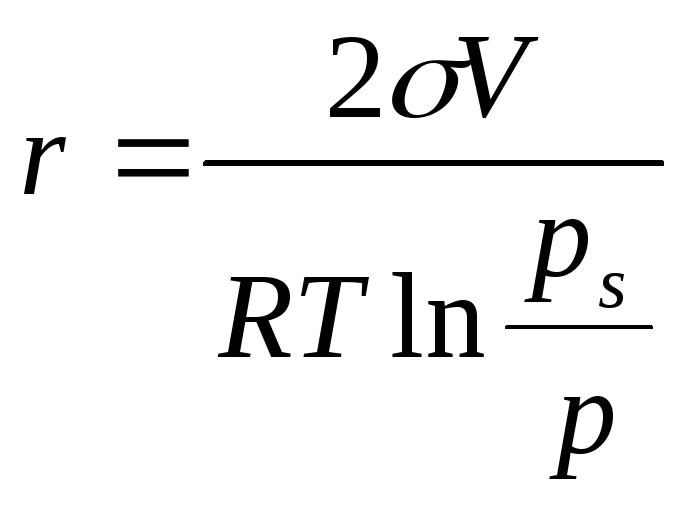 (м),
(м),
Где σ — поверхностное натяжение конденсата при данной температуре (дж/моль) (по справочнику), V— молярный объем конденсата (м3/кмолъ) (по справочнику), R — газовая постоянная, ps — давление насыщенного пара над поверхностью (н/м2) (по справочнику), р — равновесное давление в капилляре данного радиуса (н/м2) (из графика — по кривой десорбции), Т — температура (°К).
Интегральная
кривая строится в координатах ω = -f(r),
а дифференциальная — в координатах
![]() fср,
где Δωm
= ωm+1−
ωm,
Δr=rm+1−rm,
rср
— средний радиус, равный
fср,
где Δωm
= ωm+1−
ωm,
Δr=rm+1−rm,
rср
— средний радиус, равный
![]()
Процессы ионного обмена на твердой поверхности характеризуются уравнением Б. П. Никольского:
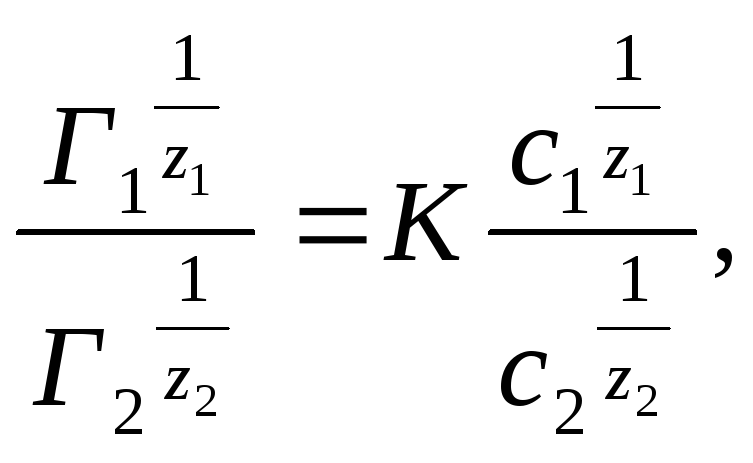
Где Г1 и Г2, — количество ионов, поглощенных поверхностью сорбента (кмоль/кг), с1 и c2 — равновесные концентрации ионов в растворе (кмоль/м3), К — константа обмена, зависящая от способности ионов к адсорбции на данном сорбенте.
Графически уравнение Б. П. Никольского изображается прямой, тангенс угла наклона которой и представляет величину константы К.
Задачи
1. Вычислить удельную поверхность золя сернистого мышьяка, средний диаметр частиц которого равен 120 • 10-9 м, а плотность γ = 3,43∙103 кг/м3 (ответ дать в м-1 и м2/кг).
2. Определить величину удельной поверхности суспензии каолина (плотность которого γ =2,5∙103 кг/м3), если ее частицы принять шарообразными и средний диаметр частиц считать равным 0,5∙10-6 м? Суспензию считать монодисперсной.
3. Найти удельную поверхность угля, применяемого в современных топках для пылевидного топлива, если известно, что угольная пыль предварительно просеивается через сита с отверстиями в 0,075∙10-3 м. Плотность угля γ = 1,8 кг/м3. Систему считать монодисперсной.
4. Вычислить удельную поверхность 1 кг угольной пыли с диаметром частиц, равным 0,08∙10-3 м. Плотность угля γ = 1,8 кг/м3.
5. Вычислить поверхностное натяжение глицерина, если в капилляре с радиусом г = 0,4∙10-3 м он поднялся на высоту h =26,8∙10-3 м. Плотность глицерина γ = 1,26 кг/м3.
6. Какова величина поверхностного натяжения ртути, если в стеклянном капилляре с радиусом г =0,6∙10 -3 м столбик ее опустился на 12∙10 -3 м ниже уровня ртути в сосуде?
7. Вычислить поверхностное натяжение анилина на границе с воздухом при 292°К, если методом наибольшего давления пузырьков получены следующие результаты: давление пузырька при проскакивании его в воду равно 11,82∙102 н/м2, а в анилин 711,5 н/м2. Поверхностное натяжение воды σ0 = 72,55∙10 -3 н/м.
8. Найти поверхностное натяжение анилина, если с помощью сталагмометра Траубе получены следующие данные: число капель анилина 42, плотность его γ = 1,4 кг/м3, число капель воды 18. Температура опыта 288°К. Поверхностное натяжение воды σ0 = 73,26 ∙10-3 н/м.
9. Во сколько раз изменится запас свободной поверхностной энергии водяного тумана, если радиус его капелек увеличится от 1∙10-6 до 1,2∙10-3 м при 288° К?
10. Во сколько раз увеличится свободная поверхностная энергия системы при пептизации геля Fe(OH)3, если при этом радиус частиц геля уменьшится от 1∙10-6 до 1∙10-9 м?
11. Для водного раствора пропилового спирта найдены следующие значения констант уравнения Шишковского (при 293°): а = 14,4∙10-3, b =6,6. Вычислить поверхностное натяжение раствора с концентрацией, равной 1 кмоль/м3. Поверхностное натяжение воды σ0 = 72,53∙ 10-3 н/м.
12. Даны константы уравнения Шишковского для водного раствора валериановой кислоты при 273°: а = 14,72∙10-3, b = 10,4. При какой концентрации поверхностное натяжение раствора будет составлять 52,1∙10-3 н/м, если поверхностное натяжение воды при 273° равно 75,49∙10-3 н/м?
13. Используя константы уравнения Шишковского (a = 12,6∙10-3, b = 21,5), рассчитать поверхностное натяжение для водных растворов масляной кислоты при 273° для следующих концентраций (кмоль/м3): 0,007, 0,021, 0,05 0,104 и построить кривую в координатах σ = f(c). Поверхностное натяжение воды σ0 = 75,49∙10-3 н/м.
14. Пользуясь графическим методом, найти поверхностную активность масляной кислоты на границе водного раствора с воздухом при 293° по следующим экспериментальным данным:
|
Концентрация с, кмоль/м3 |
0,00 |
0,021 |
0,050 |
0,104 |
0,246 |
|
Поверхностное натяжение σ∙103,н/м |
72,53 |
68,12 |
63,53 |
58,60 |
50,30 |
15. Вычислить адсорбцию масляной кислоты на поверхности раздела водного раствора с воздухом при 273° и концентрации с = 0,1 кмоль/м3, если зависимость поверхностного натяжения от концентрации выражается уравнением Шишковского:
σ = σ0−16.7∙10-3ln(1+21,5c).
16. Найти адсорбцию пропионовой кислоты на поверхности раздела водный раствор — воздух при 273° и концентрации 0,5 кмоль/м3 по константам Шишковского: а = −12,5∙10-3 и b = 7,73.
17. Найти поверхностную активность валериановой кислоты на границе ее водного раствора с воздухом при 298° и концентрации 0,01 кмоль/м3 по константам Шишковского: а = 17,7∙10-3 и b = 19,72.
18. Вычислить адсорбцию масляной кислоты на поверхности раздела водный раствор — воздух при 283° и концентрации с =0,104 кмоль/м3, используя следующие экспериментальные данные *.
|
Концентрация с, кмоль/м3 |
0,00 |
0,021 |
0,050 |
0,104 |
0,246 |
0,489 |
|
Поверхностное натяжение σ∙103,н/м |
74,01 |
69,51 |
64,30 |
59,85 |
51,09 |
44,00 |
* Задачу можно решить двумя способами: графическим и расчетным, для ознакомления с которым следует использовать книгу Н.Н. Цюрупа «Практикум по коллоидной химии», «Высшая школа». 1963.
19. Вычислил» адсорбцию н-валериановой кислоты на поверхности раздела водный раствор — воздух при 293° и концентрации с = 0,0206 кмоль/м3, если зависимость поверхностного натяжения раствора от концентрации представлена следующими экспериментальными данными:
|
Концентрация с, кмоль/м3 |
0,00 |
0,0103 |
0,0206 |
0,0683 |
0,2049 |
|
Поверхностное натяжение σ∙103,н/м |
72,53 |
65,45 |
59,78 |
49,31 |
35,20 |
См. примечание к задаче 18.
20. Используя уравнение Ленгмюра, вычислить адсорбцию пропионовой кислоты на поверхности раздела водный раствор — воздух при 293° и концентрации с = 0,1 кмоль/м3, если известны константы уравнения Шишковатого: а = 12,8∙10-3 , b = 7,16.
21. Вычислить по формуле Ленгмюра величину адсорбции изоамилового спирта концентрации с = 0,1 кмоль/м3 на поверхности раздела водный раствор — воздух при 292° по данным константам: Г∞ = 8,7-10-9 кмоль/м2, b= 42.
22. Для водного раствора изомасляной кислоты при 291° найдены константы уравнения Шишконосого: а = 13,1∙10-3 и b = 2,2. Чему равна адсорбция при концентрациях с1 = 0,01, c2 = 0,l и с3 = 1 кмоль/м3?
23. По экспериментальным данным построить кривую адсорбции углекислого газа на цеолите при 293° и с помощью графического метода определить константы уравнения Ленгмюра:
|
Равновесное давление p∙10-2, н/м2 |
1,0 |
5,0 |
10,0 |
30,0 |
75,0 |
100,0 |
200,0 |
|
Величина адсорбции Г∙103, кг/кг |
35,0 |
86,0 |
112,0 |
152,0 |
174,0 |
178,0 |
188,0 |
24. Используя уравнение Ленгмюра, вычислить величину адсорбции азота на цеолите при давлении р = 2,8∙102, если Г∞ = 38,9-10-3 кг/кг, а b = 0,156-10-2. 25. Найти площадь, приходящуюся на одну молекулу в насыщенном адсорбционном слое анилина на поверхности его водного раствора, если предельная адсорбция Г∞ = 6,0-10-9 кмоль/м?
26. Какова площадь, приходящаяся на одну молекулу изомасляной кислоты на поверхности раздела водный раствор — воздух, если предельная адсорбция Г∞ = 5,42∙10-9 кмоль/м2?
27. По экспериментальным данным адсорбции углекислого газа на активированном угле найти константы уравнения Ленгмюра, пользуясь которыми рассчитать и построить кривую адсорбции:
|
Равновесное давление p∙10-2, н/м2 |
9,9 |
49,7 |
99,8 |
200,0 |
297,0 |
398,5 |
|
Величина адсорбции Г∙103, кг/кг |
32,0 |
70,0 |
91,0 |
102,0 |
107,3 |
108,0 |
28. По константам уравнения Ленгмюра Г∞ = 182∙10-3 и b =0,1∙10-2 рассчитать и построить кривую адсорбции углекислого газа на активированном угле в пределах следующих равновесных давлений газа: 10∙102 —100∙102.
29. Построить кривую адсорбции углекислого газа на активированном угле при 231° и определить константы эмпирического уравнения Фрейндлиха, используя следующие экспериментальные данные:
|
Равновесное давление p∙10-2, н/м2 |
10,0 |
44,8 |
100,0 |
144,0 |
250,0 |
4552,0 |
|
Величина адсорбции Г∙103, кг/кг |
32,3 |
66,7 |
96,2 |
117,2 |
145,0 |
177,0 |
30. Используя константы эмпирического уравнения Фрейндлиха β = 1,6-10 -3 и α =0,48, построить кривую адсорбции углекислого газа на активированном угле при 271° в интервале давлений от 2-102 до 30-102 н/м2.
31. Установить, к какому структурному типу сорбентов можно отнести молекулярные сита, если при сорбции на них паров воды при 353° получены следующие экспериментальные данные:
|
Равновесное давление p∙10-2, н/м2 |
1,33 |
2,66 |
5,32 |
6,65 |
9,30 |
13,30 |
17,30 |
|
Величина адсорбции Г∙103, кмоль/кг |
7,0 |
7,7 |
8,34 |
8,63 |
8,90 |
9,12 |
9,33 |
Давление насыщенного пара ps = 472∙102 н/м2.
32. Используя данные задачи №31, определить общую пористость молекулярных сит (молярный объем воды V = 0,018 м3/кмоль при 353°).
33. Определить общую пористость цеолита (адсорбент структурного типа). При адсорбции на цеолите этана 298° получены следующие экспериментальные данные:
|
Равновесное давление p∙10-2, н/м2 |
50 |
100 |
150 |
200 |
300 |
500 |
|
Величина адсорбции Г∙103, кмоль/кг |
2,0 |
2,37 |
2,53 |
2,63 |
2,77 |
2,84 |
Давление насыщенного пара рs = 37∙105 н/м2, малярный объем этана V = 0,064 м3/ кмоль.
34. Определить пористость молекулярных сит, используя экспериментальные данные сорбции углекислого; газа при 256е:
|
Равновесное давление p∙10-2, н/м2 |
25 |
50 |
100 |
150 |
200 |
300 |
500 |
|
Величина адсорбции Г∙103, кмоль/кг |
3,64 |
3,83 |
3,94 |
4,03 |
4,10 |
4,19 |
4,27 |
Давление насыщенного пара Ps=23,7∙105 н/м2, молярный объем углекислого газа V = 0,0354 м3/кмоль. При, расчете пользоваться уравнением Дубинина для сорбентов I структурного типа.
35. При исследовании капиллярной конденсации паров воды в порах активированного угля (293°) получены следующие экспериментальные данные:
|
Равновесное давление p∙10-2, н/м2 |
5,32 |
10,0 |
11,3 |
12,5 |
14,7 |
17,3 |
20,0 |
23,3 |
|
Величина сорбции Г∙103, кмоль/кг: По кривой адсорбции |
0,5 |
2,3 |
4,0 |
5,0 |
10,0 |
16,0 |
20,0 |
28,5 |
|
По кривой десорбции |
0,5 |
2,5 |
5,0 |
7,5 |
15,0 |
23,0 |
27,6 |
28,5 |
Показать графически наличие гистерезиса и рассчитать дифференциальную кривую распределения пор по радиусам. Молярный объем воды V = 0,018 м3/кмоль, давление насыщенного пара рs = 23,4∙102 н/м2, поверхностное натяжение воды σ =72,5∙10-3 дж/м2.
36. Построить кривую капиллярной конденсации (петля гистерезиса) и дифференциальную кривую распределения пор по радиусам, пользуясь экспериментальными данными капиллярной конденсации паров воды в порах активированного угля при 293°:
