
Quality_Analis_Ukr
.pdf
1.Дія аргентуму нітрату. Аргентуму нітрат утворює з ціанід-іонами білий аморфний осад
AgCN. Повне осадження досягається тільки при великому надлишку AgNO3, оскільки осад AgCN розчиняється в надлишку ціанідів з утворенням комплексної сполуки
K[Ag(CN)2]. При подальшому додаванні AgNO3 комплексний іон розкладається і виділяється осад AgCN:
AgNO3 + KCN = ↓AgCN + KNO3
AgCN + KCN = K[Ag(CN)2]
K[Ag(CN)2] + AgNO3 = ↓2AgCN + KNO3
Тому виявлення ціанід-іона цією реакцією краще проводити, додаючи досліджуваний розчин до розчину аргентуму нітрату, а не навпаки.
Аргентуму ціанід не розчиняється у азотній кислоті, але легко розчиняється у розчині амонію гідроксиду, натрію тіосульфату і розчинах ціанідів лужних металів з утворенням відповідних комплексних сполук.
2.Реакція переведення ціанідів у тіоціанати. Під дією амонію полісульфіду на розчин ціаніду лужного металу ціанід-іон перетворюється у тіоціанат-іон, який можна виявити за допомогою іона Fe3+ або Co2+:
KCN + (NН4)2S2 = KSCN + (NН4)2S
FeCl3 + 3 KSCN = Fe(SCN)3 + 3KCl
CoCl2 + 4KSCN = K2[Co(SCN)4] + 2KCl
3.Реакція утворення „берлінської блакиті”. Для проведення цієї реакції ціанід-іони
переводять у комплексний іон [Fe(CN)6]2- взаємодією ціанід-іонів з FeSO4 у лужному середовищі і після цього вводять у реакцію з FeCl3 у кислому середовищі:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 Fe(OH)2 + 6KCN = K4[Fe(CN)6] + 2KOH 4FeCl3 + 3K4[Fe(CN)6] = ↓Fe4[Fe(CN)6]3 + 12KCl
COOH
Реакції виявлення бензоатіонів:
Структурна формула бензойної кислоти:
1.Дія феруму(III) хлориду (ДФУ). Феруму(ІІІ) хлорид у нейтральному середовищі утворює
збензоатами блідо-жовтий осад феруму(ІІІ) бензоату:
COONa |
COO-FeCl2 |
+ FeCl3 |
+ NaCl |
Проведенню реакції заважають феноли.
Виконання реакції. До 1 мл досліджуваного розчину додають 0,5 мл розчину феруму(ІІІ); утворюється блідо-жовтий осад, розчинний у ефірі.
81

2.Дія кислоти сульфатної концентрованої (ДФУ). 0,2 г випробовуваної субстанції, якщо необхідно, здрібненої, поміщають у пробірку, змочують 0,2 мл або 0,3 мл кислоти сульфатної, обережно нагрівають дно пробірки; на внутрішніх стінках пробірки з’являється білий наліт.
3.Дія кислоти хлоридної. 0,5 г випробовуваної субстанції розчиняють у 10 мл води. До одержаного розчину або до 10 мл досліджуваного розчину додають 0,5 мл кислоти хлоридної; утворюється осад, який після перекристалізації з теплої води і висушування у вакуумі має температуру плавлення від 120 ºС до 124 ºС:
COONa |
COOH |
+ HCl |
+ NaCl |
Реакції аніонів третьої аналітичної групи
До третьої аналітичної групи відносяться NO3–, NO2–, CH3COO–, MnO4–, саліцилат- іони. Дана група не має групового реагенту.
Реакції виявлення нітрат-іонів:
1. Дія дифеніламіну. Дифеніламін відновлює нітрати, окислюючись при цьому до дифенілбензидину, а потім – до хіноїдної сполуки, що має синє забарвлення:
2 |
N |
|
H |
N |
N |
H |
H |
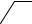 N
N 
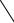
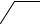
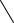
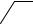
 N
N 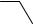
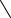
Реакцію дають також нітрити, хромати, перманганати. Межа виявлення – 0,5 мкг нітрат-іонів.
2. Реакція утворення «бурого кільця» з сульфатом феруму(II). Феруму сульфат у кислому середовищі відновлює нітрати до оксиду азоту(ІІ):
2NaNO3 + 6FeSO4 + 4H2SO4 = 3Fe2(SO4)3 + Na2SO4 + 2NO + 4H2O
Оксид азоту(ІІ) утворює з FeSO4 комплексну сполуку [FeNO]SO4 бурого кольору:
FeSO4 + NO = [FeNO]SO4
82

Реакцію проводять, обережно нашаровуючи на кристалики FeSO4 досліджуваний розчин і концентровану сульфатну кислоту. При цьому з’являється коричневе кільце. Чутливість реакції – 2,5 мкг нітрат-іонів.
3. Реакція з металічним цинком і концентрованим розчином натрію гідроксиду. Цинк,
магній та алюміній у лужному середовищі відновлюють нітрат-іони до аміаку, який виявляють за посинінням червоного лакмусового папірця:
NaNO3 + 4Zn + 7NaOH + 6H2O = ↑NH3 + 4Na2 [Zn(OH)4]
4. Реакція з антипірином. У середовищі концентрованої сульфатної кислоти нітрати з антипірином утворюють нітроантипірин червоного кольору:
H3C |
|
H3C |
|
|
|
|
NO2 |
|
|||||
|
|
|
|
+ NaNO3 + H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NaHSO + H O |
||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
H3C N O |
|
H3C |
|
|
|
|
|||||||
|
|
N O |
|
||||||||||
|
|
|
|
|
|||||||||
|
|
C6H5 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
C6H5 |
|
|||||||
5.Реакція з нітробензолом (ДФУ). Наважку порошку субстанції, еквівалентну близько
1 мг нітрат-іону (NO3–), або кількість, зазначену у окремій статті, додають до суміші 0,1 мл нітробензолу і 0,2 мл кислоти сульфатної і через 5 хв. охолоджують у льодяній воді. Продовжуючи охолодження, повільно при перемішуванні додають 5 мл води, 5 мл розчину натрію гідроксиду концентрованого, 5 мл ацетону, збовтують і відстоюють; верхній шар набуває темно-фіолетового забарвлення.
6.Реакція з калію перманганатом (ДФУ). Розчин, що містить випробовувану субстанцію
укількості, еквівалентній близько 2 мг нітрат-іона (NO3–), не знебарвлює розчин 1 г/л калію перманганату, підкислений кислотою сульфатною розведеною (відмінність від нітритів).
Реакції виявлення нітрит-іонів:
1.Дія антипірину в кислому середовищі (ДФУ). У середовищі концентрованої сульфатної кислоти нітрити з антипірином дають нітрозоантипірин зеленого кольору:
H3C |
|
|
|
|
|
|
H3C |
|
|
|
|
NO |
|
|
|
|
|
|
|
+ NaNO2 + H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NaHSO + H O |
||
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
|
N O |
|
H C |
|
|
|
|
|||||||
|
|
|
N O |
|
||||||||||
|
|
|
3 |
|
|
|
|
|||||||
|
|
|
|
|
||||||||||
|
|
C6H5 |
|
|
|
C6H5 |
|
|||||||
Виконання реакції. Кілька кристалів антипірину розчиняють у фарфоровій чашці в 0,1 мл кислоти хлоридної розведеної, додають 0,1 мл розчину, що містить 1 мг нітрит- іонів (NO2–); з’являється зелене забарвлення (відмінність від нітратів).
2.Дія мінеральних кислот. При взаємодії з кислотами нітрити виділяють вільну азотисту кислоту:
2NaNO2 + H2SO4 = К2SO4 + 2НNO2
83

Азотиста кислота є нестійкою і розкладається з утворенням оксидів азоту та води:
2НNO2 = ↑NO2 + ↑NO + H2O
3.Дія калію перманганату. Калію перманганат у кислому середовищі окислює нітрити до нітратів; при цьому розчин калію перманганату обезбарвлюється внаслідок утворення іонів Mn2+:
5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 5NaNO3 + 3H2O
4.Реакція утворення «бурого кільця» з феруму(II) сульфатом. Феруму сульфат у кислому середовищі, аналогічно до нітратів, відновлює нітрити до оксиду азоту(ІІ):
2NaNO2 + 2FeSO4 + 2H2SO4 = Fe2(SO4)3 + Na2SO4 + 2NO + 2H2O
Оксид азоту (ІІ) утворює з FeSO4 комплексну сполуку [FeNO]SO4 бурого кольору:
FeSO4 + NO = [FeNO]SO4
Реакцію проводять, обережно нашаровуючи на кристалики FeSO4 досліджуваний розчин і концентровану сульфатну кислоту. При цьому з’являється коричневе кільце. Чутливість реакції – 2,5 мкг нітрит-іонів.
5.Дія калію йодиду. Калію йодид у кислому середовищі відновлює нітрити до оксиду азоту(ІІ), окислюючись при цьому до вільного йоду, який виявляють за побурінням розчину, або за посинінням розчину крохмалю:
2KNO2 + 2KI +2H2SO4 = I2 + 2K2SO4 + 2NO + 2H2O
6.Дія дифеніламіну. Дифеніламін відновлює нітрити аналогічно до нітратів, окислюючись при цьому до дифенілбензидину, а потім до хіноїдної сполуки, що має синє забарвлення:
2 |
N |
|
H |
N |
N |
H |
H |
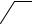 N
N 
 N
N 
Реакцію дають також нітрати, хромати, перманганати. Межа виявлення – 0,5 мкг нітрит-іонів.
7.Реакція з сульфаніловою кислотою та α- чи β-нафтолом (реакція Гріса). При взаємодії сульфанілової кислоти з натрію нітритом у кислому середовищі утворюється сіль діазонію, яка вступає у реакцію азосполучення з нафтолами з утворенням азобарвника яскраво-червоного кольору:
84

|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
N |
|
N |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NaNO |
2 |
+ 2HCl |
|
|
|
|
|
|
|
|
|
|
|
Cl + NaCl + 2H2O |
|||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO3H |
|
|
|
|
|
|
SO3H |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
+ |
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
N |
|
N |
|
||||||
N |
|
N |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
+ NaCl + H2O
Cl + |
+ NaOH |
SO H |
SO3H |
3 |
|
Межа виявлення – 0,01 мкг нітрит-іонів.
Реакції виявлення ацетат-іонів:
1.Реакція утворення етилацетату (ДФУ). Етанол (бутанол, пентанол та інші спирти) у присутності концентрованої сульфатної кислоти утворює з оцтовою кислотою етилацетат з характерним приємним запахом:
2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4 CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Заважають хлориди, броміди, йодиди, сульфіти, сульфіди, тіосульфати, які при дії концентрованої сульфатної кислоти виділяють гази з гострим запахом.
Виконання реакції. 2 мл розчину, що містить близько 20-60 мг ацетат-іону (CH3COO–), нагрівають з рівною кількістю кислоти сульфатної концентрованої і 0,5 мл 96 % спирту; утворюється етилацетат, який виявляють за запахом.
2.Дія феруму(III) хлориду (ДФУ). Реакція з хлоридом феруму(ІІІ) переводить ацетати у комплексну сполуку червоно-бурого кольору:
FeCl3 + 3CH3COONa = Fe(CH3COO)3 + 3NaCl 3Fe(CH3COO)3 + 2H2O = [Fe3(CH3COO)6(OH)2](CH3COO) + 2CH3COOH
Виконання реакції. До 2 мл нейтрального розчину, що містить близько 20-60 мг ацетат- іону (CH3COO–), додають 0,2 мл розчину (30 г/л) феруму(ІІІ) хлориду; з’являється червоно-буре забарвлення, яке зникає при додаванні кислот мінеральних розведених.
3.Дія кислоти щавлевої (ДФУ). Випробовувану субстанцію нагрівають з рівною кількістю кислоти щавлевої; виділяється кислота оцтова, яка виявляється за запахом і кислою реакцією:
2CH3COONa + H2С2O4 = 2CH3COOH + Na2С2O4
85

4.Дія лантану нітрату, йоду та розчину аміаку (ДФУ). Близько 30 мг випробовуваної субстанції розчиняють у 3 мл води. До одержаного розчину або до 3 мл досліджуваного розчину послідовно додають 0,25 мл розчину лантану нітрату, 0,1 мл 0,05 М розчину йоду і 0,05 мл розчину аміаку розведеного. Суміш обережно нагрівають до кипіння; протягом декількох хвилин утворюється синій осад або з’являється синє забарвлення.
5.Дія аргентуму нітрату. Аргентуму нітрат утворює білий осад аргентуму ацетату тільки у концентрованих розчинах:
AgNO3 + CH3COONa = ↓CH3COOAg + NaNO3
Реакції виявлення перманганат-іонів:
1.Дія відновників (калію йодиду, оксалатної кислоти, натрію нітриту). Відновники у
кислому середовищі відновлюють іони MnO4-, що мають фіолетово-червоне забарвлення, до Mn+2. При цьому розчини, що містять перманганат-іони, знебарвалюються:
2KMnO4 + 10KІ + 8H2SO4 = 2MnSO4 + 5І2 + 6K2SO4 + 8H2O 5H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 8H2O 5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 5NaNO3 + 3H2O
COOH
Рекації виявлення саліцилат іонів:
OH
Структурна формула саліцилової кислоти:
1.Дія феруму(III) хлориду (ДФУ). Феруму(ІІІ) хлорид утворює з саліцилат-іонами феруму(ІІІ) саліцилат синьо-фіолетового або червоно-фіолетового кольору (залежно від складу).
COOH |
COO |
FeCl |
OH |
|
O |
+ FeCl3 |
|
+ 2HCl |
Забарвлення зникає при додаванні хлоридної кислоти (утворення осаду саліцилової кислоти) і зберігається при додаванні оцтової кислоти.
Виконання реакції. До 1 мл досліджуваного розчину додають 0,5 мл розчину феруму(ІІІ) хлориду; з’являється фіолетове забарвлення, яке не зникає після додавання 0,1 мл кислоти оцтової.
2.Дія кислоти хлоридної (ДФУ). 0,5 г випробовуваної субстанції розчиняють у 10 мл води. До одержаного розчину або до 10 мл досліджуваного розчину додають 0,5 мл кислоти хлоридної; утворюється осад, який після перекристалізації з гарячої води і висушування у вакуумі має температуру плавлення від 156 ºС до 161 ºС:
86

COONa |
|
COOH |
|
|
|
OH |
|
OH |
|
|
|
|
+ HCl |
+ NaCl |
|
|
3.Реакція утворення метилсаліцилату. Метанол у присутності концентрованої сульфатної кислоти з саліциловою кислотою утворює метилсаліцилат з характерним запахом:
|
|
COOH |
|
|
|
|
|
COO-CH3 |
||||
|
|
|||||||||||
|
|
|
OH |
|
|
|
|
|
|
OH |
||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
|
|
|
|
+ CH3OH |
|
|
|
|
|
|
|
|
|
|
|
H2SO4 conc. |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
Аналіз суміші аніонів першої–третьої аналітичних груп
Студенти самостійно проводять аналіз розчину невідомого складу, який містить суміш аніонів I-III аналітичних груп. Хід аналізу суміші I-III аналітичних груп полягає у проведенні попередніх проб.
Більшість аніонів відкривають дробними реакціями, тому груповий реагент використовується тільки для виявлення аналітичної групи.
Для спрощення аналізу проводять також проби на аніони нестійких кислот, аніони з окислювальними та відновними властивостями.
Аналіз сумішей деяких аніонів проводиться за систематичним ходом аналізу (аналіз суміші галогенідів, суміші аніонів, що містять сірку, суміші нітрат- та нітрит-іонів та ін.).
1. Попередні проби.
1.1.Проба на аніони першої аналітичної групи. В пробірку вносять 0,5 мл отриманого розчину сумішей аніонів і перевіряють pH (по універсальному індикатору). Якщо розчин є кислим, то 0,5 М розчином натрію гідроксиду встановлюють нейтральне чи слаболужне середовище (рН 7-9). Після цього в досліджуваний розчин по краплях приливають розчин барію хлориду. Утворення осаду вказує на наявність аніонів першої групи.
Осад обробляють 2М розчином хлоридної кислоти. Якщо осад не розчиняється, то це вказує на наявність сульфат-іонів (при цьому також може виділитись осад сірки).
У деяких випадках при обробці розчином барію хлориду не осаджуються флуорид- тетраборат- і тіосульфат-іони. Тому ці аніони відкривають у суміші дрібними реакціями.
1.2.Проба на аніони другої аналітичної групи. До 0,5 мл досліджуваного розчину додають 0,5 мл розведеної нітратної кислоти і 3-4 краплі розчину аргентуму нітрату. Поява осаду вказує на наявність аніонів другої аналітичної групи.
1.3.Проба на аніони, що мають відновні властивості.
а) виявлення арсеніт-іонів. До 2-З крапель досліджуваного розчину додають 2- 3 краплі насиченого розчину натрію гідрокарбонату і розведений розчин йоду. Знебарвлення розчину йоду свідчить про наявність арсеніт-іонів.
б) виявлення тіосульфат-, сульфіт-, сульфід-іонів. В пробірку вносять 3-4 краплі досліджуваного розчину, який підкисляють 1 М розчином сульфатної кислоти, після чого по краплях додають розведений розчин йоду. Знебарвлення розчину йоду вказує на наявність даних аніонів.
87

1.4. Проба на аніони-окисники.
а) Виявлення арсенат-іонів (з розчином калію йодиду в середовищі концентрованої хлоридної кислоти). До 0,3 мл досліджуваного розчину додають 0,3 мл концентрованої хлоридної кислоти, 0,5 мл хлороформу і 3-4 краплі розчину калію йодиду. Якщо хлороформовий шар забарвиться в червоно-фіолетовий колір, це вказує на наявність арсенат- іонів.
б) виявлення аніонів окисників з калію йодидом у слабко кислому середовищі. Для цього до 0,5 мл досліджуваного розчину додають 0,5 мл 1 М розчину сульфатної кислоти, 1 мл хлороформу і 3-4 краплі розчину йодиду калію. Забарвлення хлороформового шару у червоно-фіолетовий колір свідчить про наявність аніонів окисників.
1.5. Проба на аніони нестійких кислот. До 0,5 мл досліджуваного розчину вносять по краплях 1 М розчин сульфатної кислоти. Виділення газів вказує на можливу присутність нітрит-, карбонат-, сульфіт-, тіосульфат-іонів.
2. Відокремлення та виявлення оксалат-іонів.
В пробірку вносять 0,3 мл досліджуваного розчину, підкисляють 2 М розчином ацетатної кислоти, після чого по краплях додають розчин кальцію хлориду до повного осадження осаду. Осад відокремлюють центрифугуванням, промивають дистильованою водою і розчиняють у 2 М розчині сульфатної кислоти. Розчин нагрівають на водяній бані і до нагрітої суміші приливають 2-3 краплі розчину калію перманганату. Знебарвлення розчину вказує на присутність оксалат-іонів.
3. Аналіз суміші галогенідів.
В пробірку вносять 0,5 мл досліджуваного розчину, приливають до нього 2 М розчин нітратної кислоти (до pH 3-4) і по краплях розчин аргентуму нітрату до повного осадження. Після чого суміш центрифугують. Осад галогенідів аргентуму промивають дистильованою водою і обробляють 15% розчином амонію карбонату. При цьому хлорид аргентуму розчиняється, а в осаді залишаються бромід- та йодид аргентуму. Суміш центрифугують і в центрифугаті виявляють хлорид-іони.
а) виявлення хлорид-іонів. Центрифугат ділять на дві частини. До однієї частини додають по краплях розведену нітратну кислоту, а до другої – декілька крапель калію йодиду.
б) виявлення бромідта йодид-іонів. Осад броміду та йодиду аргентуму обробляють розчином аміаку. При цьому бромід аргентуму розчиняється, а в осаді залишається йодид аргентуму. У розчині відкривають бромід-іони по реакції з хлорною водою чи броматом калію. При цьому до суміші приливають 0,5 мл хлороформу. Від виділеного брому хлороформовий шар забарвиться в жовто-бурий колір.
Осад аргентуму йодиду розчиняють у розчині ціаніду калію і проводять реакцію на йодид-іони із розчином дихромату калію в кислому середовищі та з наступною екстракцією виділеного йоду хлороформом, який приливають у досліджувану суміш.
4. Аналіз нітрат- та нітрит-іонів у суміші.
4.1.Виявлення нітрит-іонів. На фарфорову пластинку вносять декілька кристаликів антипірину і 2-3 краплі розведеного розчину хлоридної кислоти. Після цього додають 2 краплі досліджуваного розчину.
4.2.Виявлення нітрат-іонів. Відкриттю нітрат-іонів заважають нітрит-, бромід-, йодид-іони. Для відокремлення нітрит-іонів до 0,5 мл досліджуваного розчину додають декілька кристалів амонію хлориду і суміш нагрівають на водяному нагрівачі до повного виділення азоту. Про відсутність нітрит-іонів вказуватиме негативний результат реакції з розчином калію йодиду у кислому середовищі.
88

Для усунення впливу бромід- та йодид-іонів 0,5 мл досліджуваного розчину підкислюють 2-3 краплями 2 М розчину хлоридної кислоти і додають 0,5 мл хлорної води. Суміш нагрівають на водяному нагрівачі до повного знебарвлення.
Після цього, з обох розчинів, отриманих після усунення нітрит- та бромід- і йодид- іонів відбирають по декілька крапель розчинів, переносять у дві пробірки і в кожну із них приливають по 0,2 мл розчину феруму (II) сульфату та обережно по стінці пробірки приливають по 3-4 краплі концентрованої сульфатної кислоти. Поява «бурого кільця» вказуватиме на нітрат-іони у розчині.
5. Аналіз суміші сульфід-, сульфіт-, тіосульфат-, сульфат-іонів.
а) виявлення сульфід-іонів. До декількох крапель досліджуваного розчину суміші аніонів додають декілька крапель 0,5 М розчину натрію гідрокарбонату і 3-4 краплі нітропрусиду натрію.
б) відокремлення сульфід-іонів. Якщо попередньою реакцією були відкриті сульфід- іони, то в пробірку вносять 1 мл досліджуваного розчину і осаджують сульфід-іони насиченим розчином кадмію карбонату та перевіряють повноту осадження. Після чого суміш центрифугують. Осад не аналізують, а центрифугат використовують для дослідження.
в) виявлення тіосульфат-іонів. До центрифугату приливають розчин стронцію хлориду, внаслідок чого осаджуються сульфіт- та сульфат-іони, а в розчині залишаються тіосульфат-іони. Суміш центрифугують і в центрифугаті відкривають тіосульфат-іони реакцією з 2 М розчином хлоридної кислоти чи реакцією з розчином йоду.
г) виявлення сульфітта сульфат-іонів. До осаду сульфіту і сульфату стронцію приливають 0,5 мл 2 М розчину хлоридної кислоти та 0,5 мл розчину йоду. В присутності сульфіт-іонів розчин йоду знебарвиться. Нерозчинність осаду в хлоридній кислоті вказує на сульфат-іони.
6. Виявлення всіх інших аніонів проводять дробним шляхом у будь-якій послідовності за допомогою специфічних реакцій.
Деякі аніони заважають відкриттю один одного у сумішах. Тому для відкриття цих аніонів використовують елементи систематичного ходу аналізу (особливі випадки). Схеми цих випадків наводяться нижче.
Схема аналізу суміші галогенідів
|
CH3Cl |
|
надл. |
|
|||||||||
Cl-, Br-, I- |
|
|
|
I |
|
|
|
|
Br , IO - |
||||
|
|
|
|
|
|||||||||
|
2 |
2 |
3 |
||||||||||
|
Cl2 |
|
Cl2 |
|
|||||||||
AgNO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2M HNO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AgCl |
|
AgBr |
|
AgI |
|
|
|
|
|||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 15% (NH4)CO3
[Ag(NH3)2]

 AgBr
AgBr 
 AgI
AgI 

+ HNO3
AgCl 
89

|
Аналіз суміші нітрат- та нітрит-іонів |
|
|
|||
+ 2M HCl |
|
|
|
CH3 |
|
NO |
- |
- |
антипірин |
|
|
||
NO , NO2 |
NO3 |
, NO2 |
|
|
N |
|
|
|
|
|
|
O |
|
|
|
NH4Cl крист., t°C |
CH3 |
N |
||
|
|
|
|
|
||
- |
|
|
N2 |
|
|
|
NO3 |
|
|
|
|
|
|
FeSO4, H2SO4 конц. |
|
|
|
|
||
[FeNO]SO4 |
|
|
|
|
|
|
Схема аналізу суміші сірковмісних аніонів
Na4[Fe(CN)5NOS] |
|
NaHCO3 |
|
|
|
SO4 |
-2 |
, SO3 |
-2 |
, S2O3 |
-2 |
, S |
-2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na2[Fe(CN)5NO] |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
CdCl2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
SO |
|
-2, SO |
|
-2, S O -2 |
|
|
|
|
|
|
|
CdS |
|||||
4 |
3 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
||
SrCl2
|
S2O3-2 |
|
SrSO4 , SrSO3 |
[J |
-] |
+ 2M HCl |
+ 2M HCl |
|
3 |
|
|
знебарвл. S |
, SO2 |
[J3-] |
|
|
|
|
знебарвл. |
|
|
|
SrSO4 |
Питання для самостійної підготовки студентів до заняття
1.В якій послідовності осаджуються хлорид-, бромід-, та йодид-іони при дії групового реактиву на другу аналітичну групу ?
90
