
- •Содержание
- •Тематический план лекций и практических занятий по вариативной части «Биологически активные вещества и реакции в жизнедеятельности» для студентов 1 курса специальности «Лечебное дело», 1 семестр
- •Общие правила выполнения лабораторных работ.
- •Правила техники безопасности
- •Первая помощь при несчастных случаях
- •Занятие №1 Реакции электрофильного присоединения и замещения в органической химии
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №2 Реакционная способность спиртов, эфиров, фенолов и их тиоаналогов
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Образец билета входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №3 Кислотно-основные свойства органических соединений
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №4 Биологически важные реакции карбонильных соединений
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Карбоновые кислоты и их функциональные производные
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №6 Контрольная работа по модулю «Химические основы биологического взаимодействия органических соединений»
- •Образец билета
- •Занятие №7 Гетерофункциональные соединения
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №8 Пятичленные гетероциклические соединения
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №9 Шестичленные гетероциклические соединения
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №10 α-Аминокислоты. Пептиды. Белки
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №11 Моносахариды
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №12 Ди- и полисахариды
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Образец билета
- •Занятие №14 Нуклеиновые кислоты. Нуклеотидные коферменты
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №15 Омыляемые липиды
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №16 Неомыляемые липиды
- •3. Материалы для самоподготовки к усвоению данной темы.
- •6. Оснащение рабочего места:
- •7. Содержание занятия
- •7.1. Типовой билет входного контроля
- •7.2 Узловые вопросы, необходимые для усвоения темы занятия
- •7.3 Лабораторная работа
- •7.4. Контроль усвоения темы занятия
- •7.5 Подведение итогов занятия
- •Занятие №17 Зачетное занятие
- •Образец билета
- •Литература
7. Содержание занятия
7.1. Типовой билет входного контроля
1. Общее определение кислот Бренстеда;
1) содержат карбоксильную группу;
2) окрашивают лакмус в красный цвет;
3) отщепляют протон в присутствии оснований;
4) взаимодействуют с растворами щелочей.
2. Установите соответствие:
Кислота Формула
ОН-кислота Бренстеда А) СН3СООН В) С2H5SC2H5
кислота Льюиса Б) FeCl3 Г) C2H5Br
3. Наиболее сильная кислота в растворе
1) СН3ОН;
2) С2Н5ОН;
3) (СН3)2СНОН;
4) Н2О.
4. Факторы, оказывающие влияние на стабильность сопряженных оснований (анионов)
1) влияние растворителя;
2) электронные эффекты заместителей;
3) электроотрицательность элемента в кислотном центре;
4) стабилизация аниона за счет сопряжения.
5. Соединения, образующие межмолекулярные водородные связи
1) С6Н13ОН;
2) С6Н5SН;
3) СН3СН2ОСН3;
4) СН3СН2СООН.
7.2 Узловые вопросы, необходимые для усвоения темы занятия
1. Кислотность органических соединений по Бренстеду-Лоури (ОН, SH, NH, CH-кислоты). Примеры.
2. Основность органических соединений по Бренстеду-Лоури (аммониевые, оксониевые, сульфониевые и -основания).
3. Кислотность и основность по Льюису.
4. Принцип жестких и мягких кислот и оснований (ЖМКО).
7.3 Лабораторная работа
Опыт 1. Образование фенолята натрия и разложение его кислотой
В пробирку поместите несколько капель воды, кристалл фенола и встряхните. К возникшей мутной эмульсии добавьте по каплям 10% раствор гидроксида натрия до образования прозрачного раствора. Напишите уравнение реакции получения фенолята натрия. Добавьте несколько капель соляной кислоты к раствору фенолята натрия. Что при этом наблюдается? Напишите уравнение происходящей реакции.
Опыт 2. Основность алифатических и ароматических аминов
В две пробирки внесите по 2 капли воды. Затем в первую поместите каплю анилина, а во вторую – каплю диэтиламина, и взболтайте. Сравните растворимость этих аминов в воде. По 1 капле содержимого каждой пробирки нанесите на полоску универсальной индикаторной бумаги или красного лакмуса. Определите рН растворов анилина и диэтиламина.
7.4. Контроль усвоения темы занятия
Образец билета выходного контроля
1. Дайте определение понятий «кислотность» и «основность» по Бренстеду-Лоури.
2. Расположите следующие спирты в ряд по уменьшению кислотности: метиловый, трет-бутиловый, изопропиловый. Обоснуйте свой ответ, основываясь на стабильности соответствующих анионов.
Вопросы и упражнения для аудиторной работы
1. Расположите в ряд по уменьшению кислотности следующие соединения:
а) этанол, этантиол, этиламин;
б) фенол, п-нитрофенол, п-аминофенол;
в) этанол, пропанол-2, метанол, 2-метилпропанол-2.
Обоснуйте решение, исходя из стабильности анионов.
2. Глицерин взаимодействует с гидроксидом меди (II), а пропанол-1 – нет. Дайте объяснение различию в кислотности и напишите схему реакции.
3. Сравните основность каждой из следующих групп соединений:
а) аммиак, анилин, дифениламин, трифениламин;
б) анилин, п-аминофенол, п-аминобензойная кислота;
4. Чем больше основность простых эфиров, тем легче они расщепляются под действием сильных минеральных кислот. Какое соединение расщепляется легче – диэтиловый эфир или фенилэтиловый эфир (фенетол)?
5. Укажите в молекуле α-аминокислоты тирозине кислотные центры и определите порядок уменьшения их кислотности.
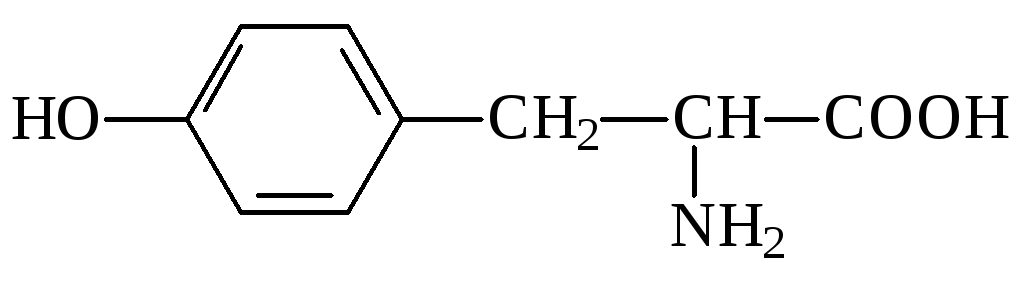
6. В качестве первого антидота при отравлениях соединениями мышьяка был предложен 2,3-димеркаптопропанол. Какие кислотные центры в его молекуле преимущественно участвуют в образовании солей мышьяка?
7. Ощущение сладкого вкуса возникает при одновременном наличии в соединении слабых кислотного и основного центров, находящихся на определенном расстоянии друг от друга и образующих водородные связи с вкусовыми рецепторами. Укажите кислотные и основные центры в молекуле 5-нитро-2-пропоксианилина, который слаще свекловичного сахара в 3100 раз.
