
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
Домашняя работа №1
Нертымова Анна
1. Для атома германия написать электронную формулу; указать электронно-графическую формулу; для последнего электрона указать значения всех четырех квантовых чисел.
2. Описать в терминах методов валентных связей (схем) молекулу C6H6. Характеристика иона CN- в терминах метода молекулярных орбиталей.
3. На нейтрализацию 50 мл раствора щелочи израсходовано 30 мл 0,2 н. раствора серной кислоты. Какова нормальность раствора щелочи? Сколько 0,1 н. раствора хлороводородной кислоты потребовалось бы для той же цели?
4. Вычислите температуру кипения водного раствора глюкозы (C6H12O6) с массовой долей 5%, Е=0,52.
5. Установлено, что равновесная смесь : SO2(г) + NO2(г) SO3(г) + NO (г) содержит 0,6 моль SO2, 0,2 моль NО2, 0,8 моль SO3, 0,3 моль NO в 1 литре. Вычислите константу равновесия этой реакции. Определите, сколько моль NO2 на 1 литр объема следует добавить в сосуд, чтобы концентрация NO увеличилась до 0,7 моль/л?
6. Подберите стехиометрические коэффициенты в уравнениях методом электронного баланса
NH3 + Br2 + H2O HNO3 + HBr

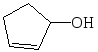
+ LiAlH4 + H2O + Li[Al(OH)4]
Домашняя работа №1
Степнов Дмитрий
1. Для атома селена написать электронную формулу; указать электронно-графическую формулу; для последнего электрона указать значения всех четырех квантовых чисел.
2. Составьте из предложенных ниже химических элементов формулы веществ с а) ионным; б) ковалентным типом связи: Сl, C, Si, K, F, H, O. Какое из веществ будет образовывать водородные связи?
3. Рассчитайте навеску для получения 250 мл водного раствора рибозы (C5H10O5) с массовой долей 2% и плотностью =1,02 г/мл.
4. Разбавленный раствор бромида алюминия и разбавленный раствор соляной кислоты кипят при одинаковой температуре. Массовая доля какого вещества- соли или кислоты больше в растворе? Объясните причины.
5. Вычислите степень диссоциации уксусной кислоты в растворе, в котором ее массовая доля равна 40% (плотность 1,05 г/мл), Ка=1,810-5.
6. Подберите стехиометрические коэффициенты в уравнениях методом электронного баланса
Na2S + K2Cr2O7 + H2SO4 ¾® S + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O
C6H12O6 + H2SO4 ¾® CO2 + SO2 +H2O
Домашняя работа №1
Чахова Надежда
1. По каким признакам различают s-, p-, d- и f- элементы? Приведите по 2 элемента из каждого семейства.
2. Укажите межмолекулярное взаимодействие (ориентационное, индукционное, дисперсионное), которое имеет место при а) растворении этилового спирта в воде; б) переходе азота в жидкое состояние.
3. Рассчитайте массы CuSO4×5H2O и воды необходимые для получения 90г 7% раствора, рассчитайте мольную долю растворенного вещества.
4. Разбавленные растворы рибозы и глюкозы имеют равные массовые доли воды. Какой из двух растворов кипит при более высокой температуре? Объясните причины.
5. Вычислите условия равновесия процесса:
СО2(г) + С(тв) = 2СО(г), Н° = +173 кДж/моль; S°= +176 Дж/(мольК).
6. Подберите стехиометрические коэффициенты в уравнениях методом электронного баланса
Si + NaOH + H2O Na2SiO3 + H2
(CH3)2C=CH-CH3 + K2Cr2O7 + H2SO4 ¾® (CH3)2CO + CH3COOH
