
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
- •Домашняя работа №1
Домашняя работа №1
Гарехт Ирина
1. Напишите электронные конфигурации атомов азота и брома и ионов N-3 и Br+5.
2. Описать в терминах метода валентных связей (схем) молекулу C2H6. Характеристика молекулы O2 в терминах метода молекулярных орбиталей.
3. Рассчитайте массы этиленгликоля и воды необходимые для получения 150г 8% раствора, рассчитайте его титр.
4. Разбавленные растворы сахарозы и глюкозы имеют равные массовые доли воды. Какой из двух растворов кипит при более высокой температуре? Объясните причины.
5. Вычислите условия равновесия процесса:
СО2(г) + С(тв) = 2СО(г), Н° = +173 кДж/моль; S°= +176 Дж/(мольК).
6. Подберите стехиометрические коэффициенты в уравнениях методом электронного баланса
SO2 + KMnO4 + KOH ¾® K2SO4 + K2MnO4 + H2O
CH3-CH2-CCH + O3 ¾® CH3-CH2-COOH + CO2
Домашняя работа №1
Горшков Никита
1. Для атома мышьяка написать электронную формулу; указать электронно-графическую формулу; для последнего электрона указать значения всех четырех квантовых чисел.
2. Описать в терминах метода валентных связей (схем) молекулу C2H4. Характеристика иона O2- в терминах метода молекулярных орбиталей.
3. Рассчитайте массы Na2SO4×10H2O и воды необходимые для получения 100г 5% раствора, рассчитайте его молярность.
4. Имеются два раствора с одинаковой молярной концентрацией: мочевины и хлорида кальция. Какой из этих растворов имеет большее осмотическое давление (при одинаковой температуре)? Объясните причины.
5. Вычислите стандартную энтальпию реакции:
С6Н12О6(тв) = 2С2Н5ОН(ж) + 2СО2(г)
6. Подберите стехиометрические коэффициенты в уравнениях методом электронного баланса
CrCl3 + H2O2 + KOH K2CrO4 + KCl + H2O
CH3-CH=CH2 + K2Cr2O7 + H2SO4 CH3-COOH +HCOOH + Cr2(SO4)3 + K2SO4 +H2O
Домашняя работа №1
Карпова Анна
1. Для атома молибдена написать электронную формулу; указать электронно-графическую формулу; для последнего электрона указать значения всех четырех квантовых чисел.
2. Описать в терминах методов валентных связей (схем) молекулу BeH2 Характеристика молекулы N2 в терминах метода молекулярных орбиталей
3. Рассчитайте массы CuSO4×5H2O и воды необходимые для получения 100г 5% раствора, рассчитайте мольную долю растворенного вещества.
4. Водные растворы мочевины и сахарозы разделены полупроницаемой мембраной. Направленного переноса растворителя через мембрану не происходит. Какой из растворов имеет большее значение массовой доли растворенного вещества?
5. Вычислите степень диссоциации уксусной кислоты в растворе, в котором ее массовая доля равна 10% (плотность 1,01 г/мл), Ка=1,810-5.
6. Подберите стехиометрические коэффициенты в уравнениях методом электронного баланса
SnSO4 + KMnO4 + H2SO4¾® MnSO4 + K2SO4 + Sn(SO4)2 + H2O

C6H5-(CH2)4-CH2OH + Pb(CH3COO)4 ¾® + Pb(CH3COO)2 + CH3COOH
Домашняя работа №1
Лаврентьев Денис
1. Для атома рубидия написать электронную формулу; указать электронно-графическую формулу; для последнего электрона указать значения всех четырех квантовых чисел.
2. Описать в терминах методов валентных связей (схем) молекулу C5H5N. Характеристика иона O22- в терминах метода молекулярных орбиталей
3. Рассчитайте массы этилового спирта и воды необходимые для получения 450г 25% раствора, рассчитайте его моляльность.
4. Вычислите осмотическое давление раствора сахарозы (C12H22O11) с массовой долей 3% (плотность 1,006 г/мл) при 25°С.
5. Вычислите стандартную энтальпию хемосинтеза, протекающего в автотрофных бактериях Thiobacillus thioparus:
5Na2S2O35Н2O(т) + 7O2(г) = 5Na2SO4(т) + 3Н2SO4(ж) + 2S(т) + 22Н2О(ж)
6. Подберите стехиометрические коэффициенты в уравнениях методом электронного баланса
SO2 + KMnO4 + H2O MnO2 + K2SO4
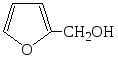
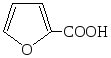
+ NaOCl ¾® + NaCl
