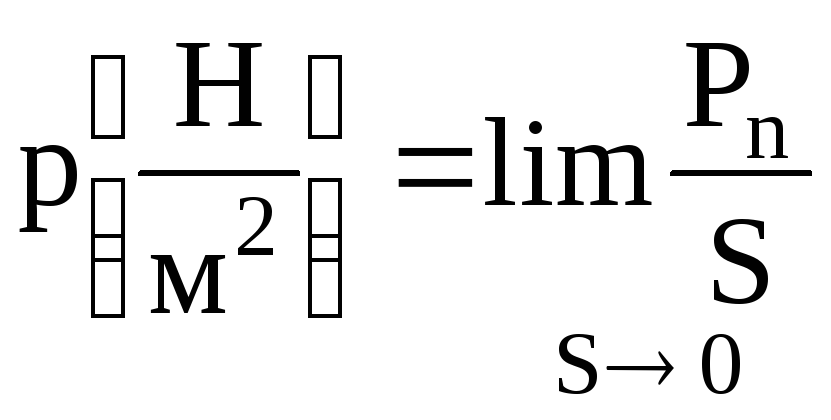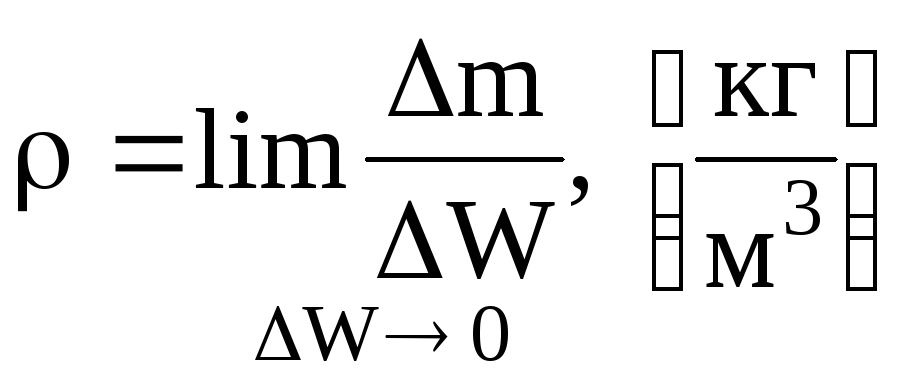- •Лекция 1
- •1. Введение в механику жидкости и газа
- •1.1. Науки и технические дисциплины, изучающие поведение жидкостей и газов
- •1.2. Основные понятия механики жидкости и газа
- •1.3. Необходимые сведения из равновесной термодинамики
- •1.3.1. Параметры состояния термодинамического тела. Уравнения состояния
- •1.3.2. Первый закон термодинамики
- •1.3.3. Понятие теплоемкости
- •1.3.4. Функции состояния Внутренняя энергия
- •Энтальпия
- •1.3.5. Второй закон термодинамики
- •1.3.6. Функции процесса
- •1.3.7. Скорость звука
1.3. Необходимые сведения из равновесной термодинамики
При выводе и преобразовании уравнений, описывающих движение и изменение состояния газа, нам потребуются некоторые основные сведения и понятия из равновесной термодинамики.
Термодинамика – наука о превращениях различных видов энергии из одного в другой, о наиболее общих макроскопических свойствах материи. При этом она оперирует не с параметрами, характеризующими состояние микрочастиц вещества, а с параметрами, определяющими состояние вещества в целом.
1.3.1. Параметры состояния термодинамического тела. Уравнения состояния
Состояние равновесного термодинамического тела (элемента сплошной среды) характеризуется совокупностью значений определенных величин – параметров состояния (см. табл. 1.1.).
Параметры состояния
Таблица 1.1
|
№ п/п |
Наименование |
Определение параметра |
Размерность |
|
1 |
Абсолютная температура |
Характеризует степень нагретости тела. Определяет интенсивность хаотического (теплового) движения молекул. Температура является статическом величиной, характеризующей свойства совокупности большого числа молекул. |
T, K = t C + 273 Определяется путем непосредственного измерения. |
|
2 |
Абсолютное давление |
Физическая величина, равная пределу отношения нормальной составляющей силы давления к площади, на которую эта сила действует. |
1 ат (техн) = 98100 Па = 735,6 мм.рт.ст = 104 мм. вод. ст. = = 0,98 бар 1 физ. атм. = 760 мм. рт. ст |
|
3 |
Плотность
(удельный объем) |
Масса рабочего тела, заключенная в единице его объема. Величина обратная плотности |
|
Между параметрами состояния существует определенная функциональная связь, называемая уравнением состояния. Для газовой среды конкретный вид уравнения состояния определяется физической природой рабочего тела и областью изменения параметров состояния, допускающей считать газ идеальным или реальным.
Идеальным считается газ, для которого можно пренебречь силами межмолекулярного взаимодействия и собственно объемом молекул в сравнении с объемом, занимаемым газом. В этом случае, уравнение состояния записывается в форме Менделеева-Клапейрона (газ идеальный в термодинамическом смысле):
![]() ,
или p
= RT, (1.1)
,
или p
= RT, (1.1)
где
![]() Дж/(кгК)
– газовая постоянная; R
= 8314 Дж/(кмольК)
– универсальная газовая постоянная;
, кг/кмоль – молекулярная масса газа.
Дж/(кгК)
– газовая постоянная; R
= 8314 Дж/(кмольК)
– универсальная газовая постоянная;
, кг/кмоль – молекулярная масса газа.
Иногда в литературе пользуются понятием идеальная жидкость. Это такая условная жидкость, которая считается совершенно несжимаемой, нерасширяющейся и обладает абсолютной подвижностью частиц (невязкая и нетеплопроводная жидкость).
Существенные отличия свойств идеального газа от реального проявляются при высоких давлениях и низких температурах, когда фазовое состояние газа близко к жидкому. В этом случае, используется одна из форм уравнения состояния реальной среды. На практике чаще всего используется уравнение состояния в форме Ван-дер-Ваальса, или уравнение с вириальными коэффициентами.
Уравнение состояния в форме Ван-дер-Ваальса:
![]() , (1.2)
, (1.2)
где
![]() и
– поправки, учитывающие реальные
свойства среды;
и
– поправки, учитывающие реальные
свойства среды;
![]() – поправка, учитывающая силы
межмолекулярного взаимодействия;
– поправка, числено равная объему,
занимаемому молекулами при их плотной
упаковке.
– поправка, учитывающая силы
межмолекулярного взаимодействия;
– поправка, числено равная объему,
занимаемому молекулами при их плотной
упаковке.
Уравнение состояния с вириальными коэффициентами:
![]() , (1.3)
, (1.3)
где B1, B2, B3 ... – вириальные коэффициенты, являющиеся функцией температуры.